电石渣及二氧化碳资源化利用现状与展望*
2022-02-24曹春霞成怀刚程芳琴潘子鹤
曹春霞,王 波,成怀刚,程芳琴,潘子鹤
(山西大学 资源与环境工程研究所,CO2减排与资源化利用教育部工程研究中心,山西 太原 030006)
0 引言
电石的主要成分是碳化钙(CaC2),是生产聚氯乙烯(PVC)、石灰氮、双氰胺以及溶解乙炔等的主要原料,其中最主要的用途是生产PVC。据统计,在中国有超过25%的PVC都是通过电石法生产的,而且将近70%的电石都用于PVC的生产[1],我国已成为世界上最大的电石生产和消费基地[2]。使用电石生产PVC、聚乙烯醇和溶解乙炔都会产生大量的电石渣(CCR)。CCR作为电石的水解产物,主要成分是CaO,此外还含有少量Al2O3、SiO2和Fe2O3等杂质[1]。反应原理是CaC2与水反应生成乙炔气和Ca(OH)2,并释放能量[3]。
据统计,2019年国内电石的累计消耗量为2 122.6万t,按电石与CCR的质量比为1∶1.2计算,2019年产生的CCR约为2 655.12万t[4]。CCR作为工业固体废弃物,其含水率低、颗粒小并具有较高的反应活性,而且溶于水后pH在12以上,因此随意堆放不仅会占用土地、造成土地盐碱化及复耕困难,还会随雨水进入地下而污染地下水。除此之外,CCR作为一般的固体废弃物,在运输过程中会产生扬尘,污染环境。早期,CCR未能得到充分利用,大多就近填埋处置,不仅破坏了水、大气和土壤环境,而且还造成了资源浪费。
近年来,由于在资源开采过程中带来了很多环境问题,随着环境管理的日趋严格,一些不可再生资源(如石灰石)的开采已经停止。与此同时,大量的工业固体废弃物作为一种潜在的矿产资源受到了广泛关注。CO2作为温室气体,浓度高会导致全球海平面上升、淡水资源减少、出现极端气候,威胁人类健康。因此,寻找将CO2转化为有用产品的方法,不仅可以刺激新技术、新产品和工业的发展,并有助于CO2的减排和控制。CCR作为固体废弃物,可以代替石灰石生产建筑材料和化工产品等,实现资源的循环利用。如将CCR和CO2发生碳化反应生成的CaCO3可以代替部分石灰石,从而提高CCR的利用价值。相关研究表明[5],1 t CCR可代替1.28 t石灰石,减少排放0.56 t的CO2,可以达到“以废治废”的目的。
1 CCR综合利用现状
1.1 CCR在建材行业中的应用
CCR富含Ca(OH)2,分解热低,通过煅烧或者用其与高炉渣、稻壳灰和粉煤灰等固体废弃物混合,可取代石灰石生产水泥、保温材料、粉煤灰砖、改良膨胀土以及冷沥青混合料等,既降低了能量消耗,又减少了石灰石煅烧过程中CO2的排放,还能实现CCR的多重资源循环利用,减少环境污染。
CCR在建材行业中的应用现状见表1。
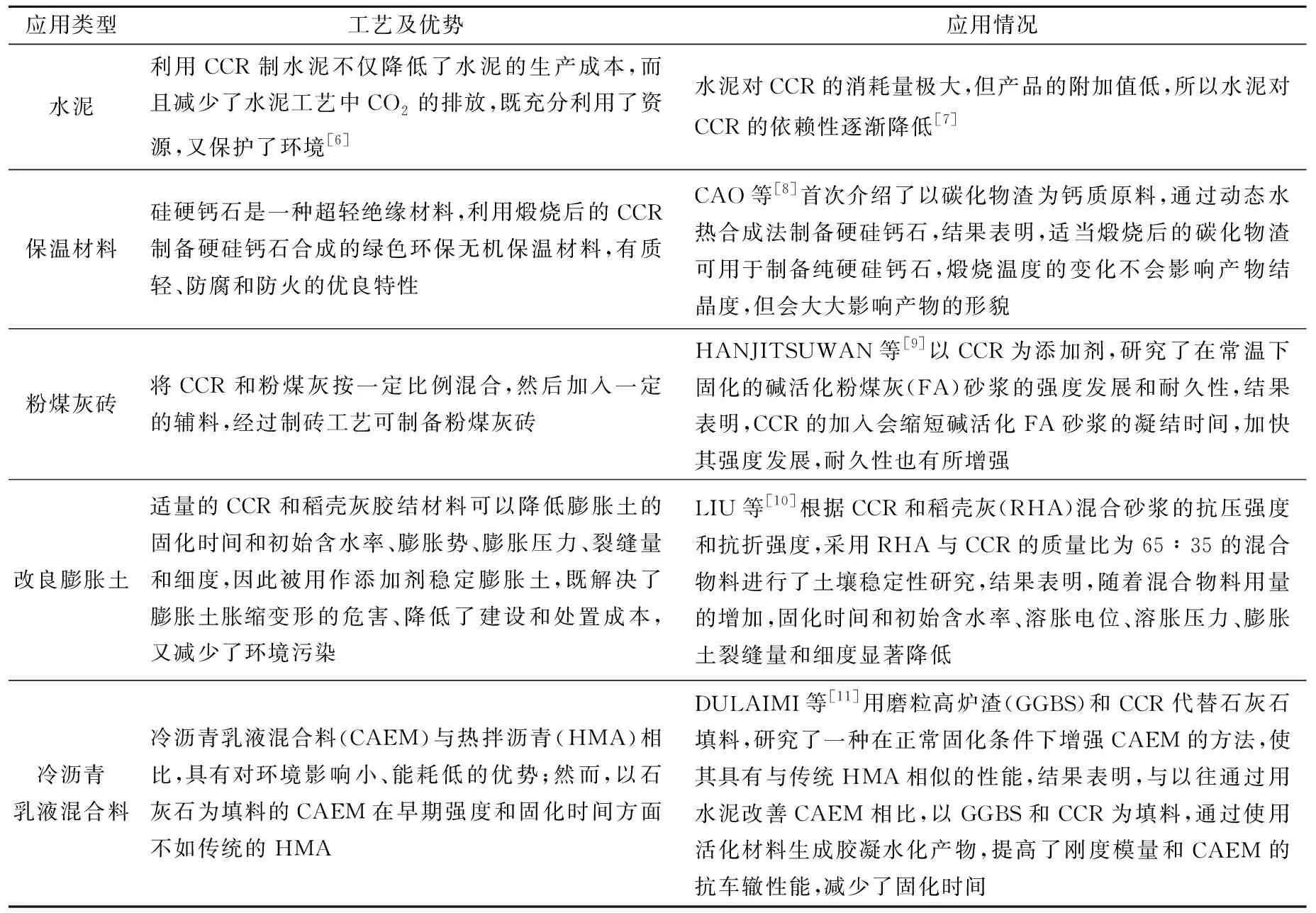
表1 CCR 在建材行业中的应用
1.2 CCR在环保行业中的应用
CCR除了在建材行业应用广泛以外,因其理化性质也被应用于烟气脱硫以及作为化学吸附剂处理工业废水等。CCR富含钙,并且碱度高,可以通过磷酸钙沉淀去除磷酸盐,而且可以作为烟气的脱硫剂,最终以硫酸钙的形式将SO2从烟气中脱除。
CCR在环保行业中的应用现状见表2。

表2 CCR 在环保行业中的应用
1.3 CCR在化工行业中的应用
将CCR应用于化工行业,既可以获得可观的经济效益,又可以保护环境。
CCR的主要成分是Ca(OH)2,可以用于制备太阳能的化学蓄热材料、纯碱、氯化钙、环氧丙烷、甲酸钙[Ca(HCOO)2]以及纳微孔硅酸盐气凝土[15]等。
CCR在化工行业中的应用现状见表3。

表3 CCR 在化工行业中的应用
2 CO2 的处置及利用技术
2.1 CO2的捕集、利用和存储技术
随着工业的迅速发展,化石燃料使用量也日益增加,大气中的CO2越来越多。为了加强对CO2的减排和控制,诸多碳捕获利用和存储技术得到了开发及应用。在CO2捕获和存储以及利用的过程中,CO2首先从化石燃料燃烧的废气中被捕获,通过其他技术净化,然后被隔离或转化为具有环境、经济和社会效益的有价值的产品。
CO2捕获技术主要分为化学吸收法[23]、膜分离和固体吸附法。在化学吸收法中,胺溶液吸收CO2因效率高、选择性强且成本低而备受欢迎;但是在CO2解吸和溶剂再生过程中的能耗和成本都较高,此外,由于高温引起的胺溶液降解、设备腐蚀等问题仍未解决[24]。固体吸附剂通常包括金属-有机骨架、沸石、活性炭和工程碳纳米材料等。PINHEIRO等[25]以废大理石粉末为钙基材料,进行了10、20次循环碳酸化煅烧反应,结果表明,该材料是一种潜在的天然低价固体吸附剂,可作为一种有效的CaO基吸附剂捕获CO2,并减少了对原料的额外预处理。近年来,煅烧石灰石和白云石得到的CaO的碳化/煅烧循环是捕获燃煤发电厂产生的CO2的一种很有前途的技术[26]。在多孔碳吸附剂表面添加金属氧化物或氢氧化物并通过增加比表面积、提高材料碱度,甚至通过与CO2的反应促进碳酸盐的产生等均可以提高CO2的捕获能力[27]。但是,碳基吸附剂用于燃烧后CO2捕获的研究仍处于起步阶段,大规模应用还需进一步研究[28]。
CO2物理封存主要包括地质储存、海洋封存、工业利用和矿化封存等。地质储存就是向沉积盆地等地下储层注入气态、液态或超临界CO2,随着时间的推移,溶解在地下水中或者与地下岩石反应生成稳定的碳酸盐矿物,但是该方法存在周期长、储存库少以及有逸散等缺点[29]。海洋封存分为液态封存和固态封存[30],液态封存就是将液态CO2封存在海洋中,固态封存就是将固体和水合物形式的CO2封存在海洋地质构造中。CO2在工业中的利用包括化学品生产、生物利用、食品饮料以及油与煤层气的开采。CO2可以作为合成化学品的基础原料[31],利用CO2可以合成一些常见的化学品,如尿素[32]、甲烷[33]、甲醇[34]和水杨酸等。除此之外,通过CO2和环氧丙烷的共聚,可制备一种聚氨酯泡沫,其与常规泡沫具有相同的稳定性,这也是CO2利用的一种新途径[35]。在食品和饮料加工行业中,CO2可以作为酸化剂。此外,利用植物和自养微生物对CO2进行生物固定也是一种安全、经济有效的方法。有研究[36]指出,1 kg的藻类可固定约1.83 kg的CO2。枯竭的油藏、页岩地层和无法开采的煤层中,注入CO2可以进行三级采收,提高油和煤层气的采收率。这些方法虽然可以在一定程度上减少CO2的排放,但是还远远达不到CO2控制目标。因此,有学者提出了CO2利用的新途径——矿化封存。工业排放的CO2可以通过矿化过程得到有效利用,形成各种产物或碳酸盐沉淀。与天然矿物相比,工业固体废弃物廉价、易得,因此利用固体废弃物直接或间接减少CO2排放是一种很有潜力的发展方向[37]。现有的碱性工业固体废弃物有钢渣、粉煤灰、CCR等,它们通常含有大量的碱土金属,可作为CO2矿化的合适原料[38]。刘项等[39]以“一步矿化法”为基础,以磷石膏为原料、氨为介质,与CO2反应生成了硫酸铵和碳酸钙;通过该技术,当加入1 t磷石膏进行反应时,可矿化0.25 t的CO2,同时产生0.78 t的硫酸铵和0.58 t的碳酸钙,既减少了温室气体的排放,又使资源得到了循环利用。WANG等[40]将CO2通入脱硫石膏悬浮液,合成了超细球霰石,研究了氨浓度、CO2流量、固液比对石膏碳化过程、矿物相组成、碳酸钙形态和粒径分布的影响,结果表明,氨浓度、CO2流量对碳化过程有显著影响,综合反应方程式为
CaSO4·2H2O+CO2(g)+2NH4OH(aq)→
(NH4)2SO4+CaCO3(s)+3H2O。
2.2 矿化反应机理
CO2矿化的概念最早由SEIFRITZ在1990年提出。该反应主要是以自然界中岩石风化并吸收CO2的过程为基础,模仿并加快了这一反应进程,即CO2与水反应生成CO32-以及HCO3-,然后与碱性矿物发生中和反应,使得CO2被固定,得到稳定的固态碳酸盐。矿化的实现方式主要分为以下4种[41]:
①直接碳化,即将CO2与碱性浆料或混合物放在单一反应器中反应; GARCA-CARMONA等[42]在Ca(OH)2-H2O-CO2体系中,以及不添加任何添加剂的情况下,通过调节熟石灰碳化过程中的电导率和温度,得到了不同形貌和尺寸的方解石,碳化反应方程式为
Ca(OH)2+CO2→CaCO3+H2O 。
②间接碳化,即先通过多个步骤提取与生产碳酸钙有关的离子,然后再进行碳化反应; MURNANDARI等[43]以各种醇胺作为CO2吸收剂,使其转化为CO32-,然后加入氯化钙,进行碳化反应生成碳酸钙,结果表明,在被测的醇胺中,以2-氨基-2-甲基-1-丙醇为吸收剂时,CaCO3的产率最高。
③碳化养护是一种混凝土辅助养护技术,其通过加快混凝土中水化矿物的反应进程,进一步增强混凝土的强度,改善其内部的微观结构,增加了混凝土对周围环境不利因素的抵抗力[44]。WANG等[45]在水泥中掺合了硅酸钙,研究结果表明,掺合硅酸钙后的水泥不仅提高了矿物碳化过程中CO2的吸收速率,而且增强了水泥组分的碳化转化,矿物碳化固化对水泥浆体的抗压性能也有显著的改善效果。
④电化学矿化,即利用电化学电池在产生氢的同时对CO2进行矿化。郑林泽[46]通过电化学方法,利用阴极生成的OH-和阳极生成的H+构建CO2捕集和回收工艺;通入含有CO2的空气后,CO2被溶液中阴极产生的OH-吸收生成HCO3-和CO32-,然后通过阳极产生的H+实现CO2的回收。
3 NCC 的特性及制备
功能纳米和微尺寸材料的设计因其在工业和生物技术领域的应用而受到广泛关注。NCC是在20世纪80年代后发展起来的一种无机非金属材料,有方解石、文石和球霰石三种不同形貌的无水晶体结构,粒径在1~100 nm[47]。与普通CaCO3相比,NCC的粒径分布相对较窄,而且具有表面效应、小尺寸效应、量子尺寸效应以及宏观量子隧道效应[48]。
3.1 NCC的用途
NCC具有无毒、易于表面改性等优良特性,被广泛应用于材料填充、食品加工、环境以及医学[49]等行业。NCC在塑料和橡胶工业中的应用非常广泛,将NCC与聚合物共混在降低成本的同时,不会显著降低其拉伸强度。FANG等[50]研究了NCC的形貌以及粒径分布对天然橡胶硫化胶力学性能和动态性能的影响,结果表明,球形NCC可以增强橡胶复合材料的机械强度,用粒径30 nm的NCC制备的橡胶复合材料比用粒径50、80 nm的NCC制备的橡胶复合材料拥有更好的机械性能,NCC的晶体结构及其粒径对橡胶复合材料的动态性能也有显著影响。环氧树脂因其优异的热稳定性、机械响应、低密度和电阻等性能,在各个行业中得到了广泛应用;但其具有高交联密度的缺点,通过加入纳米粒子,可以有效提高环氧树脂的各项性能指标,如刚度、强度和韧性。在食品加工方面,CaCO3通过热处理转化为CaO,有抗菌的效果,CaO水化引起的碱性效应被认为是壳粉浆中杀菌作用的主要机制之一[51]。CHOI等[52]利用牡蛎壳粉作为中和剂对泡菜发酵和品质的影响进行了研究,牡蛎壳粉的主要成分是CaCO3,既节约了生产成本,又实现了资源的循环利用;研究结果表明,0.5%壳粉的加入会显著提高泡菜的酸度、脆度和整体品质,并且0.5%壳粉处理的泡菜的苦味也会有所降低,除此之外,还提高了泡菜的保质期和保存质量。在环境水处理方面,CaCO3可以作为吸附剂,吸附水中的重金属。LIN等[53]利用废弃的牡蛎壳制备了球霰石微粒,然后研究了球霰石对几种金属离子的去除效率,结果表明,球霰石微粒对所有被测试的重金属离子都表现出了优异的去除性能,尤其是对Pb2+的去除效果可达99.9%;该方法制备的碳酸盐颗粒具有价格低、合成方便、环境废物少等优点。在医学行业,NCC由于其具有良好的生物相容性和生物降解性,可以作为药物载体进行药物传递,现已成为最常用的生物医学应用材料之一。ELBAZ等[54]使用多层聚电解质制备了新的刺激响应的亚微米直径多层纳米胶囊,在模拟胃肠道pH的条件下,对胶囊中NCC负载药物姜黄素的刺激反应进行了药物释放评估,在第五层和第六层的pH反应行为实验中,显示药物在胃中会不被释放,而是在肠道中释放。
3.2 NCC的制备
NCC的制备可根据反应过程的不同分为物理法和化学法[55]。物理法制备的NCC形状不规则,粒径大,所以应用不广泛。化学法分为仿生法、凝胶法、乳液法以及碳化法等。需要根据各个行业的不同需求使用不同的方法制备NCC。仿生法就是试图通过使用可溶性有机物和生理参数来模仿大自然合成各种形状和大小的CaCO3,如模仿贝壳、牡蛎壳的形成等[56]。TAKEUCHI等[57]通过研究证明了阿司匹林可以在体外控制CaCO3的晶型,文石优先在富含Ca2+的溶液中形成,阿司匹林的加入则会诱导方解石的形成。利用凝胶法可以制备不同形状和结构的NCC。胶体颗粒可以用作凝聚态物理模型、支架模板,或作为创建分层纳米或微米级体系结构的基础。使用预成形的物体作为模板不仅可以改变颗粒的化学组成,而且还可以定义粒子的形状,从而复制所用模板的结构[58]。KUANG等[59]在聚异丙基丙烯酰胺-CO(4-乙烯基吡啶)水凝胶中实现了CaCO3的原位矿化,制作了具有盘状、纤维状和半球状的无机-有机复合颗粒;这种方法唤起了以生物启发的方式来创建具有定义的尺寸和复杂几何形状的无机-有机复合颗粒。微乳液也被称为纳米乳液,用于合成纳米颗粒,被用作纳米反应器和帮助控制产品颗粒的生长和核化。BADNORE等[60]使用超声波细胞粉碎机制备反相细乳液技术合成了NCC,与常规方法合成的NCC相比,通过超声化学方法获得的CaCO3颗粒尺寸约为20 nm。超声控制技术是一种非常有效且快速的合成方法,可以控制粒径和形态,从而总体上减少反应时间和能量。碳化法是一种在含Ca2+的悬浮液中直接通入CO2,通过碳化得到CaCO3浆体,最终制得NCC的方法[61];该方法工艺简单、成熟,是目前应用最广泛的NCC制备技术。
4利用CCR矿化CO2 制备NCC
4.1 NCC的制备方法
CCR矿化CO2制备NCC是高效利用CCR的方法之一。利用CCR制备NCC,一方面可以保护环境,另一方面可以在节约CaCO3生产成本的同时实现资源的循环利用。
目前,利用CCR生产CaCO3的方法主要有两种:一种是复分解法,另一种是碳化法。复分解法是将碳酸盐溶液加入CCR的澄清悬浮液中,然后添加适宜的分散剂,使其充分混合,通过调整反应温度、Ca2+与CO32-浓度等条件制得NCC。碳化法是以CO2为碳化剂,与CCR水溶液发生反应制备NCC。碳化反应的主要方程式为
Ca(OH)2+CO2→CaCO3+H2O。
与复分解法相比,在CaCO3的制备过程中,CO2碳化法的沉淀生成速率较慢,工艺简单,容易控制,同时可在高Ca2+浓度下进行,产率高。
4.2 NCC的形成
在用CCR制备NCC的过程中为解决原料中杂质对产物形貌的影响,常用浸出剂对CCR进行纯化,常用的浸出剂为NH4Cl、丙酸等。碳化法中CaCO3的形成分为两步——晶核的形成和生长,晶核的形成是CO2溶于水中形成CO32-,达到一定临界值后会与溶液中的Ca2+发生反应,生成稳定的CaCO3团簇,随着CO32-的增加会促进团簇的形成,从而增加其与Ca2+的结合,最后成核[62]。
4.3 NCC形成的影响因素
1)过饱和度与温度
控制过饱和度可以控制成核的热力学生长速率。在碳化过程中,从沉淀相的溶解度可以看出成核阶段的不饱和及过饱和度。过饱和度越高,晶体成核速率越高,成核数量越多,CaCO3产品粒径越细[63]。另外,温度对CaCO3结晶的影响也很大[64]。温度的变化会影响Ca(OH)2、CO2以及CaCO3的溶解速率,从而影响CaCO3晶核的形成速率。温度升高,Ca(OH)2的溶解度减小,CaCO3溶解度增加,产物粒径增大[65]。
2)CO2流量
通过改变通入反应体系中的CO2流量,可以改变气液界面上的CO2分压,流量的减小会降低界面区CO32-浓度,从而导致过饱和度低,不利于CaCO3成核[66]。CO2流量的增加会起到搅拌和分散的作用,使晶体成核速率大于生长速率,从而使得产品粒度减小[67]。
3)化学添加剂
NCC在合成过程中会存在一些问题,如容易团聚、粒径分布较宽且不均匀等。通常,未经改性的NCC亲水疏油性不足。化学添加剂可以有效控制CaCO3尺寸和形貌[68-69],通过加入添加剂,可以改变CaCO3晶体的表面能,从而影响CaCO3晶体的稳定性,使得CaCO3形貌发生变化[70]。例如,有研究表明,柠檬酸盐分子有3个羰基,能强烈抑制球霰石的形成,从而有利于形成方解石[71-72];而Mg2+的掺入可以提高矿物的溶解度,抑制方解石的生长。CANTAERT等[73]研究发现阳离子聚烯丙基胺盐酸盐(PAH)对CaCO3的沉淀有显著影响,可以诱导碳酸钙薄膜和纤维的形成。CO32-诱导了PAH相分离,促进了聚合物PAH、Ca2+和CO32-的结合。
4)CCR中的杂质
CCR中的杂质主要有Fe2O3、Al2O3、MgO等。当CCR溶于水时,这些杂质随之进入反应体系,这些杂质不仅会影响所制样品的纯度、白度,而且还会通过改变晶体成核以及生长速率,从而使碳酸钙形成特定的形貌,如棒状、层状以及块状。但是目前对于CCR中杂质对产物形貌的影响规律以及反应机理尚不清楚,需要进一步探索与研究。
5 结语
利用CCR矿化CO2制备NCC是当前比较热门的废物资源化利用方向,是实现“以废治废”“变废为宝”的资源化路径,具有良好的环境效益、社会效益和经济效益。未来对于CCR的高效利用方式也会越来越多。本文介绍了CCR和CO2的来源及危害、循环利用途径,阐述了NCC的特性、制备方法及应用,详细介绍了CCR矿化CO2制备NCC的方法以及影响因素。虽然CCR矿化CO2实现了固体废弃物的资源化利用,但浸取剂的使用使得运行成本相对较高,而且矿化产物容易受到众多因素的影响,使得产物形貌、晶型难以控制。反应条件以及CCR中杂质对产物形貌的影响规律以及反应机理还需进一步探究。加入添加剂虽然能解决此问题,但是成本也随之增加,而且杂质的掺入不易去除,不能获得良好的经济效益,无法投入工业化生产。如何找到更优的CCR矿化CO2合成稳定的NCC技术、减少添加剂的使用,将是未来的研究方向。
