CAPN14通过促进CDK5蛋白的降解在口腔鳞癌中发挥抑癌作用
2022-02-24穆磊张红段晓波陈晓涛
穆磊 张红 段晓波 陈晓涛
口腔鳞状细胞癌(OSCC)是世界第八大最常见的癌症类型。在中国,口腔癌的发病率约为3/10 万人[1],且每年都在增长[2],与吸烟、酗酒及槟榔等密切相关[3]。对于口腔鳞癌经典的手术治疗结合放化疗药物辅助,但是其死亡率仍然很高,肿瘤转移是患者死亡的主要原因。因此,明确口腔鳞癌的转移机制已成为目前的热点问题[4]。
钙蛋白酶(Calpains,CAPNs)参与肿瘤组织进展的关键过程如增殖及转移等,目前已经有多种抗癌药物通过激活CAPNs诱导细胞毒性[5]。调控CAPNs家族蛋白可作为逆转口腔鳞癌进展的重要靶点[6]。本研究通过生物信息学方法发现在口腔鳞癌中,CAPNs表达异常,以CAPN14最为明显,且存在其潜在的相互作用蛋白CDK5。本研究分析了CAPN14在口腔鳞癌组织和细胞系中的表达特征,并对CAPN14对CDK5表达及细胞恶性行为的调控进行了探究。
1 材料与方法
1.1 材料与试剂
人正常口腔上皮细胞HOEC、口腔鳞癌细胞系SCC9、SCC25、CAL27(ATCC,美国); 胎牛血清FBS及DMEM/F12培养基(Gibco,美国); 青霉素-链霉素溶液、无酶水、异丙醇及无水乙醇(北京碧云天);嘌呤霉素、PVDF膜激活液、一抗稀释液、二抗稀释液及CCK-8试剂盒(北京索莱宝);放线菌酮、胰蛋白酶及阳离子聚合物(Sigma,美国);转染脂质体LipofectamineRNAiMAX Reagent(Thermo Scientific,美国);病毒包装质粒pLP1-gag/pol、pLP2-Rev及pLP-VSVG(Addgene,美国);Trizol、RNA逆转录试剂盒及SYBR Green核酸荧光染料(Takara,日本);CAPN14、CDK5、山羊抗兔-HRP及山羊抗鼠-HRP抗体(Abcam,美国)。
1.2 仪器与设备
DM500光学显微镜(徕卡,德国);Nanodrop2000c分光光度计(Thermo Scientific, 美国);多孔酶标仪(Molecular Devices,美国);凝胶成像仪、Real-time PCR仪(Bio-Rad,美国)。
1.3 细胞培养、细胞系的建立及实验设计分组
HOEC及SCC9、SCC25、CAL27在细胞75 cm2培养瓶中用培养基(DMEM/F12+10% FBS+1% 青霉素-链霉素溶液)培养,于37 ℃+5% CO2培养箱中培养。传代用胰酶消化, 1∶3传代并继续培养,选取对数生长期的细胞用作后续实验。
细胞实验分为4 组, 空白组:CAL27细胞未予以任何处理;对照组:CAL27细胞用对照载体进行转染; 过表达组:CAL27细胞用CAPN14过表达载体进行转染;回复组:过表达组细胞采用CDK5过表达载体进行转染。四组细胞处理后均加入10 μmol/L放线菌酮抑制细胞蛋白合成观察目的蛋白的降解速度[7-8]。
转染方法:10 μL LipofectamineRNAiMAX转染pLP1-gag/pol(每孔0.75 μg)、pLP2-Rev(每孔0.3 μg)和pLP3-VSVG(每孔0.45 μg)及目的载体(每孔1.5 μg)于人293T细胞中,收集病毒悬液, 0.22 μm过滤器过滤。接种CAL27细胞于60 mm培养皿中,DMEM/F12培养基+10%胎牛血清+1 mL病毒悬液培养,加入3 μL 聚凝胺,连续感染2 d,嘌呤霉素筛选后即获得相应细胞系。
1.4 CCK-8检测细胞的增殖能力
对数生长期的待测细胞以每孔5 000 个接种至96 孔板,培养24 h后,待细胞贴壁后,弃上清,加入生长培养基分别培养24、 48、 72 h,每孔加入10 μL CCK-8, 37 ℃+5% CO2孵箱中孵育2 h,多孔板酶标仪检测450 nm吸光度。计算各组细胞的相对增殖能力。
1.5 Transwell检测细胞侵袭能力
取Matrigel胶铺于4 孔Transwell上室面,每孔100 μL,风干后使用无血清DMEM/F12培养基水化。100 μL的4 组细胞悬液接种于上室面,每组细胞均接种2×105个。 24 h后轻轻擦掉上室面的细胞, 4%多聚甲醛固定15 min,0.1%结晶紫染色,进行细胞计数并进行统计学分析。
1.6 Western Blot检测CAPN14与CDK5蛋白表达
接种各组细胞于6 孔细胞培养板中, 5 μg/mL CHX处理细胞0、 6、 12 h,使用RIPA裂解液与蛋白酶抑制剂混合后冰上裂解各组细胞,加上样缓冲液煮沸10 min。选用β-actin作为内参。BCA试剂盒测定蛋白浓度,同时选取20 μL的目的蛋白先进行β-actin抗体的电泳(一抗浓度1∶400),比较各组之间的灰度值,进行调整进行CAPN14与CDK5的电泳。200 mA 90 min湿转至PVDF膜,TBSTw封闭液封闭1 h, 一抗 4 ℃过夜,二抗37 ℃ 1 h,发光液曝光显影。
1.7 qPCR检测组织与细胞中CAPN14和CDK5的表达
根据临床和病理标准,术中获得42 例口腔鳞癌患者肿瘤组织及癌旁组织。所有样本均在2019 年4 月~2019 年10 月本院口腔手术中进行采集。术中获取的组织标本保存于液氮中进行下一步实验操作。使用Trizol提取组织及细胞中的Total-RNA,提取完成后检测RNA纯度后。参考逆转录试剂盒说明书,将提取后的RNA进行逆转录,得到cDNA产物。根据PCR试剂盒说明加入设计完成的引物,行PCR反应,β-actin作为内参,并进行定量分析。
1.8 统计学方法

2 结 果
2.1 CAPN14在口腔癌中的生物信息学分析
TCGA数据库分析显示,多种CAPNs在头颈鳞癌(Head and neck squamous carcinoma,HNSC,口腔鳞癌已归类至HNSC中)组织中表达异常,CAPN14变化倍数最高,正常及HNSC组织中表达的中位数分别为18.974及0.510(P<0.001,图 1A~1B);STRING预测结果显示CAPN14与CDK5存在潜在的相互作用(图 1C);KMPLOT数据库分析结果显示高表达CAPN14的HNSC患者生存时间长于低表达患者(P<0.05,图 1D),而高表达CDK5的HNSC患者生存时间显著缩短(P<0.01, 图 1E)。
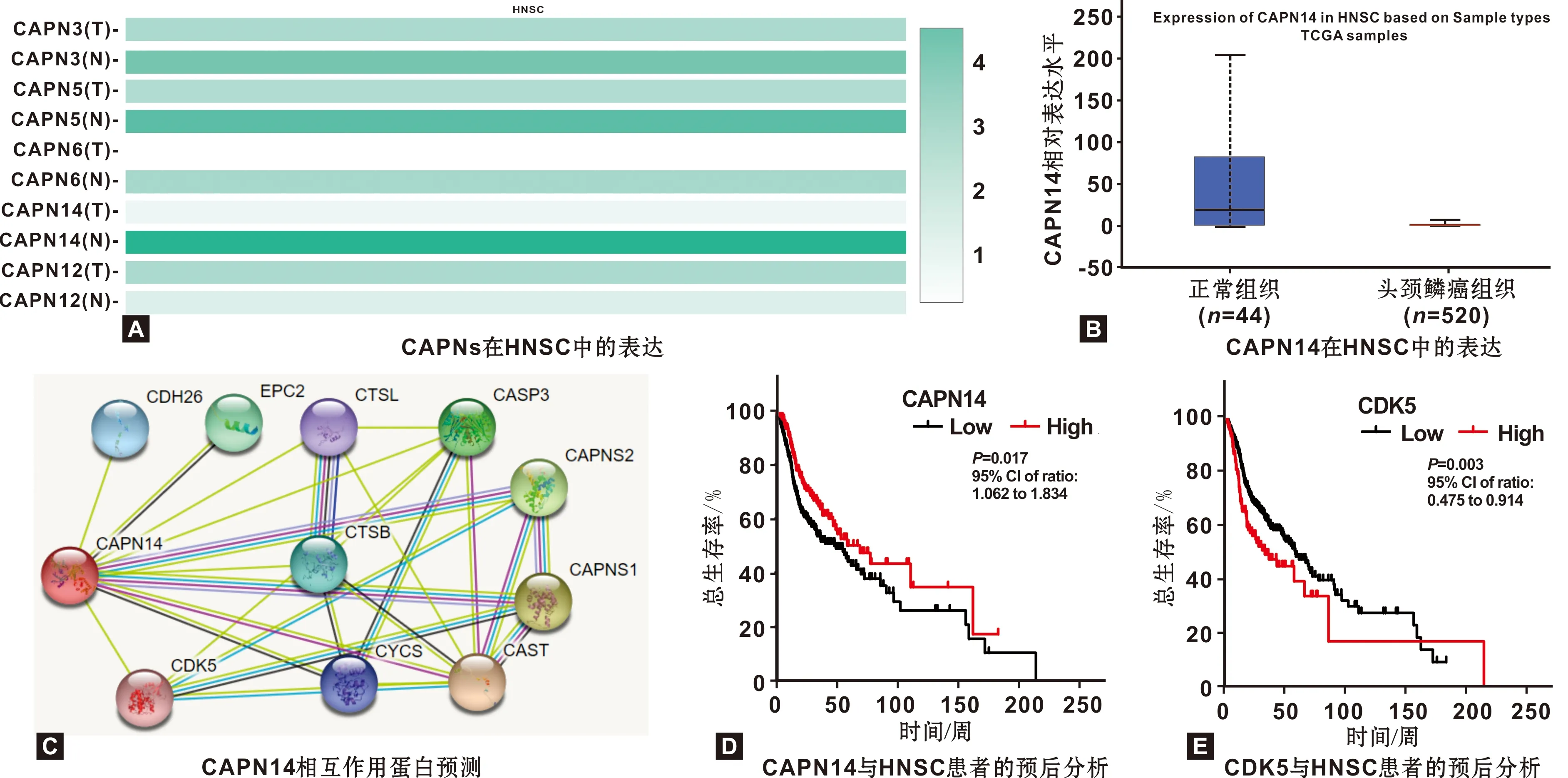
图 1 CAPN14在口腔癌中的生物信息学分析
2.2 口腔鳞癌组织与癌旁组织、HOEC、SCC9、SCC25、CAL27细胞中CAPN14表达及比较
qPCR结果提示:相比癌旁组织(0.07±0.01),口腔鳞癌组织中CAPN14的表达含量(0.16±0.01)较低(P<0.01);口腔鳞癌细胞系SCC9(0.55±0.09)、SCC25(0.74±0.06)、CAL27(0.36±0.04)中的CAPN14表达含量较正常口腔上皮细胞HOEC(1.00±0.08)低(P<0.01),以此为基础,选取CAPN14内源性表达量最低的CAL27细胞作为体外细胞实验模型(图 2)。
2.3 4 组细胞增殖能力及其比较
CCK-8法结果显示:相比对照组,过表达组细胞的增殖能力明显减弱(P<0.01);相比过表达组,回复组细胞的增殖能力明显增加(P<0.01)(图 3)。
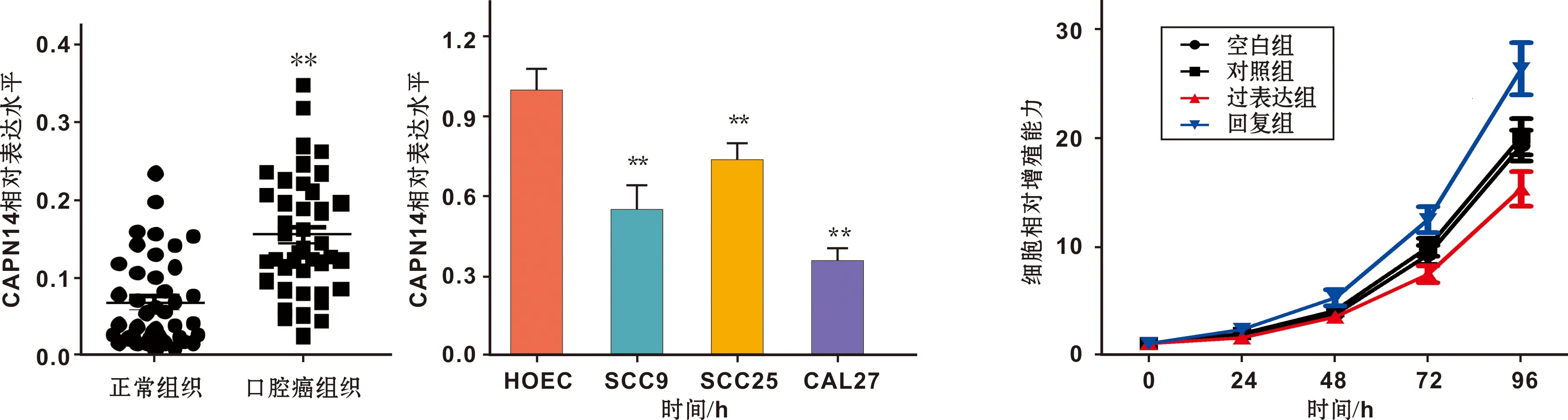
图 2 CAPN14在口腔鳞癌组织及细胞中的表达情况 图 3 4 组细胞增殖能力及其比较
2.4 4 组细胞侵袭能力及其比较
Transwell实验显示:相比对照组,过表达组侵袭细胞明显减少(P<0.01);相比干扰组,回复组的侵袭细胞明显增加(P<0.01)(图 4)。
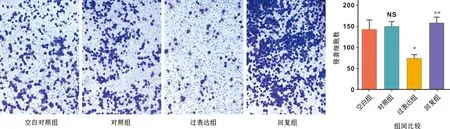
图 4 4 组细胞侵袭细胞及比较
2.5 4 组细胞中CAPN14与CDK5蛋白表达水平及其比较
Western blot结果显示:相比对照组,过表达组CDK5的蛋白表达水平显著降低,CDK5蛋白半衰期明显缩短;而相比过表达组,回复组细胞CDK5的蛋白表达水平显著增高,CDK5蛋白半衰期明显延长(P<0.01)(图 5)。
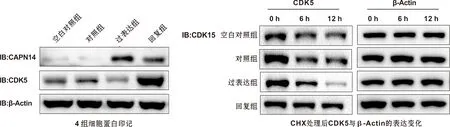
图 5 4 组细胞的CAPN14与CDK5蛋白表达含量及其比较
2.6 4 组细胞中CAPN14与CDK5基因表达水平及其比较
qPCR结果显示:空白组、对照组、过表达组及回复组细胞CAPN14的基因表达分别为1.06±0.14、1.00±0.10、14.34±1.51、16.25±2.04,CDK5的基因表达分别为1.13±0.09、1.00±0.07、1.24±0.13、5.89±0.63。相比对照组,过表达组及回复组细胞CAPN14的基因表达显著增高(P<0.01),而过表达组CDK5表达无显著变化(P>0.01),回复组CDK5表达显著增高(P<0.01)(图 6)。
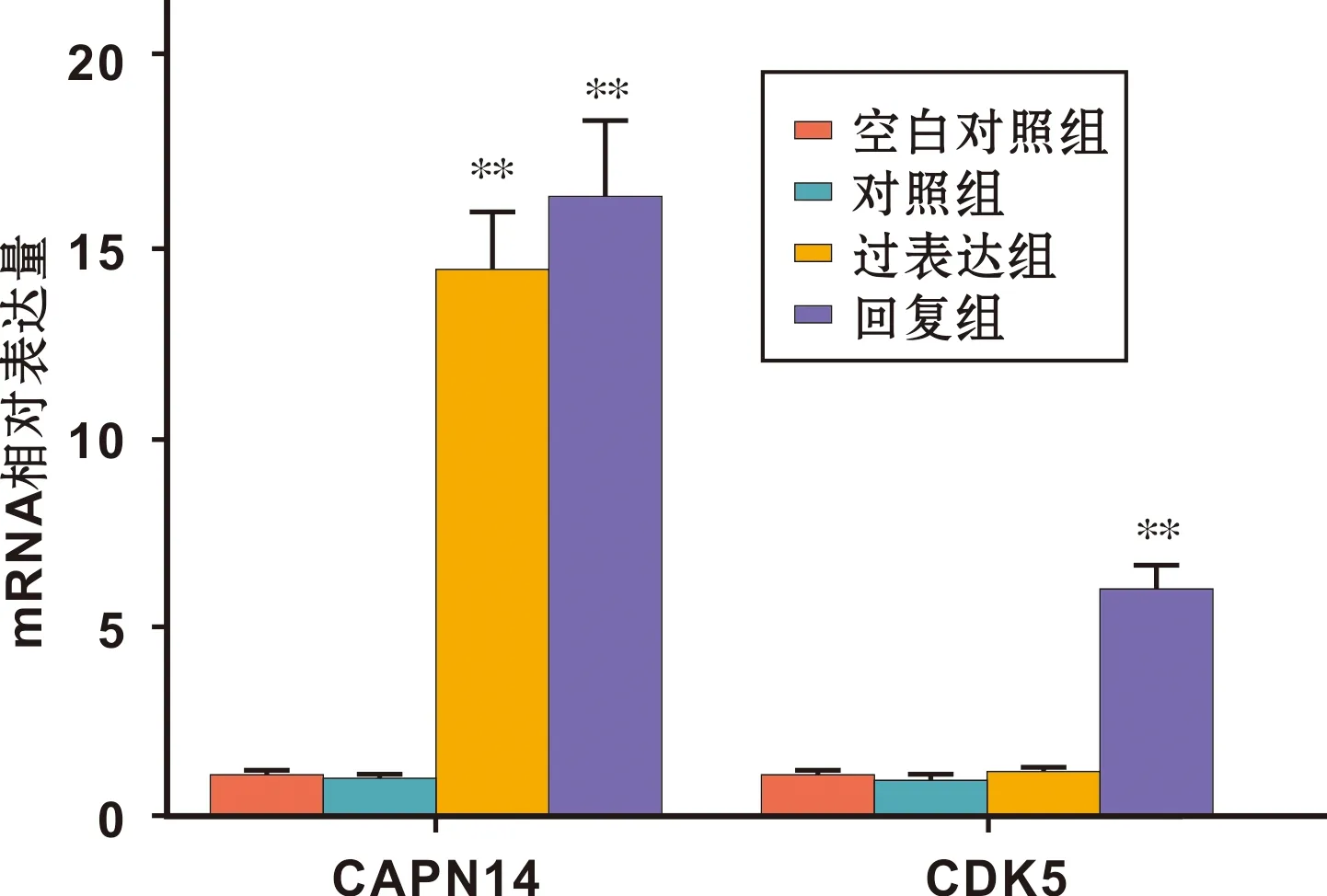
图 6 4 组细胞的CAPN14与CDK5基因表达及比较(相比对照组, **: P<0.01)
3 讨 论
口腔鳞癌由于其较强的局部组织侵袭能力,并破坏口腔面部外观,引发颈部淋巴结转移和血源性播散[9],仍然是一种致死致残性疾病,造成了严重的社会经济负担[10]。在世界范围内, 每年出现大约30 万新病例,近期发病率显著上升,尤其是在年轻人中。因此, 探索口腔鳞癌的耐发病机制及研究期新药物靶点是目前研究口腔鳞癌的热点与难点[11]。
钙激活中性蛋白酶(Calpains,CAPN)是一组非溶酶体Ca2+依赖的半胱氨酸蛋白酶,在人类基因组中,这组酶有15 种亚型,广泛存在并表现出组织特异性的表达模式[12]。钙蛋白酶广泛参与细胞增殖、转移、凋亡和信号转导等不同的生理病理过程,并且越来越多的证据表明钙蛋白酶在肿瘤转移中的中心作用是通过参与几个关键的过程[13],包括局部粘附动力学、细胞骨架重构、上皮-间充质转化和细胞凋亡等,从而被研究者认为是潜在的抗癌靶点[14]。基于CAPN在癌症中潜在的重要价值,本研究通过生物信息技术分析筛选出在正常口腔组织与口腔鳞癌组织之间差异较大的CAPN14,并且STRING预测结果显示CAPN14与细胞周期蛋白依赖性激酶5(CDK5)存在潜在的相互作用。CDK5是细胞周期蛋白依赖性激酶家族中的一个非典型成员,由于其激活因子p35在有丝分裂后的神经元中大量存在,因此在过去十年中被认为是一种神经元特异性激酶[15]。最近的研究表明,CDK5在非神经元细胞中参与了一系列的生物学和病理学过程,在各种肿瘤细胞中普遍失调[16]。CDK5的下调或者其抑制剂已被证实通过多种机制发挥抗癌作用[17],并可协同化疗药物的杀伤作用[18]。因此,结合相关文献和生物信息学结果,我们推测CAPN14可能通过调控CDK5的表达从而影响口腔鳞癌细胞的恶性表型。
本研究结果显示,相比口腔鳞癌旁组织,鳞癌组织中CAPN14的表达含量较低,且口腔鳞癌细胞系SCC9、SCC25、CAL27中的CAPN14表达含量较正常口腔上皮细胞HOEC低,这提示CAPN14的低表达与口腔鳞癌的发生与进展密切相关。此外,生物信息学结果表明CAPNs在HNSC组织中表达显著异常,以CAPN14最为明显;高表达CAPN14的HNSC患者生存时间长于低表达患者,而高表达CDK5的HNSC患者生存时间显著缩短,同时CAPN14与CDK5蛋白存在潜在的相互作用。因此,本研究推测CAPN14可调控CDK5的表达从而影响口腔鳞癌的恶性表型。实验中,我们首先在CAL27细胞中过表达CAPN14,发现过表达组细胞中CDK5的含量明显降低,CAL27细胞的增殖转移能力及CDK5蛋白的半衰期较空白组与对照组明显下降;在过表达CAPN14的CAL27细胞中回复CDK5表达后,CAL27细胞的增殖转移能力较过表达组细胞明显上升,CDK5蛋白的半衰期明显延长,这提示CAPN14可促进CDK5蛋白的降解抑制口腔鳞癌细胞的恶性增殖及转移能力。
综上所述,本研究探索了CAPN14与CDK5在口腔鳞癌的发生与发展中的作用及机制,为其作为口腔鳞癌的治疗靶点提供了实验依据,将通过构建体内动物模型进一步佐证CAPN14与CDK5在口腔鳞癌中的重要价值,以期为口腔鳞癌的治疗提供新的线索。
