Smad蛋白调控角膜新生血管发生发展的研究进展△
2022-02-24王淑荣何宇茜
曾 澳 闫 语 王淑荣 张 妍 何宇茜
角膜受到不利因素的刺激时,可通过产生角膜新生血管(CNV)来加强角膜的免疫防御功能,并且促进角膜的愈合。然而,CNV如果不加以治疗,可促使角膜形成瘢痕组织,严重时可致盲[1]。在美国,CNV的致盲率高达4.14%,我国每年也有大量的患者因此失明。遗憾的是,CNV发生发展机制尚未研究透彻。由于Smad蛋白对血管因子有调控作用,因此,本文主要就近年来Smad蛋白调控CNV发生发展的研究进展作一综述。
1 Smad蛋白的主要成员与特点
在脊椎动物中Smad蛋白有8种,根据其功能可分为三大类:第一类为受体调节型Smads(R-Smads),包括Smad2/3和Smad1/5/8;第二类为共同通路型Smad(Co-Smad),仅包括Smad4,其为转化生长因子-β(TGF-β)家族信号转导共同需要的因子;第三类为抑制型Smads(I-Smads),包括Smad6和Smad7,主要作用为抑制TGF-β家族信号转导[2]。其中,R-Smads和Smad4具有两个高度保守的结构域:N-末端结构域(MH1结构域)和C-末端结构域(MH2结构域),前者的作用是结合DNA,而后者的作用是介导蛋白质与多种调节剂和效应蛋白相互作用,从而发挥正向生物学作用[3]。与R-Smads和Smad4不同的是,I-Smads缺少这些保守结构域,从而发挥负向调节作用[4]。Smad蛋白参与TGF-β超家族的下游调控,TGF-β超家族主要包括激活素、抑制素、骨形态发生蛋白(BMP)以及TGF-β家族(TGF-β1、TGF-β2和TGF-β3)等。在TGF-β超家族激活的Smad信号通路中,不同的配体结合相应的Ⅰ型受体,即激活蛋白受体样激酶(ALK)和Ⅱ型受体(本质为跨膜的丝氨酸/苏氨酸蛋白激酶),随后Ⅱ型受体磷酸化并且激活Ⅰ型受体,进而激活相应的R-Smads[5](表1)。之后,磷酸化的R-Smads被释放并与Co-Smad结合形成异聚物,再转移至细胞核[4],然后与其他辅因子一起调节靶基因的转录,进而发挥生物学作用[5]。
2 Smad蛋白在CNV发生发展过程中的作用
2.1 Smad蛋白调节茎细胞、尖细胞形成血管出芽是CNV形成的关键过程,且主要与茎细胞、尖细胞的分化有关。新生血管芽最前端的细胞被称为尖细胞。尖细胞可以发出丝状伪足,用于引导血管出芽,此外尖细胞还能控制血管生成的数量。紧邻尖细胞后方的细胞被称为茎细胞,其增殖能力强,主要起延长新生血管分支和形成管腔的作用[6-7]。ALK激活Smad蛋白后可参与调控茎细胞、尖细胞形成,并通过以下通路调控CNV的发生发展。
2.1.1 BMP-ALK-Smad信号通路BMP9/BMP10激活的ALK1-Smad1/5/8信号通路能与Notch信号途径协同促进Notch信号靶基因的表达,从而促进茎细胞形成,抑制血管出芽[8-9],进而抑制CNV的发生发展。另外有研究发现[10],BMP6不仅可通过激活ALK2-Smad1/5信号来促进茎细胞形成,还可以通过激活ALK3-p38丝裂原活化蛋白激酶(p38MAPK)-热休克蛋白27(HSP27)信号来促进尖细胞形成。因此,BMP6通过调控ALK3-p38MAPK-HSP27信号和ALK2-Smad1/5信号来维持茎细胞、尖细胞的平衡,这种平衡有利于CNV的发生发展。然而,BMP2却只能通过激活ALK3-p38MAPK-HSP27信号来促进尖细胞形成[10]。

表1 TGF-β超家族各主要成员对Smad蛋白的调控
2.1.2 其他信号通路实验证明[11],TGF-β激活的ALK1-Smad信号可促进血管出芽;而其激活的ALK5-Smad信号维持新生血管稳定。当TGF-β1-ALK5-Smad2信号通路激活时,其通过改变血管生成过程中一些关键受体的表达量从而影响茎细胞、尖细胞形成,进而影响CNV的发生发展。相反,TGF-β-ALK1-Smad信号通路可通过间接抑制TGF-β-ALK5-Smad信号通路来促进血管出芽[11],从而促进CNV的发生发展。此外,尖细胞高表达神经纤毛蛋白-1(Nrp-1),而Nrp-1可通过抑制TGF-β和BMP9/BMP10激活的ALK1/ALK5-Smad2/3信号通路来抑制茎细胞形成,进而促进血管出芽[12],从而有利于CNV的发生发展。
2.2 Smad蛋白调控促血管生成和抗血管生成因子的表达角膜中促血管生成和抗血管生成机制的不平衡影响了CNV的发生发展[13]。Smad蛋白可能通过血管内皮生长因子(VEGF)途径、Ras同源基因-Rho相关螺旋卷曲蛋白激酶(Rho-Rock) 途径、Wnt途径和Notch途径,参与促血管生成和抗血管生成因子表达的调控,从而影响着CNV的发生发展(图1)。
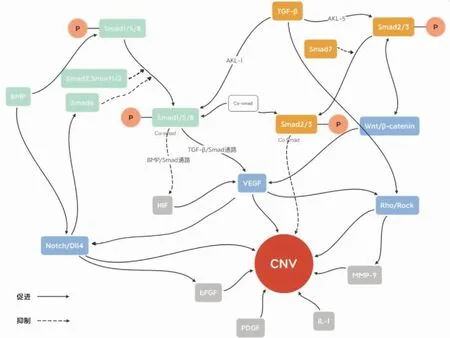
图1 Smad蛋白相关信号转导途径在CNV发生发展过程中的作用
2.2.1 Smad蛋白与VEGF途径VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(PLGF)。其中,VEGF-A是最有效的促血管生成因子。在角膜中,明确发现了VEGF-A表达的上调可促进CNV的形成[14],其机制为VEGF结合其受体VEGFR2后,可激活多种细胞内信号,如MAPK、磷脂酰肌醇3激酶-蛋白激酶B和一氧化氮信号,进而促进血管内皮细胞增殖、迁移[15-16]。目前有研究证明,抗VEGF途径的药物可以有效抑制CNV的形成。此外,VEGF基因的启动子区域受TGF-β/Smad通路的影响,这说明TGF-β/Smad是VEGF的上游通路[17]。有研究证明,TGF-β1-ALK1-Smad1/5-PLGF/VEGFR1-VEGF-A/VEGFR2信号通路能够促进血管生成,但是,TGF-β-ALK5-Smad2/3信号通路却抑制血管生成[18]。由此可见,TGF-β/Smad通路对血管生成有双重作用,可能和参与通路的ALK及Smads的种类有关。此外,在肿瘤微血管环境中,BMP介导的Smad1/5/8信号通路可使缺氧诱导因子降解,从而对缺氧诱导的VEGF表达产生负调控作用,然而此结论是否适用于角膜血管还不清楚[19]。对于I-Smads来说,有研究发现,Smad7能下调VEGF的表达,从而发挥抑制CNV发生发展的作用[20]。
2.2.2 Smad蛋白与Wnt途径配体蛋白质Wnt和膜蛋白受体结合可激活Wnt信号转导途径,经典的Wnt信号转导途径主要由β-catenin介导[21]。研究证明,Wnt/β-catenin信号转导途径能直接促进VEGF和其他促血管生长因子的表达,进而促进新血管的形成[22]。此外,R-Smads蛋白可以与Wnt/β-catenin途径协同激活靶基因转录,如VEGF基因,其中,Smad3可以促进β-catenin进行核易位,从而促进Wnt/β-catenin信号的转导[23];同样,Wnt信号可通过抑制糖原合成酶激酶-3β的活性,从而抑制Smad1和Smad3多泛素化和降解,进而促进Smad蛋白发挥作用[23]。另外,当β-catenin信号转导受抑制后,TGF-β诱导的Smad3激活减少,进一步提示我们Wnt/β-catenin途径可促进TGF-β/Smad信号转导[24]。由于TGF-β/Smad信号同Wnt/β-catenin途径可相互刺激,因此,Smad7不仅可通过抑制TGF-β/Smad信号转导间接抑制Wnt/β-catenin途径,还能与β-catenin结合以促进β-catenin降解,从而直接抑制β-catenin信号转导,这为CNV的治疗提供了广阔的思路,如过氧化物酶体增殖物激活受体γ激动剂可能通过刺激Smad7,以抑制TGF-β/Smad信号通路和Wnt/β-catenin途径,从而抑制VEGF等血管因子的生成,进而抑制CNV的发生发展[25]。
2.2.3 Smad蛋白与Rho/Rock途径Rho/Rock信号转导途径与血管内皮细胞的迁移密切相关[26]。研究发现,Rho/Rock途径能上调促血管生成因子,如基质金属蛋白酶-9和骨桥蛋白的表达,进而促进血管生成[27]。Smad蛋白可通过两种途径与Rho/Rock途径相互作用:其一,VEGF是Rho/Rock途径的上游信号[28],因此,Smad蛋白可能通过VEGF间接地影响Rho/Rock途径;其二,RhoA蛋白是TGF-β1的下游因子[29],TGF-β1/Smad信号通路可以促进Rho/Rock信号途径中的RhoA、RhoC和Rock1蛋白的表达,而TGF-β/Smad抑制剂则抑制它们的表达,同样,Rho/Rock信号抑制剂下调Smad2蛋白的表达[30]。因此,TGF-β/Smad信号通路还可以直接与Rho/Rock途径相互作用来调控CNV的发生发展。
2.2.4 Smad蛋白与Notch途径在人体中,Notch信号转导途径主要包括五种Notch配体(Delta-like1、3、4即Dll1、3、4;Jagged1和Jagged2)和四种Notch受体(Notch1-4)[31]。Notch配体与受体结合后激活Notch信号,Notch胞内段(NICD)被裂解并释放,然后从细胞膜转运至细胞核[32]。在人角膜上皮细胞中,Notch信号通路不仅可直接参与调节血管内皮细胞的增殖和分化,还协助碱性成纤维细胞生长因子诱导角膜血管平滑肌细胞和内皮细胞增殖[33]。然而,Notch信号还可参与调节Smad6的表达,从而抑制内皮细胞对BMP的反应性,继而抑制新血管形成[34]。因此,Notch信号对CNV可能起着双重作用。有研究发现,TGF-β激活的Smad3可与NICD发生作用,从而促进Notch信号靶基因的表达[23]。此外,TGF-β/Smad信号通路诱导产生的VEGF是Notch信号的上游通路[26],在血管内皮细胞中,二者形成VEGF-VEGFR-Dll4-Notch-VEGFR调节反馈通路[35],这表明,Smad蛋白还可能通过VEGF间接作用于Notch信号。另外,TGF-β抑制剂可以下调Notch信号通路中的RNA和蛋白质的表达[36],进一步说明TGF-β/Smad信号通路能促进Notch信号转导。而且,BMP/Smad通路也可以直接与Notch信号靶基因的调控序列结合,进而促进Notch信号转导[23]。
3 前景展望
虽然早有研究发现,Smad蛋白在促血管生成因子和抗血管生成因子的表达调控中具有关键作用[37]。但是近些年来,Smad蛋白直接调控CNV发生发展的研究相当少。本文主要总结了Smad蛋白对茎细胞、尖细胞形成的调控以及Smad蛋白与VEGF途径、Wnt途径、Rho/Rock途径和Notch途径的相互作用,从而推测Smad蛋白可能通过这些信号转导途径参与CNV发生发展的调控,但是其具体机制尚未明确,尚需进一步研究,以为CNV的治疗提供新的可能靶点。
