DNA氧化损伤修复基因ERCC6对过氧化氢诱导的氧化损伤的晶状体上皮细胞增殖和凋亡的影响
2022-02-24李之喆俞华林刘建军
李之喆 俞华林 刘建军
白内障是常见的致盲性眼病,老年性白内障(ARC)是白内障的主要类型[1]。有数据显示,世界范围内半数以上的失明都是由ARC所导致的[2]。目前,ARC的发病机制仍不明确,手术摘除混浊的晶状体联合人工晶状体植入是治疗ARC的主要方法。因此,探究ARC的病因及发病机制对疾病的预防和治疗有重要意义。研究发现,氧化应激导致的DNA氧化损伤是ARC的发病机制之一[2]。多个DNA氧化损伤修复基因被证实与ARC的发生发展相关,其中包括OGG1、ERCC6、WRN等基因[3-5]。科凯恩综合征互补B蛋白(CSB)是由ERCC6基因所编码,主要在核苷酸切除修复通路中发挥关键作用[4]。研究发现,CSB先天性缺陷患者不仅会出现科凯恩综合征,还伴有严重的白内障[6]。
为了探讨DNA氧化损伤修复基因ERCC6与ARC形成的关系,本研究通过构建质粒,建立过表达ERCC6的稳定细胞株,探讨过氧化氢(H2O2)诱导氧化损伤后ERCC6基因的表达对晶状体上皮细胞增殖和凋亡的影响。
1 材料与方法
1.1 试剂与仪器DMEM培养液、胎牛血清和胰蛋白酶(美国Gibco BRL公司),H2O2(上海Sigma-Aldrich公司),细胞培养6孔板和24孔板(美国Corning公司),Trizol试剂(美国Invitrogen公司),逆转录试剂盒(美国Thermo Scientific公司),引物(中国生工生物工程股份有限公司),过表达质粒(中国吉凯基因医学科技股份有限公司),EdU试剂盒(中国锐博生物科技有限公司),GAPDH抗体(中国ABclonal公司),Bax和Bcl-2抗体(英国Abcam公司),Bio-Rad蛋白免疫印迹电泳仪(中国宾智生物科技有限公司),实时荧光定量PCR仪(美国ABI公司),荧光显微镜(德国Leica公司)。
1.2 细胞培养将冻存的SRA01/04细胞从液氮罐中取出,迅速放入37 ℃水浴锅中进行快速解冻,随后加入含体积分数10%胎牛血清以及100 U·mL-1青链霉素的DMEM培养基,吹打混匀后移入培养瓶中,置于37 ℃、含体积分数5% CO2的培养箱中继续培养24 h。
1.3 H2O2处理细胞将SRA01/04细胞以每孔100×103个置于6孔培养板中培养 24 h。之后使用不同浓度H2O2处理细胞,H2O2药物处理浓度分别为0 μmol·L-1、50 μmol·L-1、100 μmol·L-1、200 μmol·L-1、400 μmol·L-1,待H2O2处理24 h 后进行后续实验。
1.4 实时荧光定量PCR检测按照Trizol试剂说明书步骤提取SRA01/04细胞中的总RNA并测定其浓度。使用Thermo Scientific公司的逆转录试剂盒逆转录成cDNA后,以GAPDH为内参,采用实时荧光定量PCR检测ERCC6的表达。反应条件如下:95 ℃ 预变性120 s,95 ℃变性15 s,60 ℃退火15 s及延伸60 s,共40个循环,实验重复3次。ERCC6上游引物序列为5’-CAATAGTCTGCCTCCCCACCCC-3’,下游引物序列为5’-CAACTTCTCGTTCCTCAACACATC-3’。GAPDH上游引物序列为5’- TGAAGGTCGGAGTCAACGGATTTGGT -3’,下游引物序列为5’- CATGTGGGCCATGAGGTCCACCAC -3’。实验中提取RNA所用的试剂Trizol购自美国Invitrogen公司,所用的引物均由上海生工生物工程股份有限公司设计合成。
1.5 细胞转染转染前1 d将SRA01/04细胞分别接种于6孔板和24孔板,并分为H2O2组、H2O2+空白质粒转染组和H2O2+pcDNA3.1-ERCC6质粒转染组。细胞种板前,6孔板和24孔板中分别加入2 mL和500 μL含血清但不含青链霉素的培养基。当细胞融合度达到50%时,6孔板转染组每孔加入10 μL Lipofectamine3000和5 μL pcDNA3.1-ERCC6进行转染;24孔板转染组每孔加入10 μL Lipofectamine3000和5 μL pMGFP-ERCC6进行转染。孵育12 h后,将细胞培养基更换为含有血清的全培养基,并置于37 ℃、含体积分数5% CO2培养箱中继续培养48~72 h后,检测ERCC6转染水平,进行后续实验。
1.6 免疫印迹实验检测蛋白表达取出6孔板,用PBS清洗3次,每次5 min。之后,根据细胞密度加入适量蛋白裂解液提取总蛋白,蛋白上样后电泳分离蛋白,湿转法将蛋白转移至PVDF膜,用5 g·L-1脱脂牛奶室温下封闭2 h,加入CSB抗体(11000)、Bax抗体 (11000)、Bcl-2 抗体(11000) 和GAPDH抗体 (16000)置于4 ℃冰箱孵育过夜[7]。加入山羊抗兔(二抗)室温孵育2 h ,ECL发光反应后,暗室曝光显影。以GAPDH为内参,用ImageJ 软件对CSB、Bax和Bcl-2蛋白含量进行定量分析。
1.7 EdU染色实验检测细胞增殖将SRA01/04细胞吹打混匀后接种在含有细胞爬片的24孔培养板中,根据实验设计进行质粒转染和H2O2造模后,用完全培养基按说明书要求稀释EdU溶液,每孔加入300 μL稀释好的EdU混合液置于37 ℃、含体积分数5% CO2培养箱中避光孵育。培养2 h后,弃去EdU混合液,用PBS清洗1次,再加入等体积的多聚甲醛,室温下固定30 min,弃细胞固定液。接下来加入2 g·L-1甘氨酸,脱色摇床孵育5 min后,弃反应液,用PBS清洗5 min。然后,向各反应孔中加入TritonX-100通透液,脱色摇床反应10 min后,弃去通透液并用PBS清洗5 min。再向反应孔中加入300 μL Apollo染色液避光室温孵育30 min后,弃染色反应液。每孔加入TritonX-100通透液清洗3次,每次10 min。最后每孔加入Hoechst反应液,染细胞核,置于脱色摇床上避光室温孵育30 min,弃去染色液后,加入PBS清洗3次,每次10 min。最后,在荧光显微镜下进行避光拍片并保存。
1.8 统计学方法采用SPSS 22.0统计学软件进行数据分析。以均数±标准差表示数据,两样本间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 不同浓度H2O2处理组SRA01/04细胞ERCC6 mRNA表达情况实时荧光定量PCR检测结果显示,与0 μmol·L-1H2O2处理组相比,100 μmol·L-1、200 μmol·L-1、400 μmol·L-1的H2O2处理SRA01/04细胞 24 h后,SRA01/04细胞ERCC6 mRNA的相对表达量明显下降,差异均有统计学意义(均为P<0.05)。其中当H2O2处理浓度为200 μmol·L-1时,SRA01/04细胞ERCC6 mRNA的相对表达量最低,与其他浓度H2O2处理组相比,差异均有统计学意义(均为P<0.01)(图1)。因此,后续转染实验H2O2处理浓度均采用200 μmol·L-1。
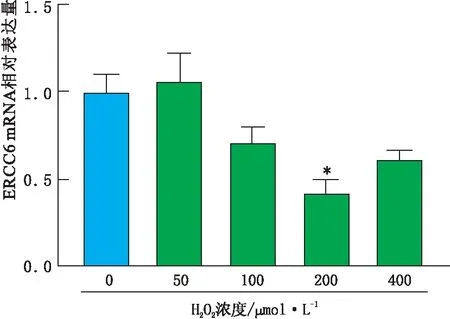
图1 不同浓度H2O2处理组SRA01/04细胞ERCC6 mRNA相对表达量 与其他浓度H2O2处理组相比,*P<0.01。
2.2 不同浓度H2O2处理组SRA01/04细胞CSB蛋白表达情况免疫印迹实验检测结果显示,随着H2O2浓度的增加,SRA01/04细胞CSB蛋白相对表达量呈剂量依赖性下降。蛋白定量结果也表明,200 μmol·L-1H2O2处理组SRA01/04细胞CSB蛋白相对表达量最低,与其他浓度H2O2处理组相比,差异均有统计学意义(均为P<0.05) (图2)。
2.3 转染后各组SRA01/04细胞ERCC6 mRNA和CSB蛋白表达情况实时荧光定量PCR检测结果显示,与H2O2+空白质粒转染组和H2O2组相比,H2O2+pcDNA3.1-ERCC6质粒转染组SRA01/04细胞ERCC6 mRNA表达水平均显著增高(均为P<0.05)(图3)。免疫印迹实验检测结果也显示,与H2O2+空白质粒转染组相比,H2O2+pcDNA3.1-ERCC6质粒转染组SRA01/04细胞CSB蛋白相对表达量也显著上升(P<0.05)(图4)。因此,选取的pcDNA3.1-ERCC6质粒转染可以作为后续实验的细胞过表达模型。
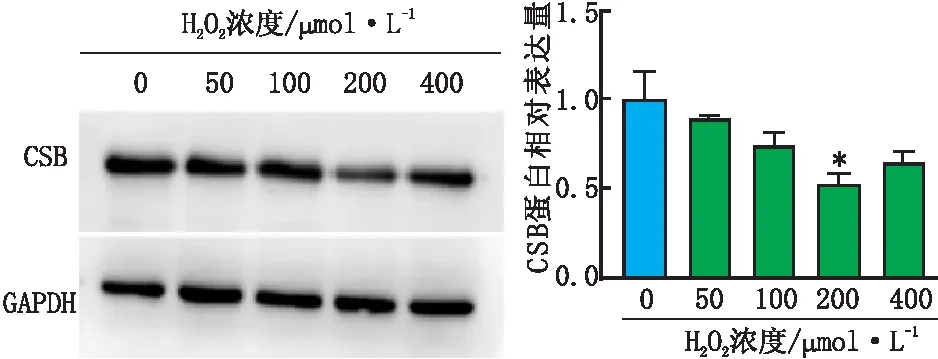
图2 不同浓度H2O2处理组SRA01/04细胞CSB蛋白表达情况 与其他组相比,*P<0.05。
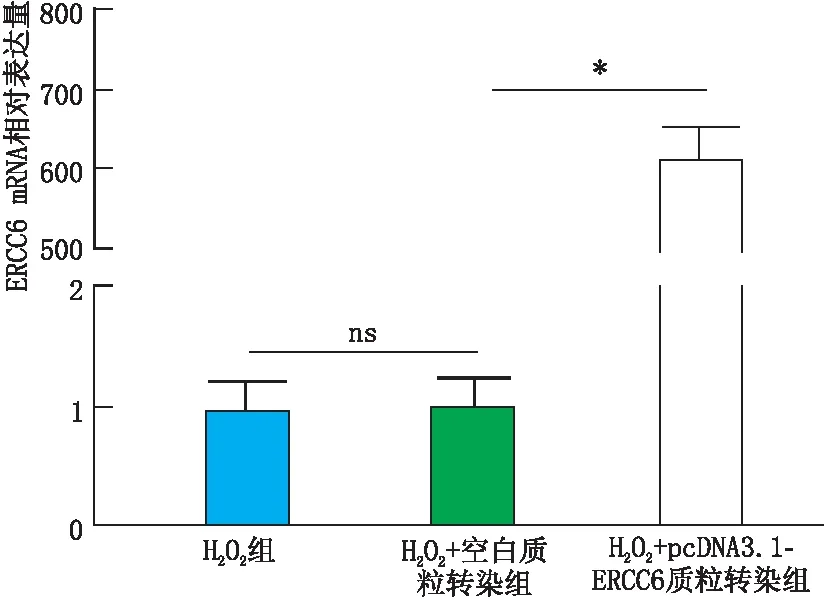
图3 转染后各组SRA01/04细胞ERCC6 mRNA表达情况 *示P<0.05,ns示差异无统计学意义。
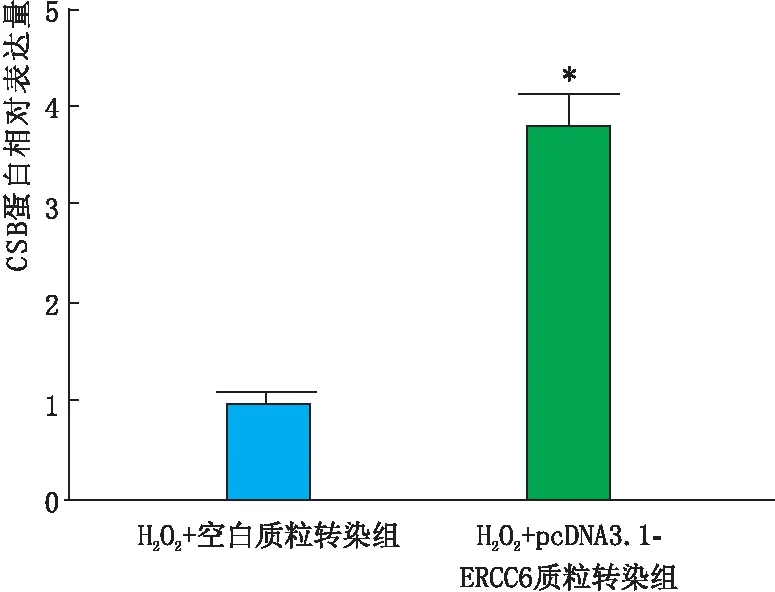
图4 转染后各组SRA01/04细胞CSB蛋白表达情况 与H2O2+空白质粒转染组相比,*P<0.05。
2.4 转染后各组SRA01/04细胞Bax蛋白和Bcl-2蛋白表达情况经200 μmol·L-1H2O2构建细胞氧化损伤模型并进行转染后检测发现,与H2O2组和H2O2+空白质粒转染组相比,H2O2+pcDNA3.1-ERCC6质粒转染组SRA01/04细胞中的促凋亡蛋白Bax表达明显降低,而抑制凋亡的蛋白Bcl-2表达则明显增加(均为P<0.05)(图5)。
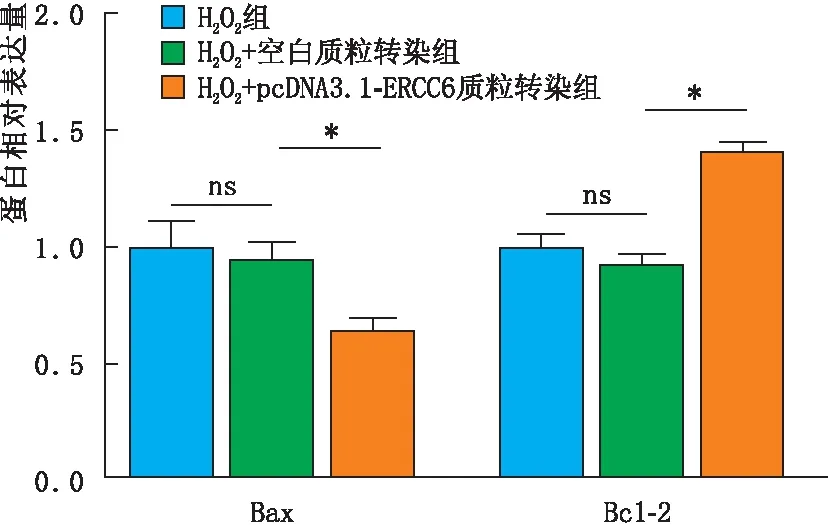
图5 转染后各组SRA01/04细胞Bax蛋白和Bcl-2蛋白表达情况 *示P<0.05,ns示差异无统计学意义。
2.5 转染后各组SRA01/04细胞增殖能力EdU染色实验检测结果显示,与H2O2+空白质粒转染组相比,H2O2+pcDNA3.1-ERCC6质粒转染组SRA01/04细胞内绿色荧光亮度增高,阳性细胞数量增加,表明SRA01/04细胞的增殖能力增强(图6)。
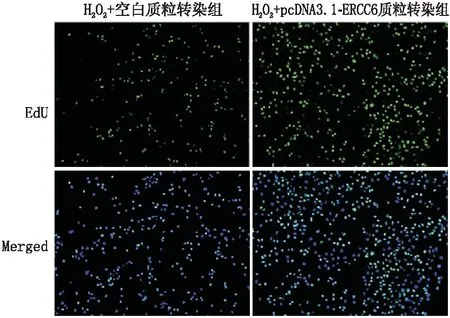
图6 EdU染色实验检测SRA01/04细胞增殖能力 细胞核呈现蓝色荧光,EdU染色阳性呈现绿色荧光。
3 讨论
近年来,随着我国人口老龄化的加剧,ARC的患病率持续升高,其导致的盲和视力损伤也成为社会巨大的经济负担[8]。迄今为止,ARC发生发展的病因及发病机制尚不明确[8]。越来越多的研究发现,氧化应激导致的DNA损伤若未及时修复将导致晶状体上皮细胞的凋亡,这是ARC发生发展的主要诱因[3,9-12]。
DNA损伤修复蛋白的缺失会引起体内DNA修复功能障碍。若晶状体上皮细胞内的DNA损伤不能得到及时修复,则会破坏晶状体上皮细胞中DNA的完整性和遗传稳定性,继而造成晶状体内错误折叠蛋白异常聚集,从而导致ARC的发生[10]。已发现约有130种人类氧化损伤修复基因分布在细胞内的多种修复系统中。细胞内主要存在以下5种修复方式,直接修复、碱基切除修复、核苷酸切除修复、双链断裂修复和错配修复[13]。在各种DNA修复通路中,基因的异常表达或功能障碍均有可能影响细胞内DNA修复过程。其中,核苷酸切除修复通路被认为是人类最重要的DNA损伤修复途径之一。核苷酸切除修复的损伤识别由两个子通路完成:全基因组修复和转录相关修复[14]。ERCC6作为核苷酸切除修复通路核心基因之一,主要参与转录相关修复子通路的调控[15]。CSB可将核苷酸切除修复通路中的修复因子募集到DNA损伤位点修复损伤的DNA,也可通过识别转录链上损伤的DNA,召集DNA修复因子至损伤部位,启动转录偶联修复来修复DNA[16]。
目前,关于氧化损伤修复基因和ARC之间的研究逐渐增多[4,10,17]。有学者研究发现,在核型ARC患者中,CSB蛋白的表达明显下调。而且在紫外线诱导的体外细胞氧化损伤模型中,CSB蛋白的表达也显著下降[4]。然而,本研究我们利用H2O2诱导SRA01/04细胞,构建氧化损伤细胞模型,模拟ARC中的氧化应激状态。结果显示,CSB蛋白在氧化损伤模型细胞中的表达也显著下降。同时有研究结果表明,CSB蛋白可以抑制乳腺癌细胞的增殖能力并诱导细胞凋亡[18]。为了探索CSB在H2O2诱导的细胞ARC模型中的功能,我们用ERCC6过表达质粒转染H2O2刺激后的SRA01/04细胞,发现ERCC6基因可能通过促进DNA损伤修复抑制晶状体上皮细胞的凋亡;同时,EdU染色实验检测结果也显示,CSB蛋白能够增加细胞的活力,促进晶状体上皮细胞的增殖。
综上所述,ERCC6基因在H2O2诱导的氧化损伤模型细胞中的表达显著下降,CSB蛋白表达下降可能通过减弱DNA的核苷酸切除修复作用抑制晶状体上皮细胞增殖,促进其凋亡。
