miR-146a对高糖诱导的人视网膜微血管内皮细胞增殖和新生血管生成的影响及其机制△
2022-02-24欧阳君肖婷婷徐琰瑛
何 静 谢 平 欧阳君 肖婷婷 徐琰瑛 袁 晴
糖尿病视网膜病变(DR)是糖尿病患者最常见的微血管并发症之一[1-2],其主要病理特征包括视网膜微血管生成和视网膜脱落[3]。因此,抑制长期高糖诱导的新生血管生成和人视网膜微血管内皮细胞(HRMEC)增殖十分重要。研究发现,miR-146a在DR大鼠模型的视网膜组织和血清中的表达均发生失调[4],提示miR-146a可能是与DR发病机制有关的重要因子。目前,人们对miR-146a在视网膜细胞中的作用及其潜在的分子机制仍然不太清楚。白细胞介素(IL)-17是一种多效性促炎性细胞因子,其家族成员IL-17A能够通过损伤视网膜Müller细胞功能加重DR病变进程[5]。因此,阻断IL-17A是一种潜在的DR治疗策略。人IL-17A mRNA 3’端与miR-146a具有一定的同源性,这表明IL-17A可能是miR-146a的潜在靶点。本研究探讨miR-146a对高糖诱导的HRMEC增殖和新生血管生成的影响及其机制。
1 材料与方法
1.1 主要试剂与仪器HRMEC(美国Angio-Proteomie微生物菌种保藏中心),miR-146a mimics及其相应的阴性对照品(中国南通生物科技有限公司),OligofectamineTM转染试剂和pcDNA3.1质粒(美国Invitrogen公司),鼠抗人Ki-67核抗体(中国武汉Proteintech公司),免疫印迹一抗(小鼠抗人多克隆抗体)VEGF、VEGF受体2(VEGFR2)、磷脂酰肌醇3-激酶(PI3K)、磷酸化PI3K(p-PI3K)、蛋白激酶B(AKT)和磷酸化AKT(p-AKT)(美国ABGENT公司)。ABI Prism 7700型荧光定量PCR仪(美国Applied Biosystems公司)。
1.2 方法
1.2.1 细胞培养、转染及分组将HRMEC放入含体积分数5%胎牛血清、0.1 U·L-1青霉素和0.1 g·L-1链霉素的内皮细胞培养基中,置于37 ℃体积分数为5% CO2培养箱内培养。选取对数生长期细胞进行处理,使用OligofectamineTM脂质体转染试剂转染50 nmol·L-1miR-146a mimics序列或miR-NC阴性对照序列。此外,将IL-17A全长插入pcDNA3.1质粒中,同样使用OligofectamineTM脂质体转染试剂转染20 nmol·L-1pcDNA3.1-IL-17A质粒或pcDNA3.1空质粒。将细胞分为正常组、高渗组、高糖组、阴性对照组、miR-146a mimics组、miR-146a mimics+IL-17A组。正常组细胞用含5.5 mmol·L-1D-葡萄糖的培养基培养24 h,高渗组细胞用含5.5 mmol·L-1D-葡萄糖和50 mmol·L-1甘露醇的培养基培养24 h;其余各组细胞先用含30 mmol·L-1D-葡萄糖的培养基培养24 h后,阴性对照组、miR-146a mimics组、miR-146a mimics+IL-17A组分别转染阴性对照序列+pcDNA3.1空质粒、miR-146a mimics质粒、miR-146a mimics+pcDNA3.1-IL-17A质粒。
1.2.2 MTT法检测细胞活力将HRMEC接种在96孔板中分组处理,加入MTT试剂后静置4 h,弃上清,将形成的紫色晶体溶于DMSO中,用酶标仪检测光密度(D490),计算各组细胞活力。
1.2.3 细胞划痕实验检测细胞迁移活性将HRMEC接种在24孔培养板中,分组处理后加入1 mg·L-1的丝裂霉素C孵育1 h,用黄色移液枪头尖在细胞表面均匀划一横线。清洗细胞碎片,分别于划伤后0 h、24 h时测量划痕距离,计算各组细胞迁移率。
1.2.4 Matrigel法检测细胞管腔形成情况将HRMEC接种于Matrigel基质胶表面,分组处理后,在显微镜下观察细胞形态及管状结构的变化。
1.2.5 Western blot法检测相关蛋白表达将HRMEC分组处理后,提取约10×106个细胞内总蛋白并测定蛋白浓度,垂直电泳分离后,转移至聚偏氟乙烯膜上,用0.5 g·L-1脱脂奶粉封闭1 h;加入一抗(稀释比为11000)孵育过夜,次日加入羊抗兔IgG室温孵育2 h;用ECL化学发光法进行检测,以GAPDH作为参照计算蛋白表达水平。
1.3 统计学分析应用SPSS 19.0统计学软件对各组数据进行统计分析,计量资料以均数±标准差表示,采用单因素方差分析和两样本独立t检验进行组间比较。检验水准:α=0.05。
2 结果
2.1 各组HRMEC细胞活力高渗组细胞活力与正常组相比,差异无统计学意义(P>0.05)。而高糖组、阴性对照组细胞活力均高于正常组(均为P<0.05);与高糖组和阴性对照组相比,miR-146a mimics组细胞活力均降低(均为P<0.05);miR-146a mimics+IL-17A组细胞活力则高于miR-146a mimics组(P<0.05)(图1)。
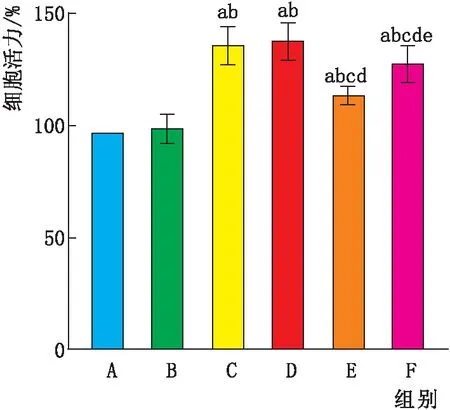
图1 各组HRMEC细胞活力 A:正常组;B:高渗组;C:高糖组;D:阴性对照组;E:miR-146a mimics组;F:miR-146a mimics+IL-17A组。与正常组相比,aP<0.05;与高渗组相比,bP<0.05;与高糖组相比,cP<0.05;与阴性对照组相比,dP<0.05;与miR-146a mimics组相比,eP<0.05。
2.2 各组HRMEC细胞迁移能力高渗组细胞迁移率与正常组相比,差异无统计学意义(P>0.05);而高糖组、阴性对照组细胞迁移率均高于正常组(均为P<0.05);与高糖组和阴性对照组相比,miR-146a mimics组细胞迁移率均降低(均为P<0.05);miR-146a mimics+IL-17A组细胞迁移率则较miR-146a mimics组升高(P<0.05)(图2)。
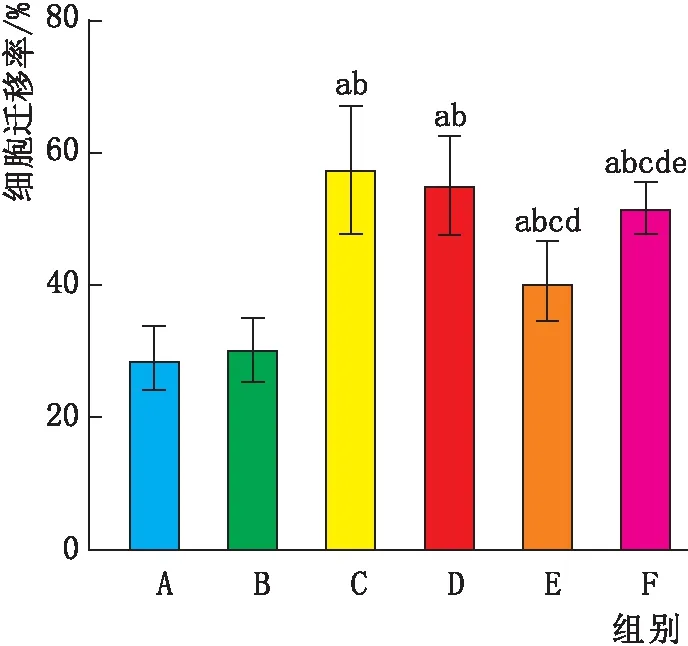
图2 各组HRMEC细胞迁移率 A:正常组;B:高渗组;C:高糖组;D:阴性对照组;E:miR-146a mimics组;F:miR-146a mimics+IL-17A组。与正常组相比,aP<0.05;与高渗组相比,bP<0.05;与高糖组相比,cP<0.05;与阴性对照组相比,dP<0.05;与miR-146a mimics组相比,eP<0.05。
2.3 各组HRMEC管腔形成情况高渗组细胞环状结构数量与正常组相比,差异无统计学意义(P>0.05);而高糖组、阴性对照组细胞环状结构数量均高于正常组(均为P<0.05);与高糖组和阴性对照组相比,miR-146a mimics组细胞环状结构数量均降低(均为P<0.05); miR-146a mimics+IL-17A组细胞环状结构数量则较miR-146a mimics组升高(P<0.05)(图3)。
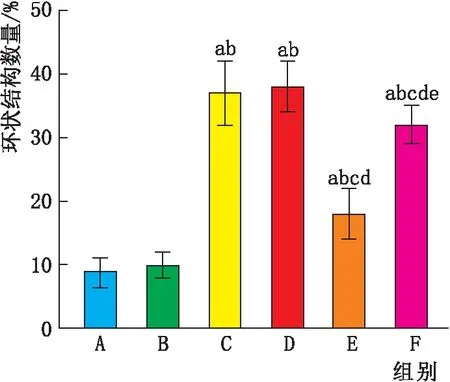
图3 各组HRMEC环状结构数量 A:正常组;B:高渗组;C:高糖组;D:阴性对照组;E:miR-146a mimics组;F:miR-146a mimics+IL-17A组。与正常组相比,aP<0.05;与高渗组相比,bP<0.05;与高糖组相比,cP<0.05;与阴性对照组相比,dP<0.05;与miR-146a mimics组相比,eP<0.05。
2.4 各组HRMEC中血管形成相关蛋白和PI3K/AKT通路相关蛋白的表达情况高渗组HRMEC中VEGF、VEGFR2、IL-17A、p-PI3K、p-AKT蛋白相对表达量与正常组比较,差异均无统计学意义(均为P>0.05);而高糖组、阴性对照组上述蛋白相对表达量均高于正常组(均为P<0.05);miR-146a mimics组上述蛋白相对表达量均低于高糖组(均为P<0.05); miR-146a mimics+IL-17A组上述蛋白相对表达量均高于miR-146a mimics组(均为P<0.05)(图4)。
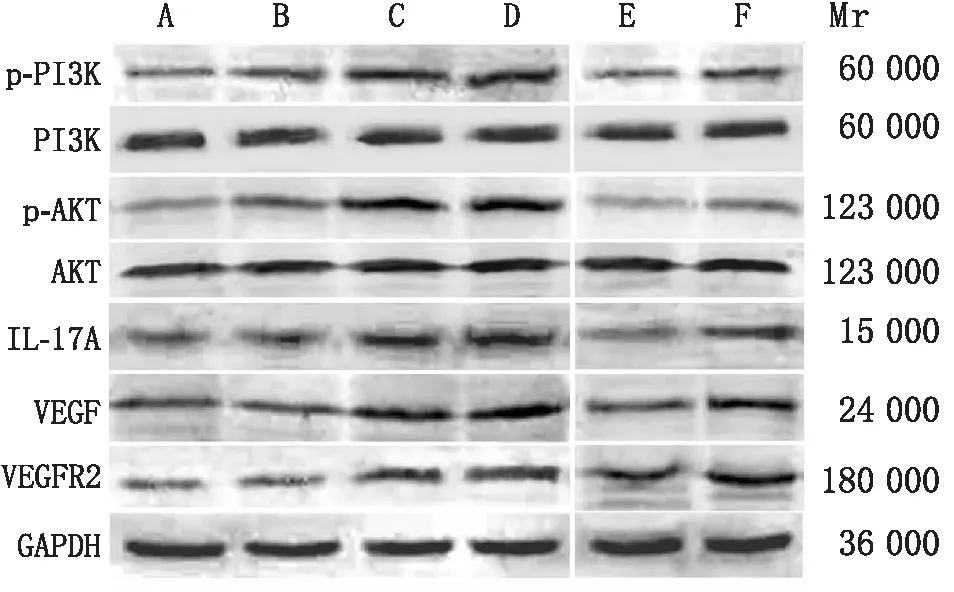
图4 各组HRMEC相关蛋白Western blot检测结果 A:正常组;B:高渗组;C:高糖组;D:阴性对照组;E:miR-146a mimics组;F:miR-146a mimics+IL-17A组。
3 讨论
DR是眼科常见的致盲性眼病之一[6],抑制高糖引起的微血管生成对抑制DR的发展至关重要[7]。近年来,有关miRNAs的研究成果为我们对复杂生物学机制的理解提供了新的思路[8-9]。持续高糖环境下HRMEC的异常增殖和微血管生成是DR的典型病理特征[10]。在本研究中,HRMEC暴露于高糖环境下导致细胞活力明显增加,miR-146a表达下调,同时VEGF和VEGFR2蛋白表达明显上调,PI3K/AKT信号通路被激活。这说明高糖能促进HRMEC增殖以及新生血管生成。本研究中HRMEC转染miR-146a mimics 后miR-146a表达上调,这可抑制高糖诱导的细胞过度增殖和新生血管生成,同时也可逆转高糖诱导的IL-17A表达升高,对于PI3K/AKT途径的激活也有抑制作用。
miR-146a是与炎症、先天性免疫疾病和癌症有关的miRNAs,其在不同类型的视网膜细胞中有不同程度的表达[11]。周垂仁等[12]研究证实,DR患者血清miR-146a含量明显降低,同时VEGF含量明显增加。因此,miR-146a有可能通过介导炎症反应和新生血管生成参与DR的发病过程。而上调大鼠视网膜微血管内皮细胞中miR-146a的表达则可抑制高糖诱导的炎症通路的激活,从而减轻或延缓视网膜微血管内皮细胞损伤及神经元功能缺陷[13-15],这与本研究结论基本一致。此外,在本研究中,我们发现上调miR-146可降低高糖诱导的IL-17A表达以及HRMEC细胞活力,提示IL-17A可能是miR-146a调控的重要靶点。这一点通过生物信息学检索和双荧光素酶报告基因实验也得到了证实。IL-17A是一种重要的促炎细胞因子,高糖环境可诱导HRMEC中IL-17A表达显著上调[16],而抑制IL-17A表达则对增生型糖尿病视网膜病变患者的视网膜内皮细胞有一定的保护作用[17]。因此,miR-146对下游IL-17A表达的抑制作用可能是影响高糖诱导HRMEC增殖和新生血管生成的重要机制之一。此外,PI3K/AKT通路是一个众所周知的经典信号转导通路,涉及细胞生长、增殖、运动、存活和凋亡[18]。该途径的异常激活不仅可导致多种恶性肿瘤细胞的存活和增殖[19],也与高糖刺激有关;而抑制这些通路被认为是治疗增生型糖尿病视网膜病变的一种有效策略[20]。本研究中,miR-146a mimics+IL-17A组HRMEC中PI3K和AKT蛋白磷酸化水平升高,同时IL-17A过度激活。因此,下调IL-17A表达,可抑制PI3K/AKT通路激活,进而降低高糖诱导的HRMEC增殖和新生血管生成。
综上所述,本研究结果显示,miR-146a可能在DR进程中扮演着关键角色。高糖可诱导HRMEC中miR-146a表达下调,而上调miR-146a表达可有效地降低高糖诱导的HRMEC增殖和新生血管生成。这些作用可能是通过降低IL-17A表达进而抑制PI3K/AKT通路激活所实现的,它是miR-146a发挥生物学作用的重要机制之一。
