S期激酶相关蛋白2(SKP2)泛素化修饰OGG1对中波紫外线诱导的晶状体上皮细胞氧化损伤作用△
2022-02-24李鹏飞陈晓娟孙诚浩张文怡吴安然管怀进
李鹏飞 陈晓娟 孙诚浩 张文怡 吴安然 管怀进
年龄相关性白内障(ARC)是主要的致盲性眼病之一。随着我国人口老龄化的加剧,ARC患者比例会进一步加大,给整个社会和患者家庭造成巨大的经济负担[1]。目前,ARC的病因及发病机制仍未阐明,因此还没有靶向治疗的有效药物,现今仍需通过手术进行治疗。研究表明,晶状体内部蛋白质的紊乱和错误折叠蛋白质的异常聚集均能引起晶状体折射率的改变,造成晶状体混浊[2]。泛素化修饰是一种常见的蛋白质翻译后修饰,是指泛素在一系列酶,如E1泛素激活酶、E2泛素结合酶、E3泛素连接酶的催化下共价结合到底物蛋白(如错误折叠蛋白等)的过程[3]。由于E3泛素连接酶能决定底物蛋白的特异性,因此也被公认是泛素化过程中最重要的调控因素。
目前普遍认为,晶状体上皮细胞(LEC)的DNA氧化损伤修复功能障碍是ARC重要的分子病理基础[4-6]。同时,本课题组经研究证实在中波紫外线(UVB)诱导的氧化损伤环境中,LEC内蛋白质的泛素化明显增多,并且在泛素修饰组学数据中显示多个DNA氧化修复蛋白存在差异的泛素化修饰[7]。8-氧代鸟嘌呤-DNA糖基化酶(OGG1)是DNA碱基切除修复途径的关键蛋白,前期研究已证实其在ARC的发生发展中起重要作用[8-10]。然而,OGG1蛋白翻译后修饰的研究尚未见相关报道。因此,本研究设计以人LEC细胞株SRA01/04作为研究对象,旨在探索OGG1在LEC氧化损伤过程中的泛素化降解机制。
1 材料与方法
1.1 材料SRA01/04细胞株购自中国科学院上海生命科学研究所。DMEM培养液、胎牛血清、胰蛋白酶和细胞培养板均购自Gibco公司(美国),Hanks平衡盐溶液、磷酸盐缓冲液(PBS)购自碧云天生物技术公司;手持UVB检测灯购自光豪分析仪器公司;免疫沉淀试剂盒购自赛默飞世尔科技有限公司;S期激酶相关蛋白2(SKP2)过表达质粒购自中国PPL质粒与蛋白共享库;GAPDH抗体、辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG二抗均购自武汉爱博泰克生物科技有限公司,OGG1和SKP2抗体均购自英国Abcam公司。
1.2 细胞培养取出待复苏的SRA01/04细胞,置于37 ℃恒温水浴锅内迅速解冻,随后放入离心机中1000 r·min-1离心10 min。弃上清液后加入新鲜培养基(含体积分数10%胎牛血清和10 g·L-1青-链霉素的DMEM培养基),接种至培养瓶中。最后,将其置于含体积分数5%CO2、37 ℃细胞培养箱中继续培养。
1.3 细胞氧化损伤模型的构建待培养瓶中的细胞密度至80%左右时,用Hanks平衡盐溶液清洗细胞,加入PBS,在紫外灯下30 cm处进行照射。细胞分为UVB组和对照组,而UVB组根据照射时间不同又分为0 min、10 min、15 min、30 min、45 min照射组。待照射结束后,换新培养基继续培养24 h。
1.4 细胞转染将SRA01/04细胞接种于6孔板,待细胞密度达60%~70%时进行转染。分组设为空白对照组、转染空载质粒组和转染SKP2过表达质粒组。转染质粒组6孔板中转染试剂体积比VOpti-MEMVLipofectamine3000VP3000为250 μL75 μL5 μL,再加入2.5 μg转染质粒进行混合,室温下孵育15 min。之后,放入培养箱中孵育6 h,将细胞培养基更换为完全培养基,继续培养72 h后,供后续实验。再通过UVB照射构建损伤模型,分组设为空白对照组、UVB组、UVB+转染空载质粒组以及UVB+转染SKP2过表达质粒组,后续检测目的蛋白表达。
1.5 免疫沉淀实验根据实验要求处理细胞后,加入免疫沉淀裂解液(20 mmol·L-1Tris-HCl,100 mmol·L-1NaCl,体积分数1% TritonX-100),提取蛋白质上清。IP组分为IgG组、OGG1组、SKP2组,IP组进行免疫沉淀实验,用OGG1抗体沉下与OGG1结合的蛋白;用SKP2抗体沉下与SKP2结合的蛋白;Input组是总蛋白,未经免疫沉淀实验处理的细胞总蛋白。每组取400 μg蛋白原液,分别加入1 μL 对应的抗体后在摇床上孵育过夜。之后根据说明书,利用磁力架将抗体-蛋白复合物提取出来,进行蛋白免疫印迹实验。同时,本实验的Input组取30 μL蛋白原液以检测内源性或所转染蛋白的表达。实验重复3次。
1.6 蛋白免疫印迹实验检测各组细胞中不同因子的蛋白表达将细胞置于冰上,PBS清洗后加入200 μL蛋白裂解液(CMRIPA比值为1100)冰上裂解;提取蛋白上清后,采用BCA试剂盒检测蛋白上样量;凝胶电泳(80 V,120 min)分离蛋白;采用湿转法转膜(250 mA,2 h),随后将PVDF膜用封闭液室温封闭2 h;根据对应的抗体说明书配置一抗稀释液(泛素、OGG1、SKP2稀释度均为11000;GAPDH稀释度为16000),并置于4 ℃冰箱进行孵育过夜。第2天用TBST缓冲液漂洗后,加入辣根过氧化物酶标记的山羊抗兔二抗(稀释度为110 000),室温孵育2 h 。最后加入显影剂,在暗室内进行曝光显影。采用GAPDH作为实验内参,计算目的蛋白表达的灰度值。实验重复3次。
1.7 统计学方法本研究采用SPSS 22.0统计学软件进行数据分析。不同分组之间的蛋白表达量均采用单因素方差分析,两样本间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 LEC中OGG1蛋白的泛素化修饰及其E3泛素连接酶的预测免疫沉淀实验发现,OGG1存在泛素化修饰(图1A)。利用UbiBrowser软件(http://ubibrowser.ncpsb.org.cn/v2/)进行预测发现,SKP2可能是导致OGG1发生泛素化修饰的潜在E3泛素连接酶(图1B)。
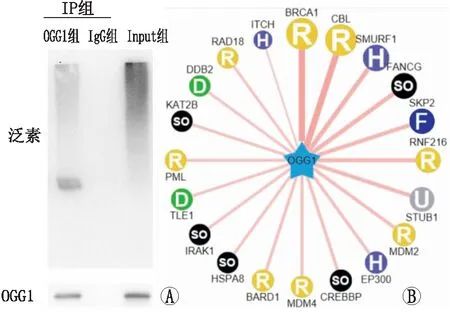
图1 OGG1存在泛素化修饰并预测其相关的E3泛素连接酶 A: 免疫沉淀实验检测发现OGG1存在泛素化修饰;B :UbiBrowser软件预测显示,SKP2可能参与调控OGG1的泛素化修饰。
2.2 SKP2与OGG1之间相互作用为验证SKP2能够与OGG1发生结合,通过免疫沉淀实验检测出与SKP2相互作用的蛋白,然后利用免疫印迹实验检测OGG1蛋白,结果显示:SKP2与OGG1存在一定的结合能力,表明SKP2有可能参与介导OGG1蛋白的泛素化修饰(图2)。
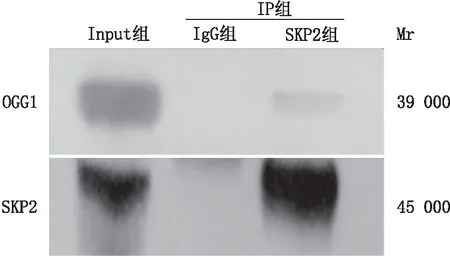
图2 免疫沉淀实验观察SKP2与OGG1之间的相互作用
2.3 各组SRA01/04细胞中SKP2蛋白表达变化蛋白免疫印迹实验检测SKP2在各组细胞中表达变化,结果显示:在UVB照射10 min时,SKP2蛋白的相对表达量明显比其他照射时间减少,且与对照组相比也减少,差异具有统计学意义(P<0.05)(图3)。随着UVB照射时间的递增,SRA01/04细胞中SKP2蛋白相对表达量呈剂量依赖性增加。因此,根据实验需要后续实验细胞氧化损伤模型均采用UVB照射10 min后孵育24 h。
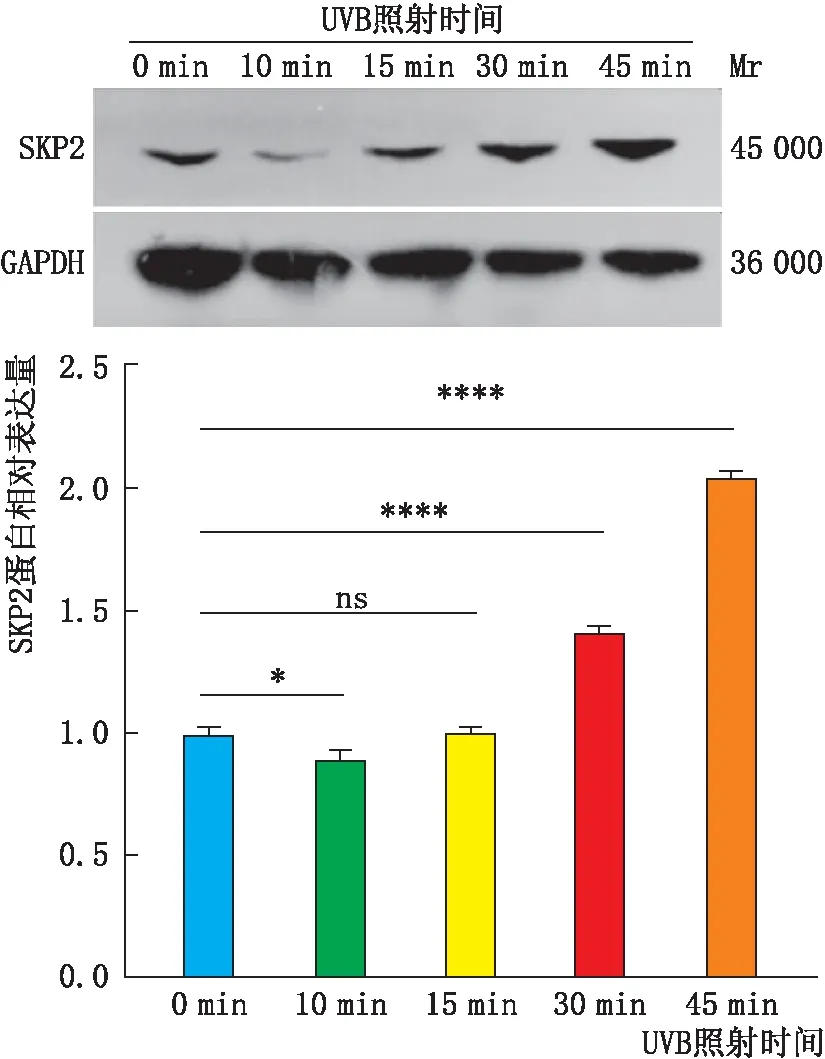
图3 细胞中SKP2蛋白在UVB照射后不同时间的表达变化 免疫印迹实验检测发现,在UVB照射时间梯度升高时,SKP2蛋白表达先减少后增加,且在照射10 min时表达最低。*P<0.05,****P<0.001,ns:P>0.05。
2.4 SKP2过表达模型验证蛋白免疫印迹实验结果显示:空白对照组、转染空载质粒组和转染SKP2过表达质粒组细胞中SKP2蛋白的相对表达量分别为1.040±0.007、0.920±0.008和1.330±0.020;与转染空载质粒组相比,转染SKP2过表达质粒组细胞中SKP2蛋白的表达显著上调(P<0.05)(图4),表明SKP2过表达模型构建成功。
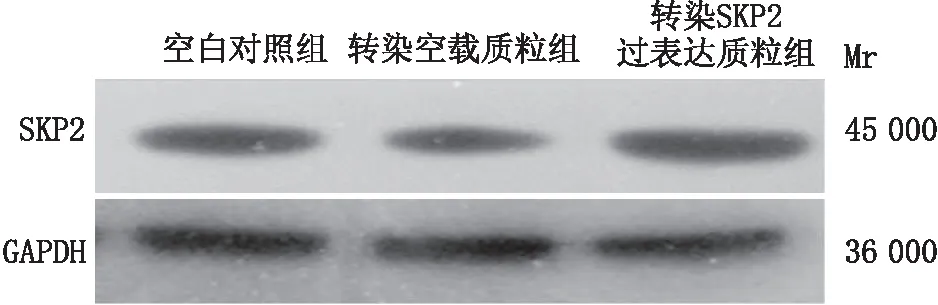
图4 SKP2过表达效率的验证 与空白对照组及转染空载质粒组相比,转染SKP2过表达质粒组细胞中SKP2蛋白表达显著增加。
2.5 OGG1蛋白在SKP2过表达模型中的表达变化采用免疫印迹实验检测各组细胞中OGG1的表达情况,结果显示,空白对照组、UVB组、UVB+转染空载质粒组和UVB+转染SKP2过表达质粒组中OGG1蛋白的相对表达量分别为1.05±0.01、5.05±0.16、5.20±0.07 和3.83±0.10;与UVB+转染空载质粒组相比,UVB+转染SKP2过表达质粒组SRA01/04细胞中OGG1蛋白相对表达量明显降低,差异有统计学意义(P<0.05)(图5)。
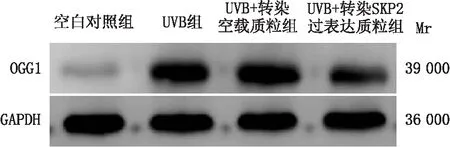
图5 OGG1蛋白在SKP2过表达模型中的表达变化
3 讨论
ARC的发生发展过程受多种因素的影响,包括UVB照射和氧化损伤等[11-12]。有研究证实,UVB是ARC发生发展的重要环境因素之一[5]。LEC通过吸收大量UVB,引起DNA氧化损伤、蛋白质翻译后修饰(如泛素化)、细胞周期改变等分子水平上的改变,进而导致晶状体内功能蛋白质失稳发生错误折叠。有研究显示,在全身老年性(年龄相关性)疾病、神经退行性疾病和肿瘤中,氧化应激(如UVB、自由基等)所致受损的DNA氧化损伤修复蛋白(如P53、ATM、WRN等)无法及时被泛素化降解时,一方面这些蛋白不仅发挥不了损伤DNA修复的作用,同时这些蛋白聚集体还会引起蛋白毒性,干扰多种细胞过程,最终引起上述疾病的发生[13-16]。
众所周知,泛素蛋白酶体系统(UPS)是真核细胞清除发生错误折叠蛋白的一种重要的降解手段[17]。在前期研究中[7],我们利用UVB照射LEC细胞株构建细胞氧化损伤模型,通过实验检测发现,在氧化损伤环境下,晶状体内蛋白质的泛素化水平明显升高;同时通过整合蛋白组学和泛素修饰组学数据分析发现,POLR2B和POLR2L等多个DNA氧化损伤修复蛋白存在显著的泛素化修饰,表明UPS在LEC的DNA氧化损伤蛋白质量控制中可能发挥着重要的作用,但其在ARC中的具体调控机制尚缺乏相关研究报道。
UPS由E1、E2、E3、去泛素化酶以及蛋白酶体共同组成,其具体的形成过程如下:当ATP持续供能的前提条件下,E1能够结合泛素C端的Cys残基并激活泛素;而活化后的泛素则由E1转移至E2形成名为E2-泛素巯基酯的中间产物;随后E2和不同类型的E3共同识别底物蛋白,形成泛素化修饰;最后泛素化修饰的蛋白被26 S蛋白酶体识别并降解。在泛素化降解的过程中,E3因能够识别底物和招募E2,而对蛋白质的泛素化修饰起到关键调控作用。目前已鉴定出的E3有600余种,根据其特征性结构域和介导泛素连接至底物机制的不同,将E3分为3大类:RING E3s、HECT E3s以及RBP E3s[4],其中RING E3s是最常见的一类泛素连接酶。而SCF(SKP1-Cull-F-box)是RING E3s泛素连接酶中最大的一个家族;已知SKP2是SCF降解体系中关键一员,起到识别底物的功能[18]。本研究发现:在体外构建的LEC氧化损伤模型中,细胞中SKP2的表达水平在损伤初期(10 min)呈下降趋势,随着UVB照射时间的延长,细胞内待泛素化降解的蛋白不断累积,其表达水平也逐渐升高,说明SKP2在LEC的氧化损伤过程中发挥一定的调控作用。
近年来有研究发现, SKP2通过靶向降解DNA损伤修复相关的蛋白(如P27、P21、P57和Foxo1等)影响细胞周期的进程,从而发挥抑癌的功能[19-22]。在本研究中,我们首先通过免疫沉淀实验确定OGG1蛋白存在泛素化修饰。OGG1是DNA碱基切除修复通路途径的重要蛋白之一[23]。本课题组前期研究中已发现在早期轻度三种类型ARC患者样本中OGG1的mRNA和蛋白表达均显著升高[9],但影响其蛋白表达改变的具体调控机制尚未见相关报道。因此,本研究利用软件预测了可能与OGG1蛋白发生结合的E3泛素连接酶,并采用免疫沉淀实验验证发现SKP2与OGG1之间能够发生相互作用。此外,结合前期研究发现,OGG1蛋白的表达在LEC氧化损伤过程中与SKP2蛋白呈相反的表达趋势,揭示了早期ARC发生过程中的OGG1蛋白应激性升高的潜在原因。因此,为了进一步探讨SKP2对OGG1表达的影响,本研究转染过表达质粒增加了SKP2蛋白的表达观察OGG1的表达,结果显示,氧化损伤早期当细胞内SKP2蛋白的表达升高时,OGG1蛋白的表达随之下降,进而影响LEC内损伤DNA的修复过程,导致ARC的发生。
综上所述,E3泛素连接酶SKP2在UVB诱导的早期LEC氧化损伤模型中表达减少,并随着照射时间和损伤的累积而逐渐增加。进一步研究发现,SKP2能够介导DNA氧化损伤修复蛋白OGG1发生泛素化修饰,通过调控OGG1蛋白的表达进而影响损伤DNA的修复过程,参与ARC的发生发展。
