饲料和不同生活时期对人工饲养大壁虎肠道菌群的影响
2022-02-24赵成坚全琛宇徐永莉姜建萍
赵成坚 全琛宇 霍 娟 徐永莉 姜建萍*
(1.广西壮族自治区药用植物园,南宁,530023;2.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁,530001)
大壁虎(Gekkogecko),又名蛤蚧,属爬行纲(Reptilia),有鳞目(Squamata),蜥蜴亚目(Lacertilia),壁虎科(Gekkonidae)动物。作为一味传统中药,大壁虎具有调节免疫[1-2]、抗肿瘤[2]、平喘[3]、抗炎[4]及抗衰老[5]等作用。同时,大壁虎亦可作为保健品与药膳等,有补肺益肾、纳气定喘、助阳益精的功效[6]。随着市场对大壁虎需求量的日益增加,现有野生大壁虎资源已无法满足需求,人工养殖大壁虎成为了解决大壁虎紧缺的有效途径。然而,大壁虎人工养殖过程中广泛出现畸形、生殖困难、疾病发病率高及发育不良等问题,严重影响养殖产业的发展。多项研究表明,这些问题可能与大壁虎特有的食性与饮食结构密切相关[7]。大壁虎一般只吃活昆虫,如蝗虫(Locustamigratoriamanilensis)、黄粉虫(Tenebriomolitor)、土鳖虫(Eupolyphagasinensis)及大麦虫(Zophobasmorio)等。长时间饲喂单一品种的昆虫易引发肢体畸形、肠炎等营养代谢类疾病,与肠道菌群失衡密切相关。同时,每年12月至次年3月为大壁虎的冬眠期,这期间停止摄食,其肠道菌群结构基本不变,是调节大壁虎机体生理功能的重要时期。肠道菌群具有促进肠黏膜免疫系统生长发育和调控黏膜屏障与免疫功能的双重作用[8],孟祥晨等[9]通过比较婴儿双歧杆菌(Bifidobacteriuminfantis,BI)和长双歧杆菌(B.longum,BL)对正常小白鼠免疫功能的调节作用,发现2株菌均对正常BALB/C小白鼠的免疫功能具有正相调节作用,并具有良好调节肠道菌群能力;叶明等[10]通过移植正常小鼠的粪便菌群至帕金森病小鼠模型,发现粪菌移植小鼠模型恢复了一定的神经保护作用,表明正常平衡的肠道菌群对机体的生理健康起关键调节作用。目前,对于大壁虎肠道菌群的研究几无报道,研究多集中于养殖、鉴定等表观方面。因此,全面深入地探究肠道菌群与饮食结构及健康的关系,是科学养殖大壁虎的关键。本研究通过16S rDNA高通量测序技术比较了冬眠期与捕食期的大壁虎胃肠道微生物菌群差异及饲喂不同昆虫饲料时大壁虎胃肠道微生物菌群的差异,全面分析大壁虎胃肠道微生物的多样性及其对大壁虎生长发育周期的影响,旨在为优化人工饲养大壁虎的膳食结构及养殖程序提供必要的理论基础。
1 材料与方法
1.1 试验材料
试验材料为3岁以上(成年)大壁虎,由广西药用植物园大壁虎养殖基地提供。大壁虎统一饲养于实验室养殖笼中,保持良好通风,避免潮湿,相对湿度控制在60%左右,温度控制在25~30 ℃,健康且外观无明显伤痕,平均体重为(65.50±8.30)g,雌雄不限。
1.2 大壁虎的饲养管理及样品搜集
2018年5月从养殖基地统一饲养的大壁虎中挑选体型相近的健康成年大壁虎25只,称重后随机分为5组,每组5只。前4组分别单独饲喂蝗虫、黄粉虫、土鳖虫和大麦虫,第5组饲喂等比例混合昆虫(蝗虫、黄粉虫、土鳖虫、大麦虫)。将昆虫置于养殖室内的浅盆中,供其自由采食,每日及时清理未吃完的昆虫及昆虫残渣,打扫室内环境卫生。饮水中不添加任何药物。3个月内,每周称量各饲养组大壁虎的体重,并于3个月后收集各组大壁虎的新鲜粪便,送至测序公司进行高通量测序。准备进入冬眠期时,将大壁虎集中转移到养殖箱内,温度控制在20~25 ℃,相对湿度控制在65%~70%。冬眠期收集第5组大壁虎的新鲜粪便,送至测序公司进行高通量测序。
1.3 16S rDNA测序分析
冻存粪便样本送至北京诺禾致源科技股份有限公司(北京)进行16S rDNA测序。采用CTAB法[11]提取黏膜样本的DNA,检测其纯度与浓度后用无菌水稀释至1 ng/μL。合格样品与其特异性引物配置PCR反应体系,设置对应的PCR反应参数进行PCR扩增,对其产物进行混样和纯化。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒(Illumina,美国)进行文库构建,构建好的文库经过Qubit和Q-PCR定量。文库合格后,使用NovaSeq 6000进行上机测序。下机数据根据Barcode序列和PCR扩增引物序列特异性标记为不同样本的数据,去除Barcode序列和引物序列后使用FLASH软件(v1.2.7)[12]对各样本reads进行拼接,得到Raw Tags。Raw Tags经过严格的过滤后[13-15],去除低质量的Tags和嵌合体序列,得到最终的有效数据。
1.4 测序数据分析
使用Uparse软件[16](v7.0.1001)对所有有效标签(effective tags)进行聚类分析,将一致性达97%的序列聚类成为OTUs,同时筛选OTUs的代表序列,使用Mothur方法与SILVA132[17]的SSUrRNA数据库[18]对其进行物种注释。分别统计界、门、纲、目、科、属、种各分类阶元样本的群落组成,并使用MUSCLE v3.8.31[18]进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后,对各组数据进行均一化处理,再进行Alpha多样性、Beta多样性、环境因子关联分析等。
1.5 统计学处理
数据运用SPSS 19.0进行统计分析,各比较组样本的菌群差异比较均采用非参数检验(Mann-WhitneyU秩和检验)。
2 结果与分析
2.1 不同昆虫饲料对大壁虎的增重效果
饲喂单一品种昆虫对大壁虎增重效果不尽相同(图1)。其中,饲喂蝗虫和土鳖虫的大壁虎体重变化趋势相近,饲喂黄粉虫和大麦虫的大壁虎体重变化趋势相近。在单一昆虫饲料组中,蝗虫组对大壁虎的增重效果最佳,混合昆虫饲料组对大壁虎的增重效果优于单一昆虫饲料组。
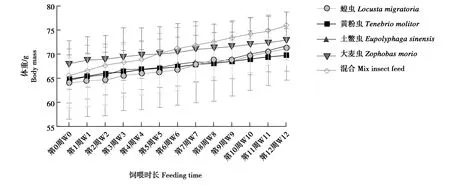
图1 饲喂不同昆虫时大壁虎的体重
2.2 不同昆虫饲料对大壁虎肠道菌群组成的影响
在属水平上,蝗虫组肠道菌群中占比较高的为拟杆菌属(Bacteroides,20.81%)、未知肠杆菌属(unidentified Enterobacteriaceae,11.31%)及Parabacteroides菌属(9.84%);黄粉虫组肠道菌群中占比较高的为拟杆菌属(27.16%)、Parabacteroides菌属(13.09%)及沙门氏菌属(Salmonella,9.50%);土鳖虫组肠道菌群中占比较高的为拟杆菌属(28.48%)、Lachnoclostridium菌属(8.19%)及氏菌属(6.07%);大麦虫组肠道菌群中占比较高的为拟杆菌属(35.27%)、立克次氏小体属(Rickettsiella,8.86%)及考拉杆菌属(Phascolarctobacterium,6.12%)。结果表明,不同昆虫饲料会显著影响大壁虎肠道微生物的菌群结构(图2);在结构上,蝗虫组和土鳖虫组较接近,黄粉虫组与大麦虫组较接近(图3)。
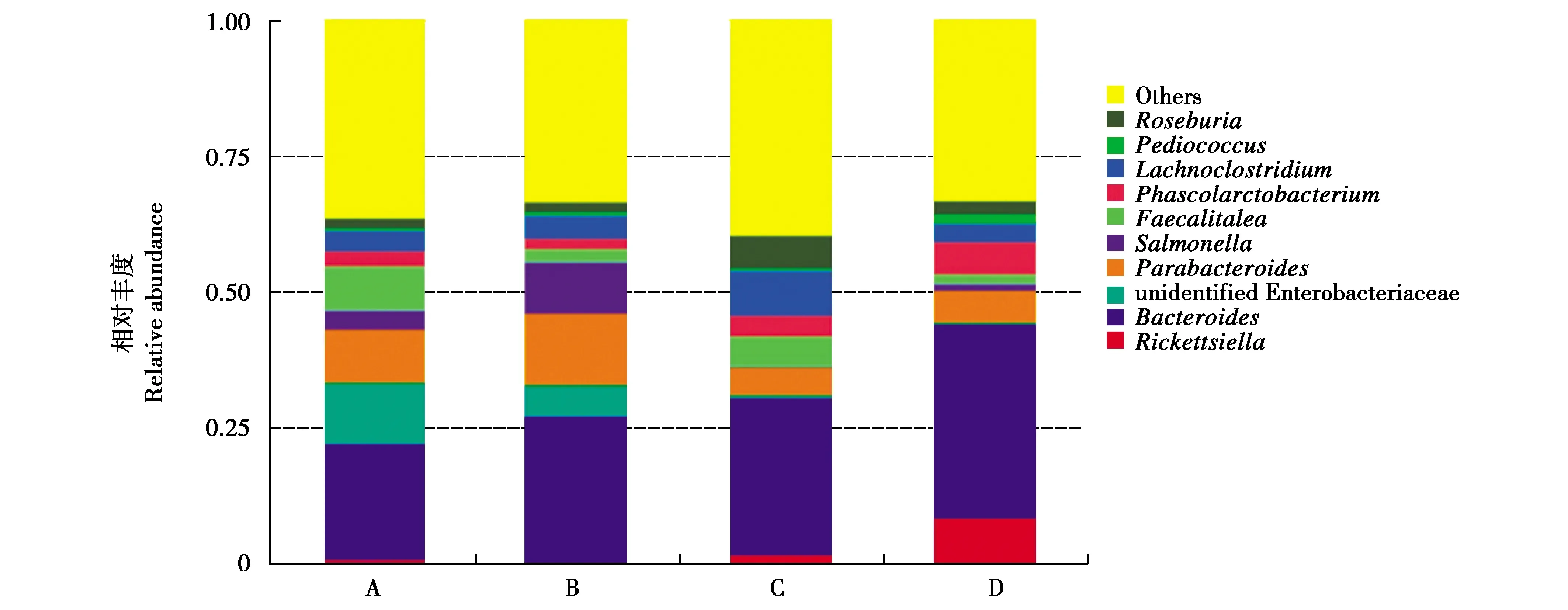
图2 饲喂不同昆虫时大壁虎肠道菌群属水平丰度前10的菌类

图3 饲喂不同昆虫时大壁虎肠道菌群门水平结构相似度聚类
2.3 冬眠期与捕食期大壁虎肠道菌群结构组成
在属水平上,冬眠期肠道菌群中占比最高的为拟杆菌属(9.86%),其次为考拉杆菌属(7.08%)及Akkermansia菌属(8.54%);捕食期肠道菌群中占比最高的为拟杆菌属(14.49%),其次为考拉杆菌属(8.19%)及Parabacteroides菌属(8.74%)。二者结构相似度很高(图4)。
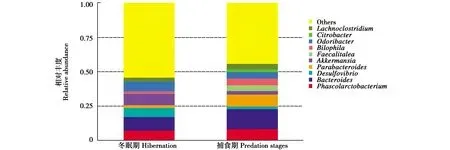
图4 冬眠期与捕食期大壁虎肠道菌群属水平丰度前10的菌类
2.4 样品复杂度
QIIME软件计算样品复杂度指数(Observed-species,Chao1,Shannon,Simpson,ACE,Goods-coverage,PD whole tree)计算结果显示:冬眠期大壁虎肠道菌群的物种总数高于捕食期,且群落多样性高(图5)。其中,由于PD whole tree是一个兼顾考虑进化距离的多样性评估指数,在计算时会考虑到各菌群直接的一个进化关系,可能是因为捕食期摄入饲料会改变肠道菌群的结构,而这种动态变化的过程中,各菌群之间存在一定的相互作用关系,所以该指数高。
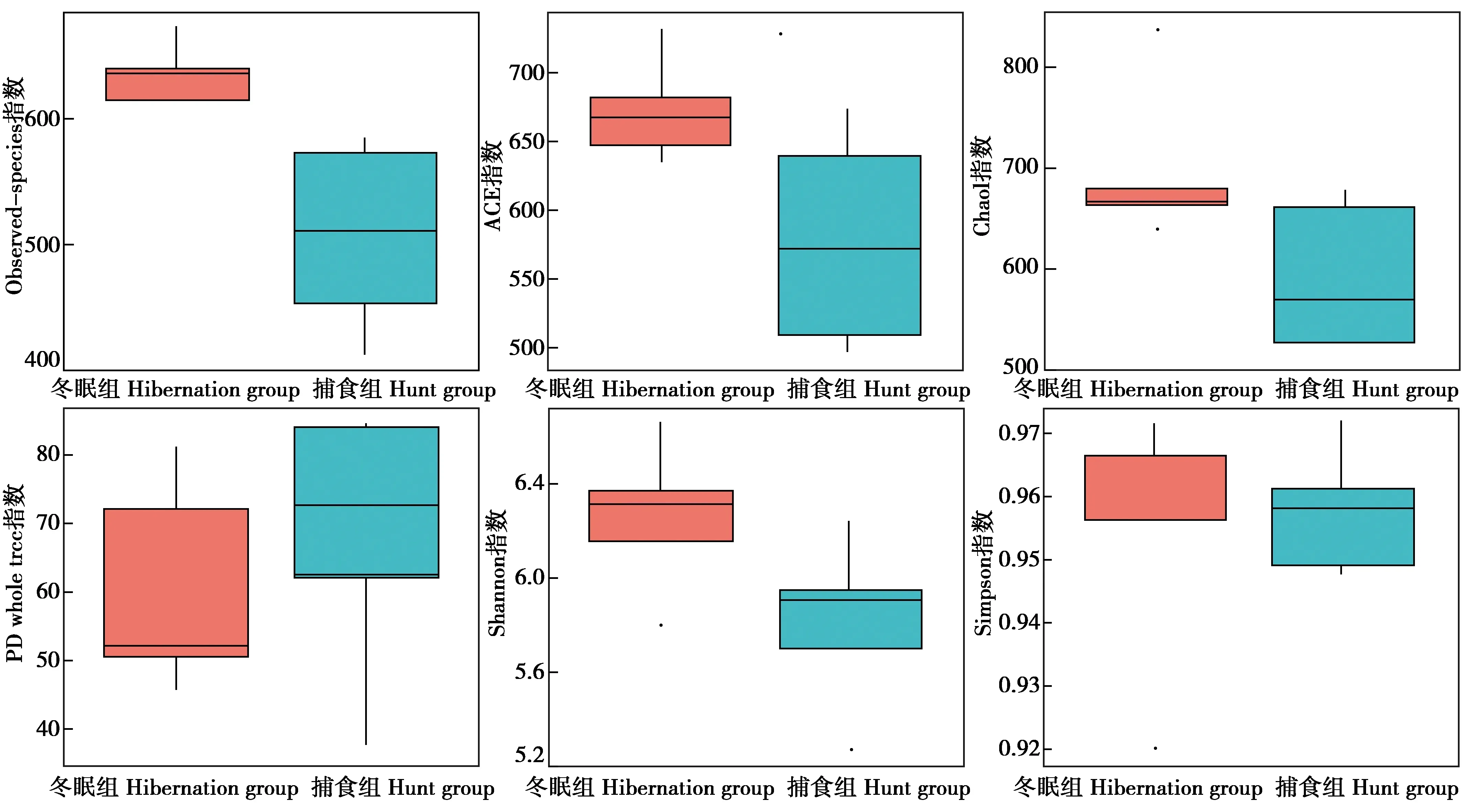
图5 不同时期大壁虎肠道菌群样品复杂度
2.5 大壁虎肠道菌群Beta多样性
Beta多样性指数结果显示,冬眠组样品的组内差异显著小于捕食组样品,这表明冬眠期大壁虎肠道菌群更为稳定(图6)。
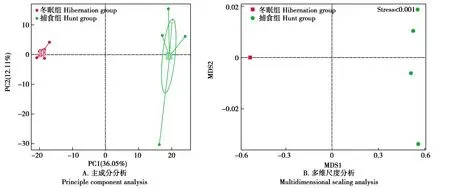
图6 大壁虎肠道菌群Beta多样性
2.6 大壁虎肠道菌群组间物种门水平差异
经组间的t-test检验,在门水平上,冬眠期与捕食期差异显著(P<0.05)的菌种主要为疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、蓝藻门(Cyanophyta)及Saccharibacteria门(图7)。

图7 大壁虎肠道菌群组间物种门水平差异
3 讨论
大壁虎因其特殊的食性,几乎只吃活昆虫,因此人工饲养时需饲喂活昆虫。本研究通过比较蝗虫、黄粉虫、土鳖虫及大麦虫等大壁虎喜食的常见饲料,发现饲喂蝗虫和土鳖虫的大壁虎生长速度相近,饲喂黄粉虫和大麦虫的大壁虎生长速度相近,这与它们的肠道菌群结构相近有关,而饲喂蝗虫的大壁虎生长最快。相较于单一饲喂一种昆虫的大壁虎,饲喂混合昆虫的大壁虎生长速度较快。前期研究表明,饲喂单一昆虫易致畸,饲喂混合昆虫不仅可以提高大壁虎的生长速度,还可以降低畸形的概率。
近年来,高通量测序技术因其高准确性与高灵敏度的优势,已成为研究肠道微生物的重要手段之一。通过该技术,可较深入地分析样品中微生物的多样性及全面性。本研究通过比较分别饲喂蝗虫、黄粉虫、土鳖虫及大麦虫的大壁虎粪便样品,发现饲喂不同类型的昆虫使大壁虎的肠道菌群结构发生变化,结合不同饲料导致生长速度不同的结果,可知这些变化的菌群是调节大壁虎生长速度的重要因素。对各组粪样的生物学分析结果显示,丰度最高的菌群为拟杆菌属,其在各组中的占比分别为20.81%(蝗虫组)、27.16%(黄粉虫组)、28.48%(土鳖虫组)及35.27%(大麦虫组)。混合饲喂4种昆虫后,拟杆菌属的占比为14.49%,此时该组大壁虎生长速度远快于单一饲料组,可见拟杆菌属在肠道菌群中的占比与大壁虎生长速度存在一定的关联。拟杆菌属正常寄居于人和动物的肠道、口腔、上呼吸道和生殖道,当菌群失调时,可导致内源性感染,如肝脓肿、转移性脓肿、腹膜炎、尿路感染等[19-20]。朱万英等[21]通过比较肥胖儿童与正常儿童的肠道拟杆菌属相似性及多样性差别,发现肥胖儿童肠道拟杆菌属的多样性及相似性降低,表明拟杆菌属与机体生长存在一定的关联。郭慧等[22]通过添加水解单宁改善对虾生长速度,添加组对虾肠道菌群中拟杆菌门的比例降低。本试验结果与上述研究结果类似,表明拟杆菌属确实与机体生长相关。张广文等[23]使用大豆异黄酮对骨质疏松大鼠模型进行了治疗,发现大豆异黄酮可通过改善大鼠肠道菌群来改善骨质疏松,其中,治疗组肠道中拟杆菌属水平显著降低,表明拟杆菌属水平与骨健康相关,降低其丰度可维持机体正常骨生长,避免畸形。陈弋等[24]比较了岭南湿热症小鼠与健康小鼠的肠道菌群,发现湿热症小鼠的肠道中拟杆菌属丰度呈特征性增多(P<0.05)。宋军民等[25]比较了炎症性肠病患者肠道菌群变化,发现炎症性肠病患者的肠道中拟杆菌属数量明显增加。潘勇[26]比较了大肠癌患者与大肠腺瘤患者的肠道菌群,发现大肠癌组患者的拟杆菌属水平均明显高于大肠腺瘤组和对照组(P<0.05)。这些研究表明拟杆菌属水平与疾病呈明显正相关。因此,通过改变饲料的组成,来调节大壁虎肠道中拟杆菌属的水平,可提高大壁虎的生长速度,并预防疾病。
蝗虫组大壁虎肠道中丰度第2高的优势菌群Parabacteroides菌属(13.09%)也与大壁虎的生长密切相关。Wang等[27]揭示肠道共生菌Parabacteroidesdistasonis的含量与肥胖、非酒精性脂肪肝、糖尿病等疾病状态呈显著负相关,提示其可能在糖脂代谢方面发挥正向调节作用。土鳖虫组中的丰度第2高的Lachnoclostridium菌属(8.19%)与疾病相关。汪群[28]发现腹泻仔猪粪便中Lachnoclostridium菌属的相对丰度显著低于健康仔猪,表明其与仔猪腹泻密切相关。这些大壁虎胃肠道的优势菌群与宿主的健康密切相关,其含量的改变可明显影响宿主的健康。因此,通过不同昆虫饲料的搭配来调节肠道菌群结构,是有效提高养殖效率的手段。
通过比较捕食期和冬眠期的大壁虎粪便样品,发现其菌群结构较为相似,其最主要的差异菌群为放线菌门(P<0.01)。放线菌多寄居于人和动物口腔、上呼吸道、消化道及泌尿生殖道,当机体抵抗力降低、口腔卫生不良、拔牙或口腔黏膜受损时,可致内源性感染,引起放线菌病。冬眠组大壁虎肠道中放线菌显著增加,在冬眠期大壁虎患放线菌病的概率大大提高,需注意提高大壁虎的抵抗力,同时注意通风保暖。
综上所述,本研究证明饲喂不同的昆虫会显著影响大壁虎生长速度,混合昆虫饲料较单一昆虫饲料有促生长及防畸形的作用。不同昆虫饲料可通过调节大壁虎肠道中拟杆菌属的水平来调节大壁虎生长速度与预防疾病。通过调节膳食结构,使拟杆菌属、Parabacteroides菌属、Lachnoclostridium菌属等参与调节大壁虎生长与健康的优势菌群占比趋于稳定,可有效提高大壁虎的养殖效率。
