记忆性干细胞样T细胞:从哪里来?
2022-02-24杨敏捷综述王小林审校
杨敏捷(综述) 王小林△(审校)
(1复旦大学附属中山医院介入治疗科 上海 200032;2上海市影像医学研究所 上海 200032;3国家放射与治疗临床医学中心 上海 200032)
人体内稳态需要自我更新和分化之间的精确平衡。不同组织中存在干细胞,其中少数保留再生潜能,而大多数细胞进入不可逆分化过程,最终产生特定类型的细胞。干细胞存在于造血干细胞、神经干细胞、肠、皮肤、心肌、肺等组织中[1]。人体对于某种抗原能够产生长达几十年甚至终身的特异性免疫记忆[2]。理论上存在一种能够自我更新以及分化为其他类型T细胞的记忆性干细胞样T细胞(stem cell-like memory T cells,TSCM)[3]。2006年,人们在移植物抗宿主疾病小鼠模型中发现一群长期生存、具有干细胞特性的记忆T细胞,逐步揭开了TSCM神秘的面纱[4]。由于TSCM所占比例稀少(正常人外周血中TSCM占T细胞的2%~3%)[5],确定人类的TSCM表型特征十分具有挑战性。最近,通过TSCM细胞标记物CD62L、CCR7、IL2Rβ、BCL-2和趋化因子(C-X-C基序)受 体3(chemokine(C-X-C motif)receptor 3,CXCR3)的表达可在多个物种中鉴别出TSCM[4-5]。使用羧基荧光素琥珀酰亚胺酯(carboxy fluorescein N-succinimidyl ester,CSFE)追踪细胞分裂的实验已经证明:TSCM细胞能够自我更新,且分化为 不 同 类 别 的T细 胞[6]。虽 然 中 央 记 忆T细 胞(central memory T cell,TCM)和 效 应 记 忆T细 胞(effector memory T cell,TEM)也可以进行自我更新,但是只有TSCM细胞能够产生所有3种记忆T细胞以及效应T细胞(effector T cell,TEFF)[5]。
细胞免疫治疗是肿瘤治疗的新方向,其中基因修饰T细胞(如嵌合抗原受体T细胞,CAR-T)已经在血液系统肿瘤中取得突破性进展。但是实体肿瘤的CAR-T细胞治疗效果欠佳。研究表明大部分的T细胞在输注后耗竭失能[7],而输注记忆性T细胞等其他具有长期生存能力的T细胞亚型有望提高临床疗效[8-11]。采用传统的细胞培养方案扩增T细胞会导致T细胞分化和增殖潜力的丧失。由于TSCM能够更好地适应肿瘤微环境并且能够长期生存分化为其他类型的T细胞,这使其成为肿瘤细胞免疫治疗的理想工具[12-13]。目前,首个采用Piggybac基因编辑技术以抗B细胞成熟抗原(B cell maturation antigen,BCMA)为靶点的CAR-TSCM的临床试验正在进行中(NCT03288493)。
通过小分子药物在体外诱导或者重新编程诱导干细胞、心肌细胞、神经细胞、β-胰岛细胞等[14-15]。TSCM表型研究的重要进展也是在小分子药物处理下诱导产生足够量的细胞(用于细胞测序,发现表型特征)的前提下而取得[5-6,16]。另外,抗原识别、共刺激配体和细胞因子共同调控T细胞活化和分化。本文将主要聚焦于TSCM,对其诱导、转化、培养机制的最新研究进展进行综述。
T细胞的分化幼稚T细胞(naïve T cell,TN)在 接 受 抗 原 刺 激 后 表 达CD45RO[17],分 化 为TM及TEFF。根据是否表达淋巴结归巢标志CCR7,TM分为TCM(CCR7+)及TEM(CCR7-)[18]。与TN比较,TM在抗原再次刺激时能够迅速增殖,释放TNFα、IL-2、IFN-γ等细胞因子,转化为TEFF细胞[19]。TCM细胞保持表达CD62L及CCR7但TEM两者均为阴性,前者能够更高效地释放IL-2而后者则释放更多的IFNγ从而更具细胞毒性[18]。越来越多的研究发现T细胞的分化呈渐进式:效应相关基因的表达随着TN细胞→TSCM细胞→TCM细胞→TEM细胞逐渐升高,而初始相关基因的表达则逐渐丢失[5,20];T细胞效应相关分子的转录因子随着细胞分化程度去甲基化并处于准备表达的状态,在IL-5、IL-7介导的细胞增殖中效应分子的去甲基化得以保存而CCR7、Tcf7位点则 逐 渐 甲 基 化[21]。TSCM是 幼 稚T细胞接受抗原刺激后分化最少的一群T细胞其基因表达谱更接近于TM。
2006年Takahashi等[22]报道导入4种 转 录因子将体细胞转化为干细胞的iPSC技术。iPSC技术开启了人类编辑细胞的新篇章。近年来,人们利用不同的细胞谱系特异性转录因子组合,通过iPSC技术成功诱导出神经细胞、心肌细胞、肝细胞、β-胰腺细胞[23-26]。然而,用于递送重编程因子的转基因载体一般是病毒,这对干细胞的临床应用产生影响。小分子药物可取代部分转录因子,调控相关通路促进干细胞的产生[27]。近年来,基于这种思维以及前期对于T细胞记忆产生机制相关通路的研究,利用小分子药物促进TSCM的分化取得了重大的研究进展(表1)。
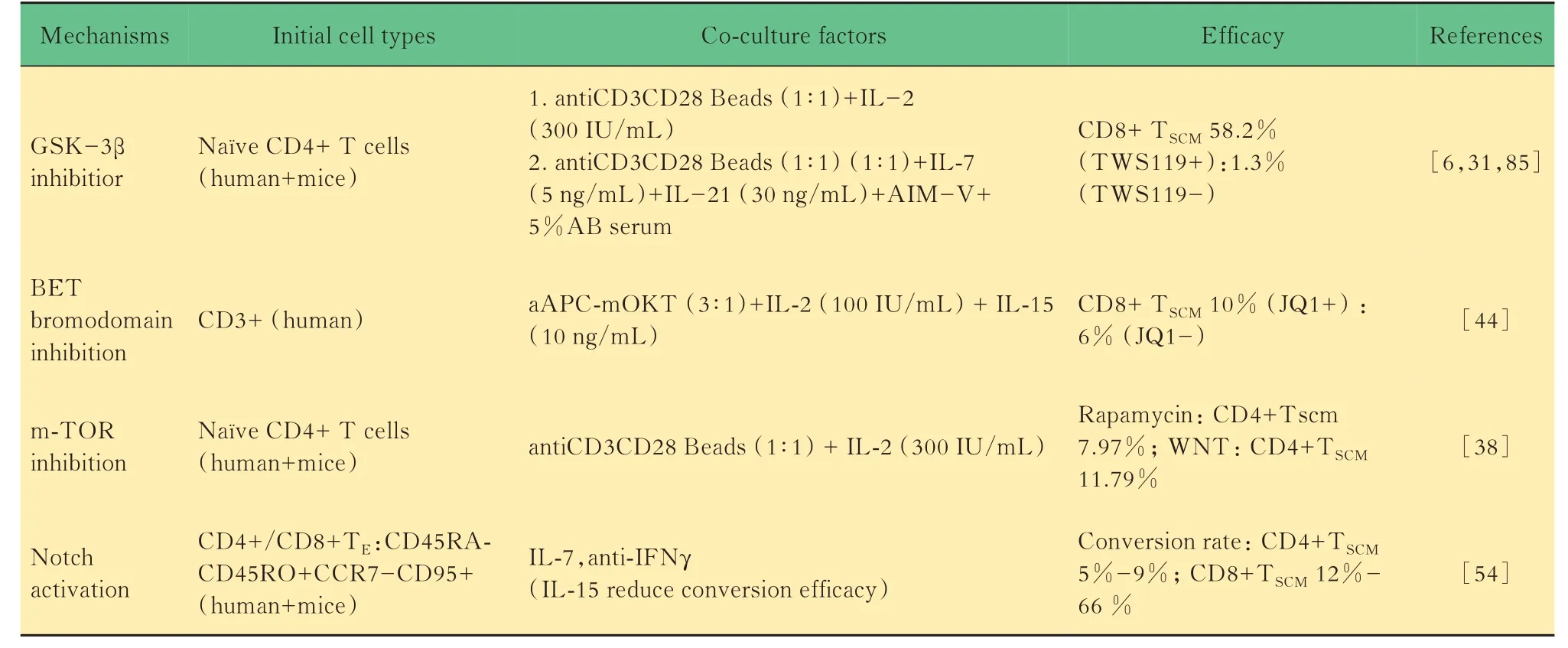
表1 TSCM体外诱导培养的机制Tab 1 Mechanisms of in vitro induction of TSCM
WNT信号通路在TSCM中的作用WNT信号对维持干细胞的自我更新具有重要的作用,通过GSK3β抑制剂激活WNT通路可以增加iPSC的转换效率[28-30]。T细胞在胸腺的发育、分化、成熟中WNT信号通路同样扮演着重要的角色。成熟的T细 胞 表 达WNT信 号 通 路 分 子LEF1和TCF1[31]。另外LEF1及TCF1在TN受到抗原刺激后降低表达[32]。Gattinoni等[6]发 现TWS-119(GSK3β抑 制剂)抑制TN细胞向TEFF细胞分化,产生一群CD44lowCD62LhighSca-1highCD122highBcl-2highTSCM。这群细胞能在小鼠体内长期生存且在大量增殖后有将近一半的细胞依然保持TSCM的特性。相较于TEM及TCM,TSCM细胞在体内具有更加高效的抗肿瘤能力。值得注意的是研究中每只小鼠所注射的T细胞量为5×104,这仅仅是CAR-T常用方案剂量的千分之一。GSK3β抑制剂的使用能够产生足够量的TSCM,这为确定人TSCM的表型提供支持。进一步研究发现,CD95和IL-2Rβ的表达能够区分人类的TN及TSCM。TSCM在α-CD3/CD2/CD28微球的刺激下迅速产生IFN-γ、IL-2及TNFα。腹腔注射靶向间皮素的TSCM相较于TEM及TCM明显延长晚期(模型建立3个月后)腹腔间皮癌小鼠生存期[5]。
mTOR信号通路在TSCM中的作用mTOR是一种调节细胞生长的代谢酶。mTOR整合PI3KAKT通路的细胞因子和生长因子信号以及WNTGSK3β等信号,是调节代谢的枢纽[33]。雷帕霉素能够特异性结合FKBP12蛋白阻断mTORC1信号通路,是器官移植术后常用的免疫抑制药物[34-35]。近年来研究发现低剂量的雷帕霉素能够促进TM细胞的 分 化[36-37]。mTOR通 路 中mTORC1、S6K1及eIF4E参与调控TM的形成,mTOR是直接作用于T细胞从而发挥调控作用[36]。研究表明雷帕霉素或WNT激动 剂TWS119对mTORC1的抑制,可以 促进CD4+TSCM和CD8+TSCM细胞的诱导。药物诱导的TSCM细胞具有优越的在体长期增殖能力,WNT信号通路激活剂TWS119同时也抑制mTOR信号通 路[38]。这 与GSK3通 过 磷 酸 化TSC2以 依 赖 于AMPK-引发磷酸化的方式抑制mTOR途径类似[39-40]。当 然,TWS119是 否 能 够 通 过 独 立 于mTOR信号通路促进TSCM的产生还需要进一步研究。另外,值得注意的是该研究所用的细胞因子为IL-2(300 IU/mL)。联合其他促进记忆性T细胞产生及增殖的细胞因子可能进一步增加TSCM的比例,为其临床转化打下基础。
表观遗修饰信号通路调控诱导TSCM真核细胞的基因组被包装成被称为核小体的紧密折叠结构。核小体可以通过控制转录因子对DNA的可及性来协调细胞类型特异性基因表达。在细胞分化过程中,命运决定因子的DNA以及染色质获得了多个层次的表观修饰[41]。调控DNA或者组蛋白修饰的小分子药物能够加速或者增加iPS的诱导、替代某些转录因子[14,42]。
Crompton等[43]对 体 外 产 生 的 小 鼠CD8+TCM、TEM和TSCM细 胞 进 行 了H3K4me3和H3K27me3修饰的全基因组分析,发现TCM和TEM高效富集了包括IFN-γ、GZMB和PRF在 内 的 效 应 分 子 位点的H3K4me3组蛋白修饰,这使得记忆细胞在再次遇到抗原时能够迅速表达这些基因。值得注意的是,虽然TSCM在许多检测到的效应分子位点处具有H3K4me3组蛋白修饰,其修饰程度与初始CD8 T细胞相似。Kakaradov等[20]通过单细胞测序发现,在CD8+TN第一次分裂后产生的子代细胞中,CD8+TE的前体细胞迅速上调几百个基因,而CD8+TM的前体细胞则只有几个特定基因的改变。理论上通过小分子药物调节相关因子的表观修饰可以影响T细胞的分化方向。
Kagoya等[44]通过高通量小分子筛选促进TSCM产生表观遗传学修饰靶点。研究发现JQ1在体外刺激CD8+TN细胞后,TSCM和TCM细胞增加。在体内,JQ1处理的细胞表现出更好的细胞生存、细胞增殖能力和细胞因子产生能力。JQ1是含溴结构域蛋白的BET家族的抑制剂。JQ1处理后T细胞减少赖氨酸拉链转录因子(human basic leucine zipper transcription factor,BATF)表达。通过siRNA沉默BATF增加TSCM和TCM细胞群。这与之前报道的JQ1通过抑制BATF增强沉默信息调节因子(Sirtuin1,SIRT1)抑 制T-bet减少TE一致[45-46]。研究中细胞培养方案包括细胞因子为IL-2(100 IU/mL)及IL-15(10 ng/mL)。初始培养细胞为CD3+T细胞,JQ1处理后CD4+TSCM细胞的比例为10%左右。IL-15可以促进TM细胞的增殖。JQ1处理也同时显著降低T细胞mTOR通路中的S6K蛋白的磷酸化,同时其上游的AKT磷酸化状态没有改变。JQ1对于mTOR通路的作用位点可能在AKT的下游。这提示表观修饰调节小分子药物对于细胞命运的改变是通过多通路的调节而实现。Youngblood等[47]发现CD8+T细胞中的幼稚相关基因的甲基化可以逆转从而产生能够长期生存的CD8 TM细胞。表明记忆T细胞也可能起源于效应T细胞。DNA甲基转移酶3a(DNA Methyltransferase 3A,DnMt3a)在CD8+T细胞受到刺激后升高[48]。在TE细胞中DnMt3a特异性的靶向幼稚相关的基因为:Sell(Cd62L),Ccr7以及Tcf7。研究者通过CSFE标记CD62L(-)的T细胞,发现未分裂的第一代细胞可以通过去除Cd62L基因启动子的甲基化而重新表达CD62L蛋白[47]。另外的研究[49]表明,调节甲基化的TET2的丢失促进记忆性T细胞的产生。
Notch信号通路在TSCM中的作用Notch转 导通路是细胞高度保守的信号通路,参与调节不同的祖细胞和干细胞类型的增殖和分化。Notch信号与造血干细胞的维持、T细胞的分化及成熟有关[50-51]。另外,Notch与IL-2R、mTOR及T-bet形成正 反 馈促 进TE细 胞 的 产 生[52]。在iPS诱 导 方 面,抑 制Notch通路能够抑制p21从而显著提高了iPSC的产生[53]。这些信息似乎暗示Notch信号的阻断可以促进TM的生成。与此相反的是通过OP9-hDLL1系统激 活 人TEM(CD45RA+CD45RO-CCR7+CD95+)Notch信号能够高效地促进其转变为TSCM[54]。其潜在机制可能在于NOTCH-FOXM1代谢通路调控[55]。这也说明,激活状态的TEM也可以是TSCM的来源。通过测序发现,Notch诱导的TSCM的基因表达谱系与TWS119诱导的TSCM最为相似[54]。Notch信号可以促进TH17细胞的长期生存,这说明Notch信号在T细胞应答收缩和记忆阶段中可能发挥不同的作用[56]。TSCM转化研究中细胞培养的条件近乎苛刻,OP9-DL1系统、IL-7(10 ng/mL)以及IFN-γ抗体缺一不可。而加入IL-15则显著减少转化效率。这也提示细胞因子在Notch信号通路T细胞类别转换中扮演重要角色。
细胞因子在TSCM产生中的作用细胞因子全程参与T细胞的发育、成熟、分化、效应和记忆形成[57]。在TSCM的产生中也扮演着至关重要的作用。近年来,多项研究表明IL-7、IL-15及IL-21能够增加T细 胞 增殖 及 肿 瘤 杀伤 能 力[58-63]。IL-7及IL-15能够促进TSCM的产生,另外TSCM在IL-15或IL-7的作用下能够大量分裂、增殖,而且该组合产生TSCM的效率优于TWS119+IL-2[64]。为了培养临床应用级别的TSCM,Gattinoni等[5]采用逐步分离法从外周血中分离TN,培养基中加入5 ng/mL IL-7及30 ng/mL IL-21,9天后TSCM的比例高达52.2%±12.52%,而IL-2组TSCM的比例只有1.2%[5,65]。相较于体细胞,细胞因子对于T细胞的分化、生存及凋亡起着至关重要的作用。在对T细胞的重新编程、诱导转化中,必须考虑细胞因子的作用。令人深思的是,IL-2增强抗原诱导的脱中胚蛋白(Eomes)、颗粒酶B和CD44表达促进CD8+TN细胞向CD8+TE细胞分化。IL-21抑制IL-2Rα的表达并抑制IL-2介导的CD8(+)TE细胞表型获得,但IL-21在过继免疫治疗中显著增强了抗肿瘤效果[66],这与IL-21调控CD8+T细胞表达L-选择蛋白提高细胞体内的增殖有关。IL-2犹如T细胞之“兴奋剂”,使之疯狂,然后“消耗殆尽”。对于肿瘤或者慢性病毒感染,需要的是“持久的战斗”,IL-7、IL-15及IL-21所培育出的“战士”更具耐受性,能够以一当十。
不对称分裂与TSCM不对称分裂是干细胞的特征之一[67]。T细胞在穿越血管内皮、与肿瘤组织接触、辅助细胞和APC接触以及细胞因子的作用下均可诱导T细胞产生不对称分裂。通过不对称分裂子细胞可以获得不同的命运决定因子从而分化为不同类型的细胞。TN细胞在接触抗原呈递细胞(antigen-presenting cells,APC)后产生第一代子细胞:靠近APC的子代细胞分化为TE;远离APC的分化为TM[68]。这种分化与c-Myc的不对称分裂有关。进一步研究表明:Notch、WNT、mTOC、表观修饰、细胞因子等信号通路均与细胞的不对称分裂有关[69-72]。另外,T细胞通过不对称分裂子代细胞可以获 得 不 同 的 代 谢方式[69,73-74]。低 表 达mTOC1的子代细胞脂肪代谢能力提高并且能够在小鼠体内长期生存[69]。CD4+细胞在刺激后分裂产生的子代细胞一部分保留了TCF1具有更强的自我更新能力,而另一部分子代细胞由于mTOC1抑制TCF1向终末分化的TE细胞分化[75]。TCR信号的强弱参与T细胞的极化从而引发不对称分裂[76]。在IL-5及IL-17存在的条件下高强度的antiCD3刺激促进TN细 胞向TE细胞分化[64],而 低 强 度 刺 激 可 以 促 进TSCM细 胞 产 生[77-80]。携 带 抗 原 肽-MHC复 合 物 的APC细胞对T细胞的极化是多方面的,具体在什么条件下,哪一方面对于所接触的幼稚T细胞的分化方向起到决定性的作用还需要进一步研究。另外血管内皮细胞、肿瘤细胞等其他类型的细胞对于T细胞极化、不对称分裂、命运转化的影响也有待探索[81]。
结语基因组学、蛋白组学、表观修饰组学、单细胞测序、基因编辑技术不断发展,通过整合各种信息的综合分析,新的TSCM命运决定因子会不断被发现[82]。目前,对于TSCM的转化研究多为体外研究,值得注意的是诱导产生的iTSCM与自然状态的TSCM不 同:TWS119及NOTCH诱 导 的TSCM更 多 地表达IFN-γ、IFN-α、mTORC1信号基因,更少表达NF-κB导 致 的TNFα信 号、缺 氧 信 号、TGF-β信号[54]。对于TSCM在体内如何产生,其长期生存的位置是位于骨髓、淋巴结还是其他部位需要进一步的研究。综合目前的研究结果,多数证据支持幼稚T细胞在接触APC细胞活化时在特定的细胞因子组合情况下通过不对称分裂产生保持一定幼稚T细胞特性的活化的TSCM(图1)。

图1 体内产生的TSCM关键因素Fig 1 Key factors that determine differentiation and generation of Stem cell-like memory T cells in vivo
未来我们在运用各种组学技术发现TSCM产生的关键因子基础上,通过纳米材料技术等人工合成促进TSCM的微环境、基因编辑技术、小分子药物、相关细胞因子调控细胞分化命运,能够创造出更加适应肿瘤微环境、安全、长效的TSCM应用于实体肿瘤的治疗[83-84]。
作者贡献声明杨敏捷论文撰写和修订,制图。王小林论文构思和审校。
利益冲突声明所有作者均声明不存在利益冲突。
