子宫内膜癌及非典型增生患者血清载脂蛋白AI水平及其模拟肽L4F对子宫内膜癌细胞增殖的抑制作用
2022-02-24徐郁慧陈晓军
徐郁慧 陈晓军△
(1复旦大学附属妇产科医院妇科 上海 200011;2上海市女性生殖内分泌相关疾病重点实验室 上海 200011)
子宫内膜癌(endometrial cancer,EC)是最常见的妇科恶性肿瘤之一[1],其发病率的逐年增加与肥胖相关,这一相关性在发达国家尤其明显[2]。约7%的EC患者年龄在45岁以下并且渴望保留生育能力[3]。目前,EC的保守治疗策略仅限于大剂量的激素治疗。然而,近年的系统荟萃分析表明,仍有25%~30%的内膜病变患者对激素治疗无反应[4-6]。因此,寻找新的抗肿瘤药物对于期望保留生育能力的EC患者尤为重要。
载 脂 蛋 白AI(apolipoprotein AI,apo AI)作 为血浆中高密度脂蛋白(high-density lipoprotein,HDL)颗粒的主要成分,其主要功能为促进胆固醇运输和脂质代谢。研究发现apo AI可作为肥胖相关恶性肿瘤的诊断标记物[7],如血清apo AI低水平预示结肠癌的发生[8],血清apo AI低水平被认为是恶性肿瘤进展和不良预后的预测因子[9-10]。文献报道血清apo AI联合转铁蛋白(transferrin,TF)及前白蛋白(transthyretin,TTR)的检测集合可作为EC诊断的新工具[11]。但是,国内外尚无有关血清apo AI与EC及癌前病变之间关系的研究。apo AI模拟肽L4F是一组长度为18个氨基酸的肽,能形成可结合脂质的经典两亲螺旋的结构,类似于全长apo AI的功能。apo AI模拟肽被证明具有相似的抗肿瘤特性:在卵巢癌中,L4F、D4F和L5F均可抑制ID8癌细胞增殖并抑制异种移植瘤生长[12-14]。然而,目前尚无研究证明apo AI或其模拟肽是否影响EC的发展。
本研究通过回顾临床血脂数据,首次评估apo AI模 拟 肽L4F对EC细胞系的影响,并 利 用EC类器官模型模拟机体对L4F的反应,初步验证了apo AI及模拟肽L4F对EC发展的影响。
资料和方法
细胞和临床样本人EC细胞系HEC-1A和ECC-1获自美国典型培养物保藏中心(ATCC)。细胞系经过短串联重复序列(short tandem repeat,STR)鉴定,每半年重复鉴定STR。
临床人体组织样本采集由复旦大学妇产科医院伦理委员会批准(批准号:kyy2019-104)。3例新鲜EC组织样本取自2019年5月—2020年5月在复旦大学附属妇产科医院就诊并行子宫切除术的患者,患者均签署知情同意书。3例患者在6个月内均无雌孕激素用药史,病理诊断由2名病理医师共同认定。
回顾性病例纳入2020年1月—2021年1月在我院杨浦院区首次就诊并经病理诊断证实为子宫内膜非典型增生(atypical endometrial hyperplasia,AEH)的患者48例和EC患者45例;41例无子宫内膜病变者作为对照。排除严重内科疾病或其他系统恶性肿瘤者。经过患者及家属知情同意后,在住院病历系统中查询并收集纳入对象的一般资料、病理诊断及术前血脂评估。一般资料包括年龄、身高、体重、是否绝经、病史(有无高血压、糖尿病、心脏病及用药史),血脂评估包括apo AI、apo B、总胆固醇(total cholesterol,TCH)、甘油三脂(triglyceride,TG)、高 密 度 脂 蛋 白(high-density lipoprotein,HDL)和 低 密 度 脂 蛋 白(low-density lipoprotein,LDL)。
主要试剂和抗体apo AI模拟肽L4F购自中国强耀生物有限公司,多肽序列为Ac-DWFKAFYDKVAEKFKEAF-NH2(N→C),纯 度高于98%。Ki67抗体购自美国Cell Signaling Technology(CST)公司。AMPK、p-AMPK、Nanog、β-action抗体购自美国Abcam公司。
细胞培养和处理ECC-1细胞培养于R/MINI 1640(HyClone,美 国),HEC-1A细 胞 培 养 于DMEM/F12(HyClone,美国),两种培养基均含有10%胎牛血清(Gibco,美国)。细胞置于37℃、5%CO2培养箱中培养。
EC类器官分离及培养将新鲜肿瘤组织切成1~2 mm的碎片,在1.25 mg/mL胶原酶Ⅱ和1 mg/mL分散酶Ⅱ组成的消化液中消化40~50 min。肿瘤组织碎片被消化成上皮细胞簇,用冰PBS洗涤,300×g离心1 min。去除上清液,沉淀物被重新悬浮在预冷的基质胶中,混悬液接种于24孔板中,置于37℃培养箱中培养15 min,直到基质胶变成凝胶状,而后以每 孔500 μL加 入EC类 器 官 培 养 基[Advanced DMEM/F12+50 ng/mL表皮生长因子+250 ng/mL R-spondin1(Wnt信 号 通 路 激 动 剂)+100 ng/mL Noggin(一种类胰岛素生长因子)+10 μmol/L Y27632(ROCK信号通路抑制剂)+L-glutamax(L-丙氨酰-L-谷氨酰胺)]。
细胞增殖能力检测消化对数生长期的人EC细胞,以3 000个/孔的密度均匀接种于96孔板中,每孔含100 μL完全培养基。细胞贴壁培养24 h,PBS洗涤2次,予以不同浓度的L4F(0、5、20、40 μg/mL)处理24 h。Cell Counting Kit-8(CCK8)检测试剂盒(日本Dojindo公司)用于检测细胞增殖,每孔加入10 μL CCK8试剂,在37℃下孵育1 h。用酶标仪测定450 nm处吸光度值。
免疫荧光检测EC类器官用20 ng/mL的L4F处理7天后,用4%多聚甲醛固定1 h,0.25% Triton 100渗透30 min,用5% BSA封闭1 h。类器官与一抗Ki67(1∶200)在4℃下孵育过夜。预冷PBS洗涤类器官沉淀2次,与二抗室温孵育30 min。预冷PBS洗涤类器官沉淀2次,将类器官重悬于含DAPI(4′,6-二脒基-2-苯基吲哚)的抗荧光淬灭剂中,并固定于载玻片上。共聚焦显微镜(赛默飞,中国上海)拍摄图像(20倍放大率)。
免疫印迹实验收集不同浓度L4F(0、5、20、40 μg/mL)处理48 h后的人EC细胞沉淀,PBS洗涤2次,予以RIPA(强)裂解液(Santa Cruz,美国)冰上裂解细胞沉淀10 min。所得细胞悬液予以12 000×g离心10 min后,收集上清液,并和5×SDS上样缓冲液按比例混合后,放入100℃金属浴处理15 min。电泳:80 V恒压30 min,120 V恒压1 h;转膜:300 mA恒流3 h。蛋白转移至PVDF膜上,5% BSA室温封闭1 h后,予以一抗4℃孵育过夜,二抗室温孵育1 h,ECL(Epizyme,中国上海)化学发光方法对抗原蛋白进行可视化和定量。
统计学分析采用双尾t检验分析数据,对照组标准化为1,利用Graphpad软件呈现数据图(柱状图)。所有数据的处理都遵循SEM分析法(用x±s表示),每个实验独立重复3次。多组间计量资料的比较使用Kruskal-Wallis H检验,多组间计数资料间的比较采用Pearson’sχ2检验。P<0.05为差异有统计学意义。
结 果
不同子宫内膜病变阶段与正常对照血脂水平的比较134例观察对象的临床参数资料比较见表1,包括48例子宫内膜AEH、45例EC及41例正常对 照。45例EC患 者 中 有12例 为G3期,33例 为G1~G2期。观察对象的年龄、月经状态、体重指数、是否存在高血压以及高脂血症在3组之间差异无统计学意义(表1)。对3组观察对象血清中的血脂水平进行统计分析,发现apo B、TCH、TG、HDL、LDL与正常对照组的差异无统计学意义,而血清apo AI水平在子宫内膜AEH组和EC组均低于对照组(P<0.001,表2)。其中,正常对照组为(1.129±0.257)g/L,高 于AEH组 的(0.970±0.201)g/L和EC组的(0.913±0.163)g/L,提示apo AI可能参与EC的发生发展。EC组血清apo AI平均值低于子宫内膜AEH组,但差异无统计学意义(P=0.671)。
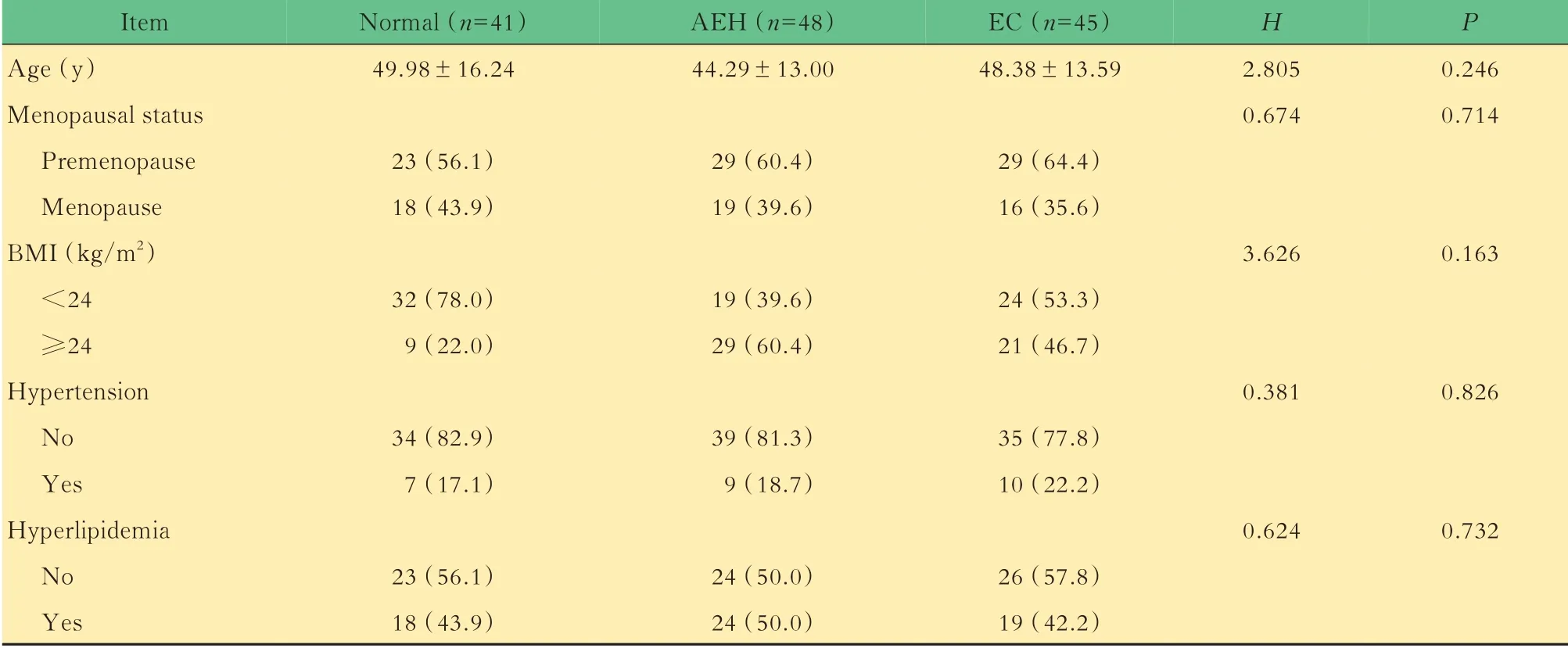
表1 正常对照组、子宫内膜非典型增生组及内膜癌组患者临床参数资料的比较Tab 1 Univariate analyses of clinical parameters in patients of normal,AEH or EC group [n(%)]
表2 子宫内膜非典型增生组及内膜癌组与正常对照组血脂水平的比较Tab 2 Comparison of lipid metabolism levels in normal,AEH and EC group ()

表2 子宫内膜非典型增生组及内膜癌组与正常对照组血脂水平的比较Tab 2 Comparison of lipid metabolism levels in normal,AEH and EC group ()
AEH:Atypical endometrial hyperplasia group;EC:Endometrial cancer group;TCH:Total cholesterol;TG:Triglyceride;HDL:High-density lipoprotein;LDL:Low-density lipoprotein.
Lipid Metabolism apo AI(g/L)apo B(g/L)TCH(mmol/L)TG(mmol/L)HDL(mmol/L)LDL(mmol/L)Normal(n=41)1.129±0.257 0.859±0.203 4.698±0.970 1.366±0.668 1.130±0.239 3.179±0.696 AEH(n=48)0.970±0.201 0.887±0.211 4.636±0.734 1.559±1.224 1.096±0.261 2.895±0.658 EC(n=45)0.913±0.163 0.934±0.183 4.954±0.739 1.435±0.658 1.134±0.227 2.976±0.551 H P<0.001 0.072 0.057 0.743 0.433 0.158 20.520 5.263 5.728 0.593 1.671 3.688
apo AI模拟肽L4F抑制EC细胞系增殖利用不同浓度的apo AI模拟肽L4F(0、5、20、40 μg/mL)处理内膜癌细胞系HEC-1A和ECC-1。L4F处理癌细胞48 h后,通过CCK8细胞活力检测试剂盒检测EC细胞增殖活力。L4F可以抑制HEC-1A和ECC-1的增殖,且随着L4F浓度升高,其对HEC-1A和ECC-1细胞增殖的抑制效果增加(图1)。综上所述,L4F以剂量依赖的方式抑制EC细胞系的增殖。
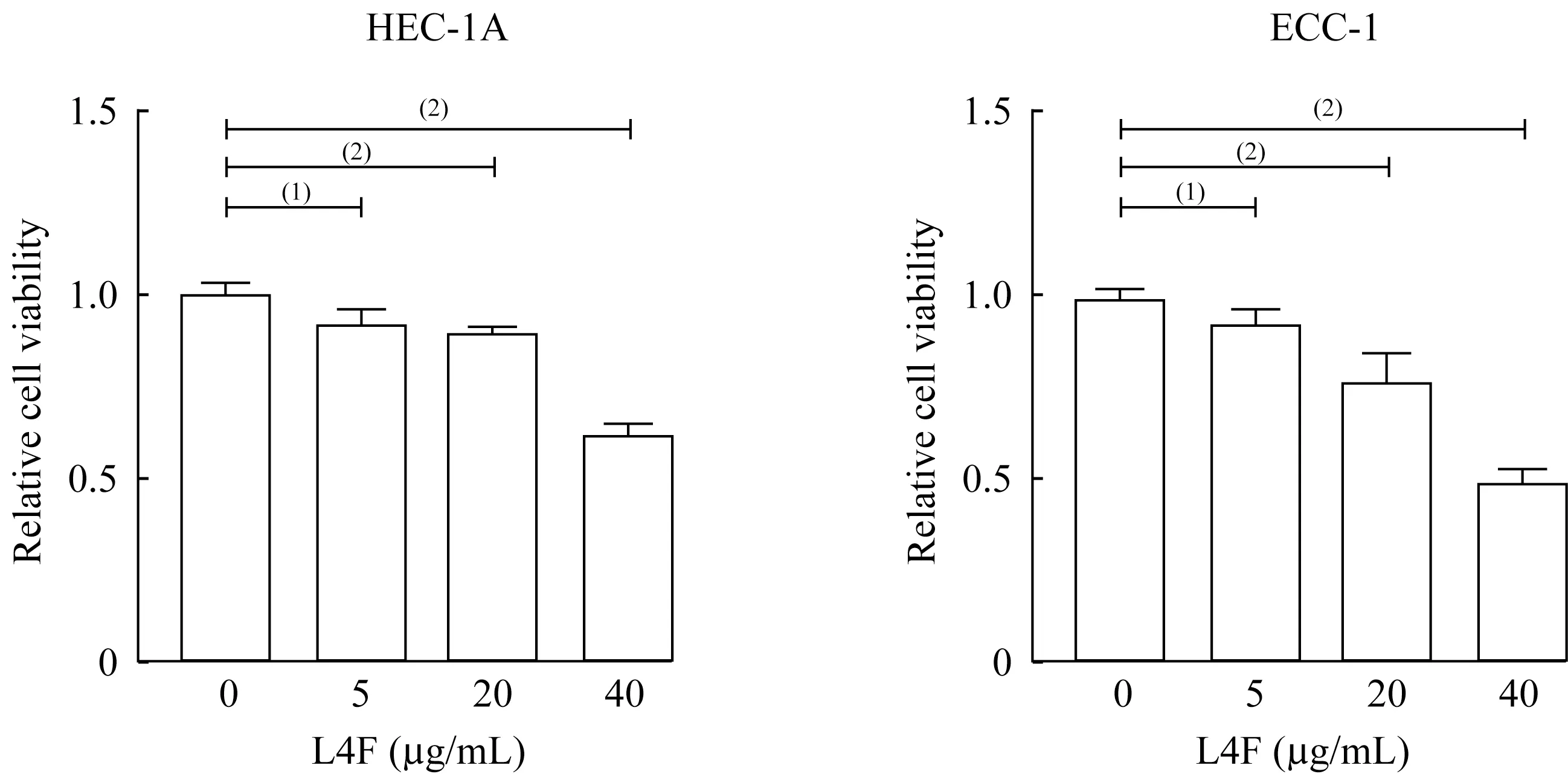
图1 apo AI模拟肽L4F抑制EC细胞系增殖Fig 1 Apo AI mimetic L4F reduced the cell viability in EC cell lines
apo AI模拟肽L4F抑制EC类器官增殖由临床肿瘤样本构建的肿瘤类器官模型是目前最有效的 药 物 筛 选 工 具。根 据Turco等[15]2017年 发 表 的EC类器官培养方案,我们培养了3例EC类器官,标记编号为No.1,No.2,No.3(图2、3)。3例取样的患者均为绝经前妇女,病理证实为EC,均行全子宫及双侧附件切除术。我们利用20 μg/mL L4F处理EC类器官7天,以研究L4F是否可作为潜在的抗肿瘤制剂。类器官的明场显微镜图像显示:与对照组相比,L4F处理组的EC类器官球体大小及数量显著低于对照组(图2A)。统计类器官数量后发现,L4F处理的EC类器官数量显著低于对照组(图2B)。对类器官进行免疫荧光染色以评估增殖标志物Ki67的表达,结果发现L4F处理后EC类器官的Ki67表达水平相对于对照组显著降低(图3),这表明L4F对所有3例EC类器官均有抑制增殖的作用。
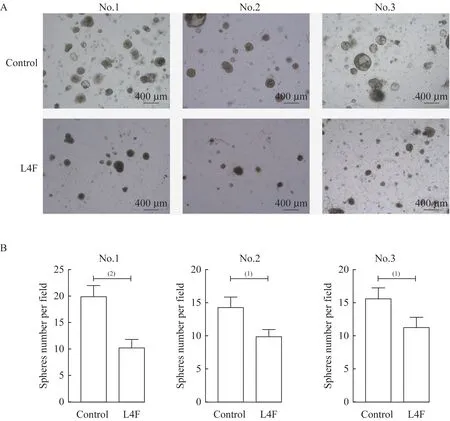
图2 apo AI模拟肽L4F抑制EC类器官生长Fig 2 apo AI mimetic L4F inhibited the growth of endometrial cancer derived-organoids

图3 apo AI模拟肽L4F抑制EC类器官增殖活力Fig 3 apo AI mimetic L4F inhibited the proliferation of endometrial cancer derived-organoids
apo AI模拟肽L4F激活EC细胞AMPK信号通路的磷酸化不同浓度的L4F分别处理HEC-1A和ECC-1细胞系24 h后,收集癌细胞的蛋白裂解液。蛋白质印迹实验显示:与对照组相比,L4F显著增加了HEC-1A和ECC-1细胞的AMPK磷酸化蛋白(phospho-AMPK、p-AMPK)水平。随着L4F处理剂量的增加,癌细胞的AMPK磷酸化水平不断增加(图4),提示L4F可能通过促进AMPK的磷酸化来抑制肿瘤细胞增殖。
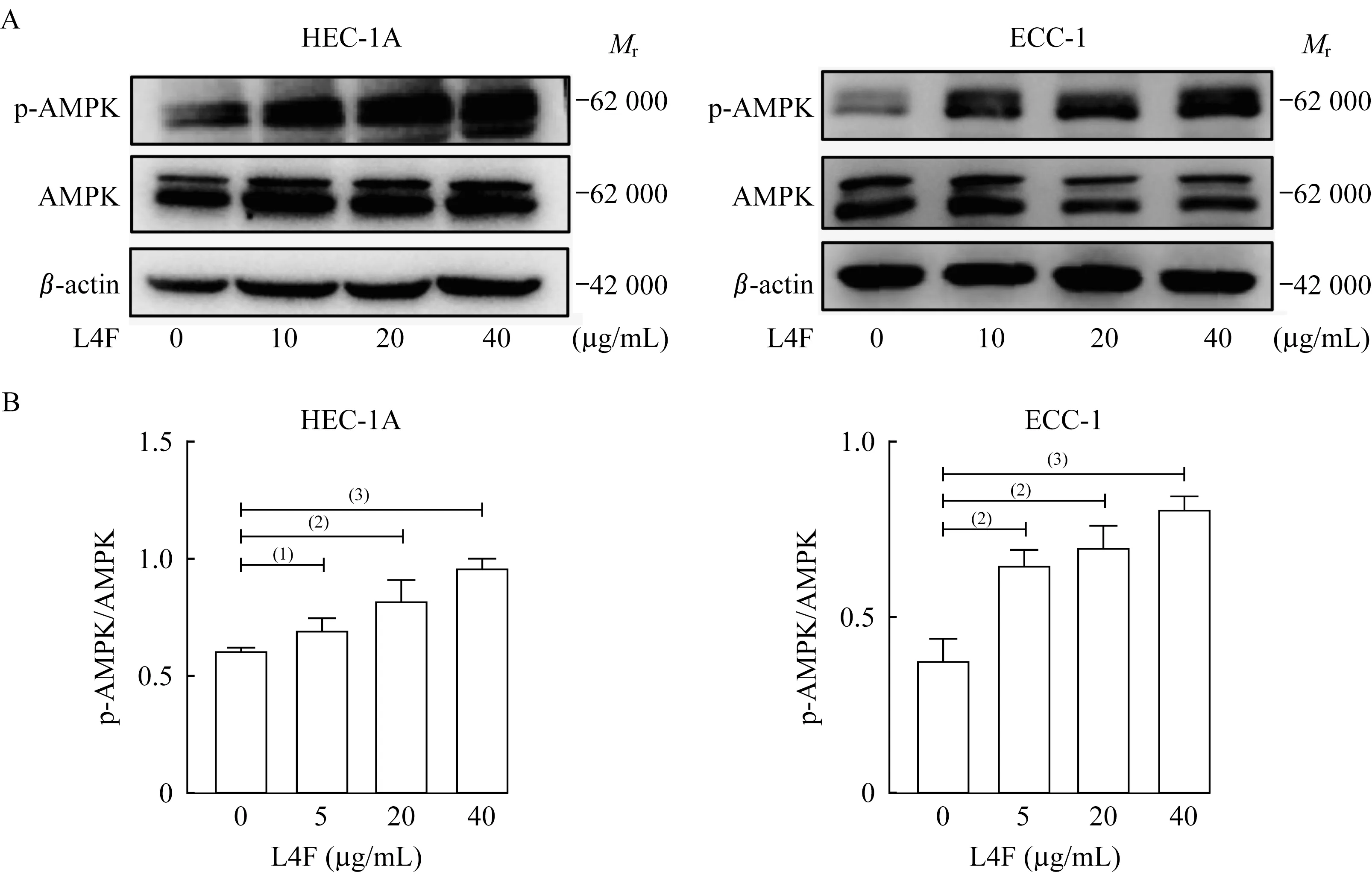
图4 apo AI模拟肽L4F诱导EC细胞AMPK信号通路磷酸化Fig 4 apo AI mimetic L4F stimulated the phosphorylation of AMPK in endometrial cancer cells
apo AI模拟肽L4F抑制EC细胞干性标记物Nanog的表达Nanog是维持EC干细胞的重要转录因子,被作为肿瘤治疗的新靶点[16]。已有文献报道Nanog的胞内降解受到AMPK磷酸化通路的调控[17]。20 μg/mL L4F处 理HEC-1A和ECC-1细 胞24 h后,收集细胞蛋白裂解液。免疫印迹实验表明L4F处理组Nanog蛋白表达水平低于空白对照组(图5),提示L4F可能通过AMPK信号通路调控抑制EC干性。
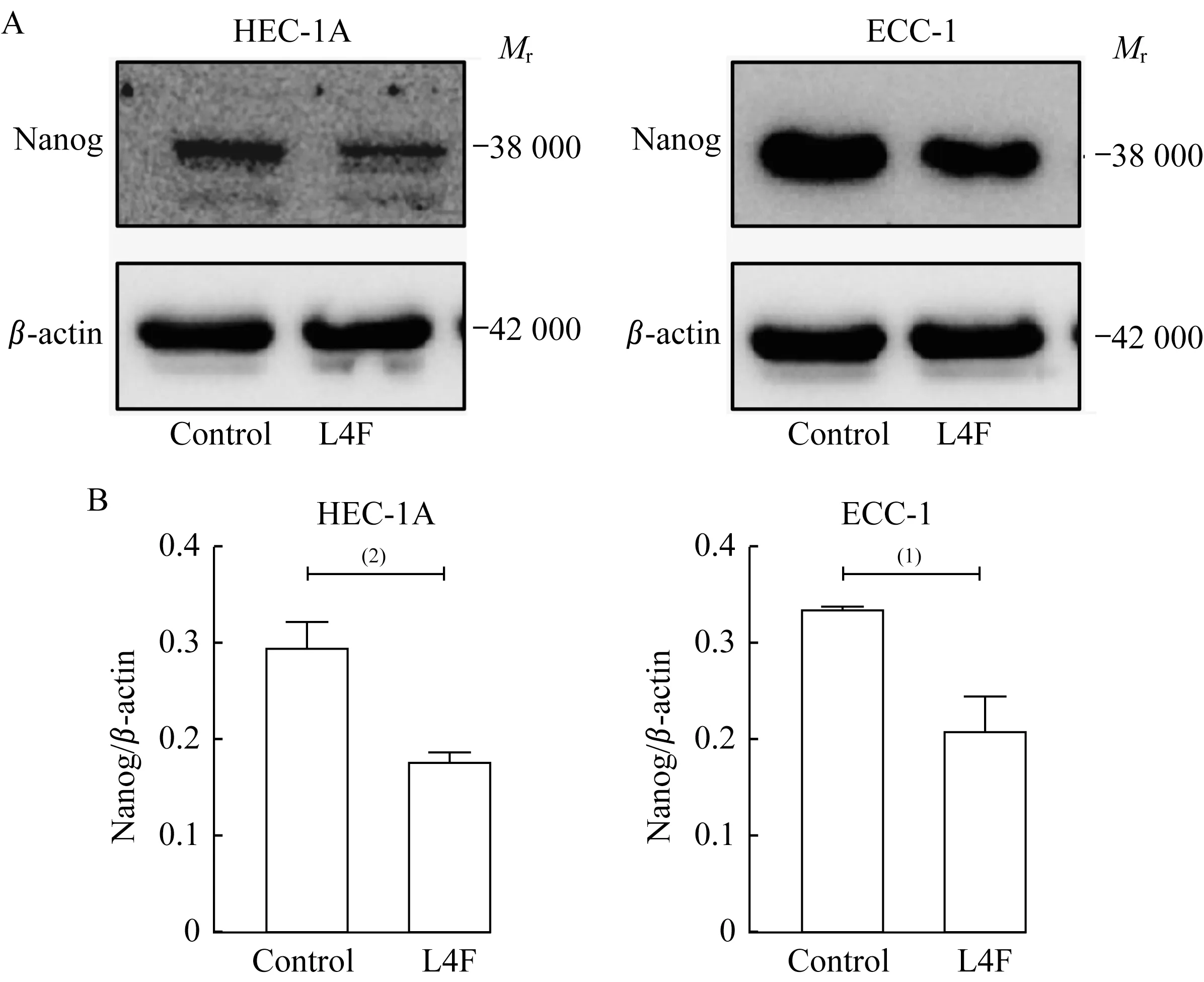
图5 apo AI模拟肽L4F抑制EC细胞Nanog蛋白水平Fig 5 apo AI mimetic L4F inhibited the protein level of Nanog in endometrial cancer cells
为验证EC类器官中,apo AI模拟肽L4F是否促进其AMPK信号通路磷酸化并抑制Nanog的表达,我们利用EC类器官模型验证L4F对EC细胞AMPK信号通路及干性相关基因的影响。20 μg/mL L4F处理EC类器官7天后,收集类器官的蛋白裂解液。蛋白质印迹实验显示:L4F处理组磷酸化AMPK蛋白高于空白对照组,而Nanog蛋白表达水平低于空白对照组(图6)。表明L4F激活AMPK信号通路磷酸化并抑制Nanog表达在EC类器官中得到验证。
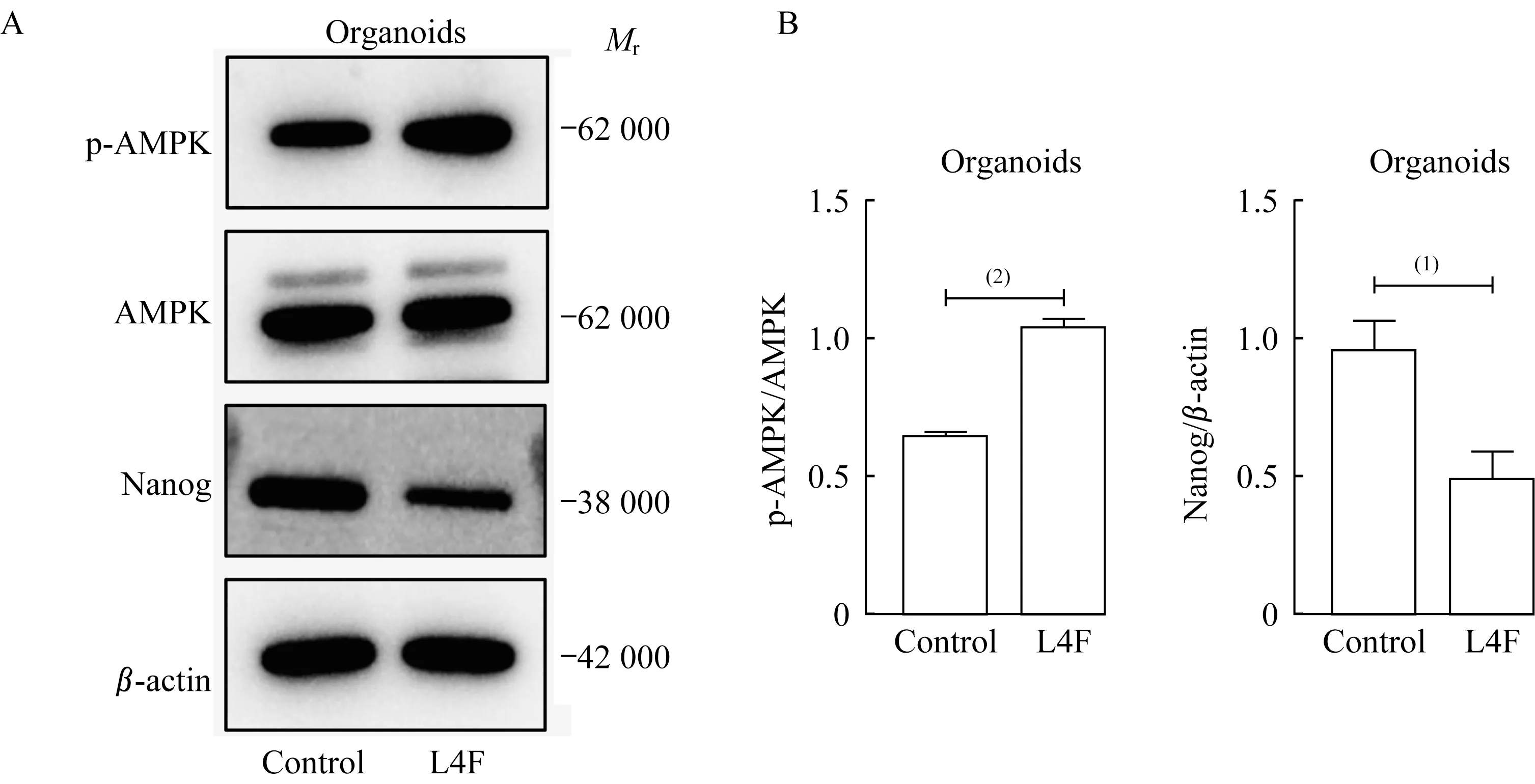
图6 apo AI模拟肽L4F诱导EC类器官AMPK信号通路磷酸化并下调Nanog蛋白水平Fig 6 apo AI mimetic L4F stimulated the phosphorylation of AMPK and inhibited the protein level of Nanog in endometrial cancer derived-organoids
讨 论
近年的研究表明,血清apo AI低水平可能有助于肿瘤发生,并且与许多癌症的转移程度和预后不良有关,如结直肠癌[10]、卵巢癌[18]、肺癌[19]、肝癌[20]等。有文献表明血清apo AI是一种很有前景的预后指标,可用于补充食管癌的TNM分期[21]。此外,血清apo AI低水平与结直肠癌患者的全身炎症反应和低存活率相关[22]。本研究通过回顾子宫内膜AEH及EC患者的血清血脂水平,以正常人群作为对照,发现AEH及EC患者血清apo AI水平较低,血清apo AI低水平在EC的进展中可能起重要作用,同时我们推测补充apo AI或其模拟肽可能影响EC的发展进程。
在卵巢癌、结肠癌及胰腺癌的研究中,apo AI及其模拟肽可通过抑制肿瘤细胞增殖活力及迁移来抑制 肿瘤发 展[12,23-24]。apo AI模拟 肽比全 长apo AI能更有效地抑制肿瘤增殖。在乳腺癌小鼠模型中,apo AI和apo AI模拟肽D4F都降低了血清氧化低密度脂蛋白(oxLDL)水平,但只有D4F抑制了oxLDL介导的肿瘤生长[25]。本研究中,L4F以剂量依赖性的方式抑制两株EC细胞系的增殖,与上述文献结果一致。这种剂量依赖的作用提示:未来L4F作为临床药物时需选择合理的用药浓度,以达到安全及有效的治疗结果。
肿瘤类器官由源自患者的原代肿瘤组织培养获得,保留了肿瘤组织的特性,如细胞与细胞的接触、细胞极性等[26]。因此肿瘤类器官系统比动物模型能更好地模拟人体对药物和毒素的反应,从而被用于抗癌药物研发和个性化治疗[27]。尽管apo AI模拟肽的抗肿瘤特性在体内和体外均已确定,但其在癌症治疗中的应用尚无临床前试验。我们成功分离培养了3例EC患者的类器官,以此模拟机体对L4F的反应性。结果发现,L4F可抑制EC类器官的生长以及增殖活力,同时不同肿瘤样本提取的类器官对L4F的反应性存在一定差异。提示L4F或可用于临床治疗EC并具有一定的抑制效果,但这种效果存在异质性。
apo AI模拟肽可以通过激活AMPK磷酸化来改善葡萄糖代谢[28],而AMPK信号通路磷酸化被认为是二甲双胍抑制肿瘤细胞增殖的重要机制[29]。Wang等[17]发现,AMPK信号通路的磷酸化通过促进Nanog的泛素化降解而下调前列腺癌干性,最终抑制肿瘤发展。Nanog被广泛证实是维持EC干细胞的重要转录因子[16]。因此,我们推测L4F对EC细胞系增殖的抑制可能是通过激活AMPK信号通路,从而促进Nanog降解,影响EC细胞干性。我们的结果证实L4F可以诱导EC细胞AMPK信号通路的磷酸化,同时抑制癌细胞Nanog蛋白的表达水平。Nanog蛋白降解是否与AMPK激活而促进其蛋白的泛素化有关,有待进一步研究。
本研究存在以下局限性:(1)属于单中心的回顾性研究,研究时间有限,样本量不大,可能存在选择偏倚。(2)未涉及L4F在体内的效果验证,L4F对EC的抗肿瘤作用及机制有待深入研究。(3)虽然L4F对EC的抗肿瘤作用已得到初步证实,但其临床应用及可行性还需进行安全性和效力评估。
综上所述,本研究证实血清apo AI低水平为子宫内膜AHE及EC患者的血脂特点,L4F可能具有作为诊断EC的生物标志物的潜力。同时证实了apo AI模拟肽L4F抑制EC进展、激活AMPK信号通路以及抑制肿瘤干细胞标记物Nanog表达的能力。这是首次通过患者来源的类器官提供了令人信服的证据来证实L4F的抗肿瘤功能,为今后进行临床试验或临床应用提供了理论基础。
作者贡献声明徐郁慧数据整理,实验研究,论文撰写。陈晓军实验指导,论文修改。
利益冲突声明所有作者均声明不存在利益冲突。
