海盐气溶胶界面有机膜的红外光谱研究
2022-02-23程淑敏杜林
程淑敏,杜林
(山东大学环境研究院,山东 青岛 266237)
0 引 言
海盐气溶胶(SSA)是全球最大的初级气溶胶颗粒来源之一(约2×1015~100×1015g·yr-1),也是大气中主要的液相气溶胶[1-3]。它们主要是通过风作用在海面上导致的海水气泡破裂过程产生的[4,5]。存在于海洋微表层中的有机物、无机盐和颗粒态生物质等以SSA为载体,在其自海洋向大气传输的过程中进入海洋大气,并在风力的作用下参与生物地球化学循环[5-7]。SSA中的有机物主要由海洋细菌和浮游植物分解产生[8-10]。这些有机物主要包括小分子的脂肪酸及其衍生物、脂肪醇、磷脂、氨基酸、糖类和甾醇类物质以及大分子的蛋白质和腐殖质类物质等[11-13]。另外,有机物的非生物来源比如污染物的河流输送和光化学前体物的转化也增加了SSA的组分多样性[7,14,15]。此外,通过有机物的静电和络合等相互作用,SSA中的金属离子含量一般也比较高[3,16]。
14~18个碳的长链脂肪酸是在SSA颗粒表面发现的最重要的有机化合物[17-20],其中以硬脂酸(SA)和棕榈酸为主。这些有机物通常不是单独存在,而是与其他物质形成混合有机膜,因此,研究复合膜的界面性质具有重要的实际意义。此外,长链不饱和脂肪酸也是大气气溶胶的重要组成成分[21-23]。油酸(OA)和反油酸(EA)是海水中含量最丰富的不饱和脂肪酸[22,24],它们普遍存在于SSA的界面有机膜上。SA、OA和EA都是18个碳的长链脂肪酸,其中OA和EA分子中有一个不饱和双键存在,并且互为构型异构体。通过这三种物质,可以探究有机膜中分子的不饱和度和双键构型对其界面特性的影响。
Langmuir单分子膜是由长链表面活性有机物在水-气界面上自发扩散形成的单层分子薄膜,它是实验室模拟SSA表面的理想模型。采用Langmuir槽可测定水-气界面的表面压π随单分子膜分子面积A变化的曲线,进而提供关于海水亚相、单分子膜组成、表面压以及分子间相互作用等因素对有机膜界面特性影响的宏观信息。而将红外反射吸收光谱(IRRAS)与Langmuir槽进行有机结合,可从分子层面上获取单分子膜体系的红外谱图。了解单分子膜的界面特性将有助于预测表面活性物质在真实SSA中的大气寿命和行为。此外,气溶胶的界面特性会同时受到其液相核心和有机膜本身化学成分的影响。本文以SSA界面上含量丰富的低挥发性长链脂肪酸作为模型分子,并分别采用纯水和人工海水作为亚相,基于气-液界面的单分子膜建立了一系列SSA模型。
1 实验方案与装置
1.1 表面压-面积(π-A)曲线的测定
Langmuir单分子膜的制作与表征在Langmuir槽装置中进行(图1)。该装置主要由样品池(65 mm×280 mm×3 mm)、参比池、可移动的挡板和压力传感器组成。在Langmuir单分子膜的制作中,首先需要用水溶液填充样品池。为了使有机物在液面上更好地分散开,需将脂肪酸溶解于挥发性溶剂(如氯仿)中,然后用玻璃微量注射器取一定量有机物的单一或混合溶液逐滴滴加到液面上。在实验中,分别以纯水和人工海水(ASW)作为亚相。电阻率为18.2 MΩ·cm的纯水通过超纯水机(Milli-Q)制得。人工海水的组成如表1所示,它是以氯化钠为主的十组分混合盐溶液,总浓度为0.53 mol·L-1。滴加完之后等待10~15 min,以便于溶剂的挥发和有机物在界面的扩散。最后设置挡板移动速度,使两个挡板以3 mm·min-1匀速挤压液面上无序分散的有机物,使其逐渐形成有序排布的单分子膜。在这个过程中,用压力传感器结合Wilhelmy吊片法监测表面压的变化 (±0.1 mN·m-1)。
图1 Langmuir槽和单分子膜示意图Fig.1 Schematic diagram of Langmuir trough and monolayer

表1 人工海水的组成Table 1 Composition of the artificial seawater
1.2 IRRAS的测定
IRRAS技术是基于小部分(6%)的红外光可被表面的分子成分所反射的原理来对液相界面上的单分子膜进行检测[25]。在测定时,需将单分子膜挤压到表面压为20~30 mN·m-1,保证分子可以立在水面上。如图2所示,红外光从光源发出后经过光路系统照射到Langmuir槽的液面上,之后带着液面上分子信息的红外光以相同的角度被反射到检测器。为了获得最大的信号强度,将红外光的入射角设置为40°,然后延迟60 s让单分子膜稳定下来,接着用MCT检测器采集400~4000 cm-1范围内的红外光谱,并以8 cm-1的分辨率进行2000次扫描。此外,IRRAS附件中的光路可在样品池和参比池之间切换,从而可去除亚相对红外光谱的影响。

图2 IRRAS和Langmuir槽联用示意图Fig.2 Schematic diagram showing the combination of IRRAS and Langmuir trough
2 结果与讨论
2.1 脂肪酸复合膜体系的界面相变化
在水-气界面上,表面压-面积(π-A)曲线的形成与表面活性分子的取向变化有关[26,27]。SA单分子膜在纯水界面上的π-A曲线如图3所示[28]。随着对单分子膜的压缩,SA分子的堆积密度和排列有序性呈现出与三维气、液、固相类似的二维相变化[28]。可以明显地看到三个阶段:在分子面积较大的气态膜中,SA分子在气-液界面上呈分散状态铺展开来,分子之间几乎不发生相互作用,这时表面压几乎为零[29];经过持续压缩至约0.21 nm2·molecule-1的提离面积之后,表面压开始上升,单分子膜转变为液态膜,此时分子之间排列相对紧密且相对于液面呈现出一定的取向;持续压缩至表面压约为22 mN·m-1之后[30-31],单分子膜的可压缩性降低,从曲线上可以看到表面压的迅速上升,说明固态膜的形成并且可在π-A曲线上观察到明显的扭结点。这时表面活性分子在界面上紧密排列,并且烷基链几乎垂直于表面[32]。继续压缩单分子膜,分子间距会达到一个临界值,对应的表面压叫做崩溃压,此时单分子膜受力会发生崩溃从而转变为多层分子堆叠的三维结构[33-35]。

图3 SA单分子膜在纯水界面上的π-A曲线Fig.3 The π-A isotherm of SA on pure water subphase
图4展示了SA、OA和EA的单组分以及复合组分有机膜在纯水和人工海水界面上的π-A曲线。图5给出了SA、OA和EA三种有机物的结构式。由图4可知,与SA膜在低分子面积下形成固态膜不同,OA和EA膜经过持续压缩最终都只能形成液态膜[36]。此外,相对于SA膜,OA和EA膜的提离面积明显增大至0.5~0.8 nm2·molecule-1,说明不饱和脂肪酸分子在界面上排列的有序性显著降低。在OA和EA膜之间也存在区别,OA膜的分子面积略大于EA,这就反映出了分子构型对单分子膜的影响,OA分子烷基链上的cis型双键使得其分子间距离增大,进而导致了其单分子膜的扩张[37]。另外,可以看到在亚相中加入海盐之后,π-A曲线的提离面积都是增大的,这说明了海盐对脂肪酸单分子膜的扩张效应。

图4 SA-OA和SA-EA复合膜在纯水(a)、(b)和人工海水(c)、(d)界面上的π-A曲线Fig.4 The π-A isotherms of mixed SA-OA and SA-EA monolayers on pure water(a),(b)and artificial seawater(c),(d)subphases
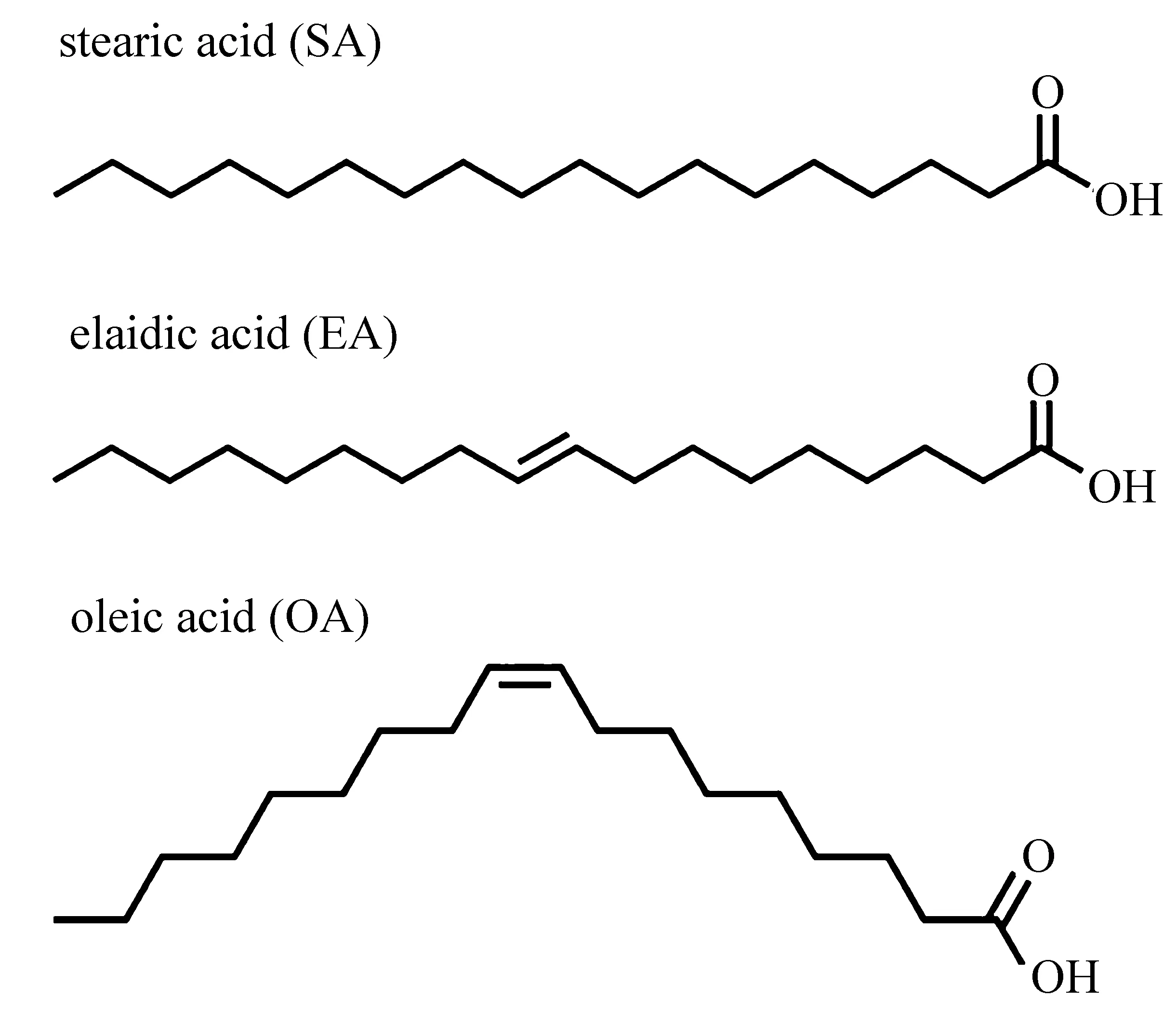
图5 SA、EA和OA的结构式Fig.5 Structural formula of SA,EA and OA
将饱和与不饱和脂肪酸分子混合之后,在纯水界面上[图4(a)、(b)],SA-OA和SA-EA复合膜的π-A曲线都是随着OA或EA摩尔分数的增加向面积增大的方向移动。随着不饱和脂肪酸的引入,SA-OA和SA-EA复合膜曲线的变化程度不同。对于SA-OA复合膜,当XOA=0.05时,复合膜的π-A曲线虽然保留着从液态膜到固态膜的扭结点,但与纯SA膜的π-A曲线发生了明显分离,说明在SA膜中引入少量的OA就会对界面SA分子的排列产生影响,这意味着OA分子打破了原来的稳定性[38]。当XOA=0.2时,π-A曲线的扭结点消失,并且变化趋势开始接近于纯OA单分子膜。而对于SA-EA复合膜来说,扭结点在较高EA比例(XEA=0.3)时开始变得不明显。当XEA=0.5时,π-A曲线的走向开始接近于纯EA膜。这说明与OA分子相比,EA分子对SA膜相态变化和稳定性的影响程度较小。
从图4(c)、(d)中可以看到,SA-OA和SA-EA复合膜的π-A曲线对亚相中海盐的引入比较敏感。首先,曲线的提离面积均向较大分子面积移动,说明分子排列的有序性降低。其次,分子排列较为疏松的SA-OA复合膜的扩张程度高于SA-EA,说明海盐的存在导致前者有序性降低程度更大。此外,当海盐存在时,SA-OA复合膜的π-A曲线均有或大或小的转折点存在。可以看到,在XOA=0.05时,仅在高表面压下有轻微的转折点出现;随着OA摩尔分数的增大,尤其是在XOA=0.3和XOA=0.5时,曲线上开始在表面压为15 mN·m-1左右出现过渡状态,随后曲线在较低分子面积下继续上升。增大OA的摩尔分数至XOA=0.7时,转折点开始变弱,复合膜π-A曲线的形态和纯OA膜相近。对于SA-EA复合膜,这一现象在EA摩尔分数较高如XEA=0.5、0.7和0.9时更加明显。这说明SA分子与两种不饱和脂肪酸之间可能存在不同的相互作用方式。
研究表明,在亚相中引入无机离子会使界面上脂质单分子膜的分子面积增大或减小,进而影响其分子取向、排列和表面形态[16,39]。为了探究五种主要的海水成分对于脂肪酸复合膜的影响,选取XOA=0.5和XEA=0.5复合膜,分别在NaCl、Na2SO4、KCl、CaCl2和MgCl2的液面上测得它们的π-A曲线如[图6(a)、(b)]所示。这里选取的离子浓度和人工海水中保持一致。

图6 等摩尔比例的SA-OA和SA-EA复合膜在不同亚相上的π-A曲线(a)、(b)及其分子面积相对于纯水上的偏差(c)、(d)Fig.6 The π-A isotherms of the equimolecular mixed SA-OA and SA-EA monolayers on different subphases(a),(b)and the deviations of the molecular area relative to that of pure water(c),(d)
在特定表面压下,复合膜在不同亚相上π-A曲线的分子面积相对于纯水上的偏差用ΔA表示,负的ΔA值反映了离子对单分子膜的凝聚作用,而正的ΔA值则表明离子对单分子膜的扩张作用。观察单一海盐成分的ΔA值[图6(c)、(d)],发现在NaCl、KCl和MgCl2溶液上,复合膜的分子面积相对于纯水上均有所增加,说明这三种溶液对复合膜具有一定的扩张作用。然而,和上述几种海盐不同的是,CaCl2溶液对SA-EA和SA-OA复合膜始终具有收缩的作用,在测量到的所有表面压下,都比在纯水上排列的更加紧密。在CaCl2溶液上,XOA=0.5和XEA=0.5复合膜的分子面积分别比在纯水上减小了0.019~0.075 nm2·molecule-1和0.021~0.031 nm2·molecule-1。此外,从π-A曲线的变化趋势来看,CaCl2在复合膜π-A曲线向低分子面积的转折中起到了主要作用。亚相中的Ca2+使得脂肪酸膜处于压缩状态,表明和纯水上的有机膜相比,在含Ca2+的亚相上形成的有机膜更加稳定。此外,钙离子的凝聚作用还会随着其液相浓度的增加而加强[16]。Schwartz等[40]提出,Ca2+在新生SSA中的高度富集现象可能是由于它与脂肪酸的羧酸根基团通过阳离子桥的作用形成了稳定的双齿复合物。这些结果表明,金属离子与脂质分子间的相互作用具有一定的特异性,并且,带相同电荷的金属离子对有机膜的影响程度也可能不同。
2.2 脂肪酸复合膜体系的热力学稳定性
在获取单组分和复合组分有机膜的π-A曲线之后,对实验测得的复合膜的分子面积以及计算得到的理想状态下的分子面积进行比较,进而分析复合膜中两组分之间的互混度[41]。该参数可以用过剩表面积ΔAex来表示,它是复合单分子膜所占的实际分子面积与两组分不相互作用时所占分子面积的差值[42]。
以SA-OA复合膜为例,ΔAex的计算公式为


二元复合膜的热力学稳定性可以用过剩吉布斯自由能ΔGex来定量分析,ΔGex的值可以通过对过剩表面积曲线从零到特定表面压进行积分得到[45,46],即

由式(2)结合过剩表面积计算公式可以得出,当复合膜中两组分处于理想状态时,ΔGex的值为零。ΔGex的值越低表明单分子膜的热力学稳定性越强,两组分之间的吸引力越强,反之高的ΔGex值则表明复合膜的稳定性较差,两组分之间的排斥力越强[47]。
图7展示了过剩分子面积ΔAex值随复合膜表面压和混合比的变化情况。可以看到,ΔAex值均偏离理想状态(ΔAex≠0),说明SA与两种不饱和脂肪酸均不能形成理想状态的复合膜,而是以不同的互混度在界面发生混合。在这一过程中,两种组分之间的静电力起到了主要作用,包括静电排斥力和静电吸引力[48]。对于纯水界面的SA-OA复合膜[图7(a)],两组分之间的相互作用和表面压相关。ΔAex值基本上随着表面压的增大而降低,说明随着挡板的挤压和分子面积的减小,两组分之间的吸引力在逐渐增强。在特定的表面压下,ΔAex值呈现出随着OA摩尔比例的升高而增大的趋势,最低值出现在25 mN·m-1下的XOA=0.1复合膜(-0.043 nm2·molecule-1),这证实了OA分子的引入对SA单分子膜稳定性的降低作用,与π-A曲线的结果是一致的。当亚相为人工海水时[图7(c)],ΔAex曲线的总体分布依然是随着表面压的升高而降低。不同的是,低值在 30 mN·m-1下较高 OA 含量的 XOA=0.3(-0.118 nm2·molecule-1)和 XOA=0.5(-0.141 nm2·molecule-1)复合膜出现,说明此时复合膜中两组分之间的吸引力较强。而这两种比例下的π-A曲线[图4(c)]也表明,随着表面压的升高,在两组复合膜的曲线中均有明显的转折点存在,经过转折之后,在30 mN·m-1下分别达到了0.081 nm2·molecule-1和0.082 nm2·molecule-1的较低分子面积。复合膜中SA和OA分子在高表面压下强烈的吸引力可以解释这一转折点的出现。当SA-EA复合膜处于纯水界面上时[图7(b)],ΔAex的最小值出现在20 mN·m-1(-0.045 nm2·molecule-1)。除此之外,SA-EA复合膜在其他表面压和摩尔比下的ΔAex绝对数值均小于相应的SA-OA膜。这说明在同样的摩尔比例下,EA与SA分子之间的相互作用力较弱。在人工海水界面上[图7(d)],SA-EA复合膜ΔAex的最小值在XEA=0.7和15 mN·m-1时出现(-0.041 nm2·molecule-1),而最大值在 XEA=0.5 和 20 mN·m-1时出现 (0.057 nm2·molecule-1),说明此时单分子膜的分子相邻链之间相互排斥,使得有机膜的有序性降低。这说明除了复合膜中有机物的种类、分子结构和表面压之外,亚相的成分也会影响复合膜在水-气界面的互混度。

图7 SA-OA和SA-EA复合膜在纯水(a)、(b)和人工海水(c)、(d)界面的过剩分子面积Fig.7 Excess molecular area(ΔAex)of the mixed SA-OA and SA-EA monolayers on pure water(a),(b)and artificial seawater(c),(d)subphases
基于热力学参数ΔGex可以对复合膜的稳定性和作用力的大小进行定量分析。由图8(a)知,SA-OA复合膜在纯水界面上ΔGex的最小值出现在25 mN·m-1下的XOA=0.1复合膜(-56.5 J·mol-1),说明此时SA和OA分子之间的范德华作用力最强。从ΔGex的变化趋势可看出,SA-OA复合膜的稳定性随着OA摩尔比例的增大而减弱。同样,在人工海水界面上[图8(c)],XOA=0.3(-120.5 J·mol-1)和XOA=0.5(-103.8 J·mol-1)复合膜在高表面压下出现低ΔGex值,这是由于分子间强烈的相互作用力引起的。而根据图8(b)、(d)中SA-EA复合膜的ΔGex值分布可以看出,不饱和脂肪酸的构型会对复合膜的稳定性产生影响。在纯水界面上,负的ΔGex值说明SA-EA复合膜在任一表面压的所有比例下形成的复合膜都要比理想状态下更加稳定。然而,当亚相为人工海水时,高ΔGex值的出现说明海盐对界面分子的排布具有扰乱作用。

图8 SA-OA和SA-EA复合膜在纯水(a)、(b)和人工海水(c)、(d)界面的过剩吉布斯自由能Fig.8 Excess Gibbs free energy of mixing of the mixed SA-OA and SA-EA monolayers on pure water(a),(b)and artificial seawater(c),(d)subphases
2.3 脂肪酸复合膜体系的界面分子排布
图9(a)中的2750~3100 cm-1波段反映了烷基链的C-H伸缩振动特征。对于纯SA膜,2917 cm-1和2850 cm-1位置的谱峰分别对应于CH2的不对称和对称伸缩振动[νas(CH2)和νs(CH2)]。在3000~3040 cm-1范围内出现的弱谱峰来自于HC=CH基团中的C-H伸缩振动。这里较低的νas(CH2)和νs(CH2)波数说明烷基链形成了高度有序排列的All-trans构型[49]。随着复合膜中OA摩尔分数的增大,CH2伸缩振动峰强度降低,这是由于空间位阻较大的OA分子的引入降低了界面分子的堆积密度。此外,虽然两个特征峰的波数变化不太明显,但在高OA比例(XOA=0.9)下依然出现了向高波数方向的移动,这种蓝移的现象在人工海水界面上更加明显[图9(c)],说明海盐的存在使得SA-OA复合膜的有序性降低。当复合膜中OA的摩尔分数大于XOA=0.5时,SA-OA复合膜的νas(CH2)振动峰增大至2921、2923、2927 cm-1。这表明OA分子在降低界面分子堆积密度的同时,使得界面的Gauche构型缺陷增多,界面分子排列的有序性降低[16,50,51]。
νas(CH2)和νs(CH2)峰的强度比值(Ias/Is)是衡量脂质膜有序性和无序性的重要参数[52-54]。这个比值越高说明有机膜中的烷基链拥有更多的trans构型。表2展示了人工海水界面上不同混合比例下SA-OA复合膜的Ias/Is值。可以看到,在表面压为22 mN·m-1时,随着OA在复合膜中比例的提升,Ias/Is值从1.41降低至1.02。这表明随着界面上OA分子的增多,复合膜中烷基链排列的有序性在逐渐降低,这一变化趋势和对应混合比下π-A曲线的变化是一致的。此外,在2960 cm-1附近比较弱的峰来自于CH3的不对称伸缩振动[νas(CH3)]。这个峰的存在可以证明烷基链上有Gauche构型缺陷的存在。因此,IRRAS谱图的结果可以表明不饱和脂肪酸的存在能够降低有机分子在界面排列的有序性和紧密程度。
在纯水界面上,随着OA分子比例的增加,在1700~1750 cm-1波段的C=O基团伸缩振动[ν(C=O)]强度显著降低[图9(b)],并且出现谱峰位置的移动,这是由于羰基基团水合作用的改变引起的。当在亚相中加入海盐之后[图9(d)],COO基团伸缩振动的谱峰出现在1400~1600 cm-1波段。在人工海水界面上复合膜主要振动谱峰的指认结果如表2所示。COO基团特征峰的存在是由于羧酸基团与亚相中海盐离子的作用,使得脂肪酸部分解离为羧酸阴离子,由此可以确定脂肪酸分子在界面上存在质子化和去质子化两种形式。
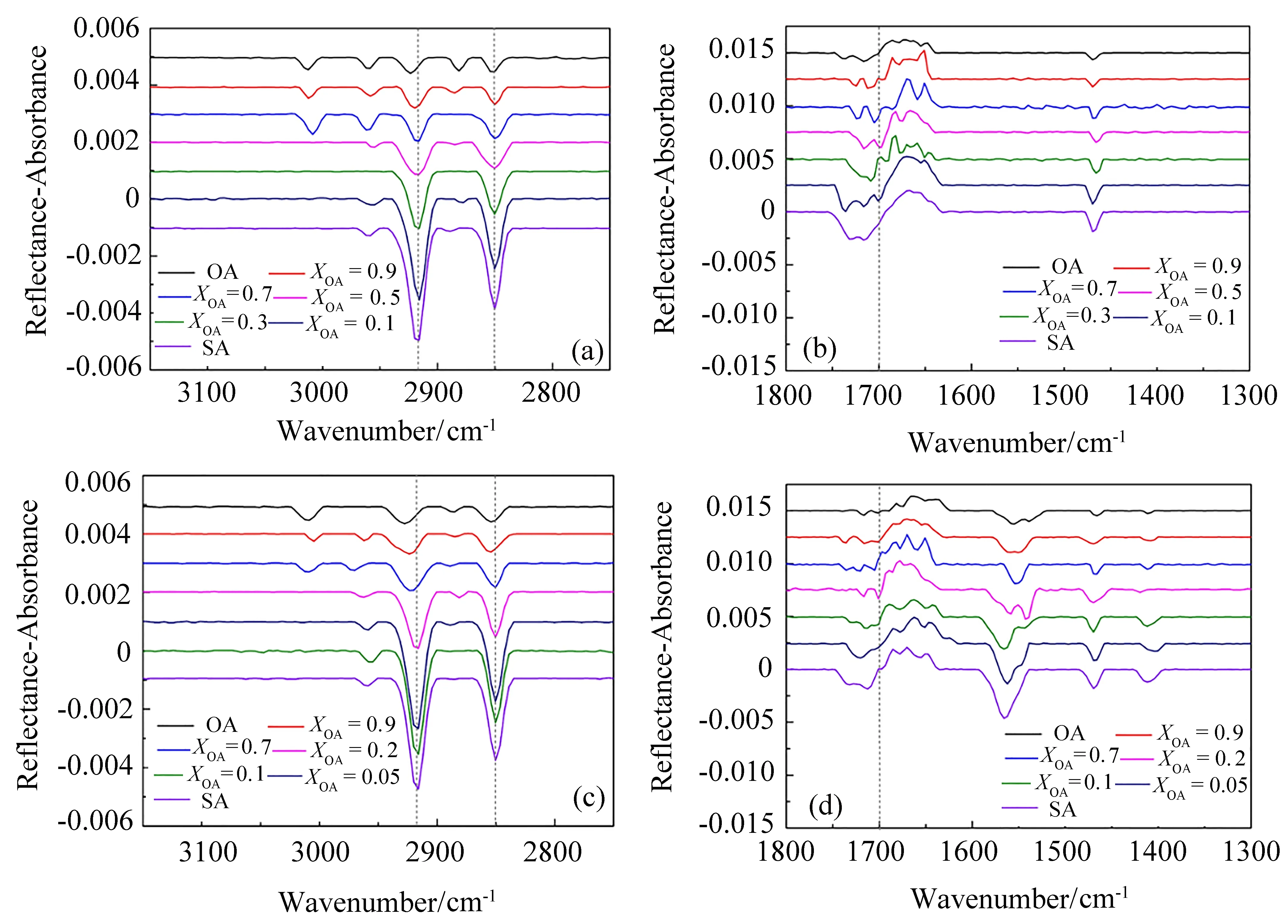
图9 SA-OA复合膜在纯水(a)、(b)和人工海水(c)、(d)界面上的IRRAS谱图Fig.9 IRRAS spectra for the mixed SA-OA monolayers on pure water(a),(b)and artificial seawater(c),(d)subphases

表2 在22 mN·m-1表面压下SA-OA复合膜的IRRAS谱峰指认和相应νas(CH2)和νs(CH2)的峰强度比值(Ias/Is)以及CH2弯曲振动谱带δ(CH2)Table 2 Assignment of IRRAS peaks of mixed SA-OA monolayers and corresponding Ias/Isvalue of νas(CH2)and νs(CH2)peaks,and the scissoring mode of CH2 δ(CH2)at the surface pressure of 22 mN·m-1
3 结 论
SSA(特别是有机膜)的组成可以通过改变其界面形态影响水分子的沉积和蒸发,以及反应性气体和自由基从气相到颗粒相的传输,进而影响其云凝结核活性以及一系列的非均相化学反应[5,55]。高度有序排列的有机膜如SA单分子膜的形成能够抑制这些物理化学过程,而真实SSA界面上不同有机物之间的相互作用则可以通过降低界面分子密度和稳定性加速SSA的大气演化[56,57]。由于气溶胶的光学性质依赖于它们的粒径[58,59],理解颗粒表面吸收或蒸发水分的能力对于全球辐射平衡的模拟具有重要意义。
组成SSA有机膜的物质具有广泛的分子形式、溶解度、表面活性、构象和界面取向,这些都可能会影响气溶胶的大气过程。本研究采用界面光谱技术与Langmuir槽相结合的方式,测定具有不同饱和度和双键构型的SA-OA和SA-EA复合膜发现,不饱和脂肪酸可以明显地降低界面分子的堆积密度和有序性。不同的双键构型对有机膜稳定性的影响程度也不同,相对于EA,具有cis构型双键的OA由于其较大的空间位阻影响更为显著。此外,观察脂肪酸复合膜对亚相中主要海盐离子组分的响应发现,与纯水上的有机膜相比,在含Ca2+的亚相上形成的有机膜更加稳定。这个现象从分子层面上解释了Ca2+在真实SSA中的高度富集现象。
