双硫仑抗肿瘤作用及其机制研究进展
2022-02-23骆玲玲朱梓睿赵馨媛王婷婷张丽慧
骆玲玲,朱梓睿,赵馨媛,王婷婷,张丽慧,杨 怡
(杭州师范大学药学院,浙江省榄香烯类抗癌中药研究重点实验室,浙江省中药资源开发与应用工程实验室,浙江省协同创新中心,浙江杭州 311121)
双硫仑(disulfiram),商品名为戒酒硫(Antabuse),是一种二硫代氨基甲酸盐,分子式为C10H20N2S4,水溶解度约为0.2 g·L-1。双硫仑的代谢产物可通过抑制乙醛脱氢酶(aldehyde dehydrogenase,ALDH)使嗜酒者血乙醛浓度升高,产生面部潮红、头痛、恶心、呕吐等不适感而放弃酗酒,从而达到戒酒的目的[1]。1948年,美国食品药品监督管理局批准双硫仑用于临床治疗酒精依赖症,至今已在临床使用70余年[2]。此外,双硫仑也用作橡胶硫化促进剂,在化工领域使用。
研究发现,除治疗酒精依赖症外,双硫仑还具有多种药理作用,如抗炎[3-4]、抗菌[5-6]、抗病毒[7-8]和调节代谢[9]。近年来,大量细胞和动物实验研究结果表明,双硫仑具有广谱抗肿瘤活性,能抑制多种人源肿瘤细胞增殖、迁移、侵袭和血管生成等,诱导肿瘤细胞死亡[10-11]。此外,双硫仑的抗肿瘤作用与其可螯合二价铜离子(Cu2+)密切相关,二价铜离子可显著增强其抗肿瘤效应。2017年,Nature首次报道双硫仑抗肿瘤作用机制,为其临床应用奠定了基础[12]。目前,双硫仑抗肿瘤治疗的临床试验在欧美国家广泛进行,但关于其针对实体瘤的疗效目前还无法明确。本文就双硫仑抗肿瘤作用及其作用机制研究进展进行综述,为拓宽其临床应用提供思路。
1 体内代谢
双硫仑相对分子质量约296,由巯基、乙基和秋兰姆结构构成,其中巯基基团对其抗肿瘤作用的发挥具有重要意义[13]。口服后,80%~90%被胃肠道吸收,1%~20%随粪便排出[14],半衰期约7.3 h。双硫仑在人体组织内广泛分布,在肾、胰腺、肝和胃肠道中浓度较高[15]。双硫仑主要在肝内代谢,双硫键断开后生成两分子二乙基二硫代氨基甲酸酯(diethyldithiocarbamate,DDC)[16-17]。DDC 是强效金属螯合物,通过巯基基团与多种重金属离子螯合,尤其是二价铜离子。DDC在酸性环境中不稳定,与Cu2+形成复合物二乙基二硫代氨基甲酸铜〔copper diethyldithiocarbamate,Cu(DDC)2〕。 Cu(DDC)2较DDC更稳定,自身也具有抗肿瘤活性(图1)。更重要的是,与其他组织(如肝和脑组织等)和血液相比,Cu(DDC)2在肿瘤组织中的浓度明显增高[12],显示出特异性抗肿瘤的优势和潜力。
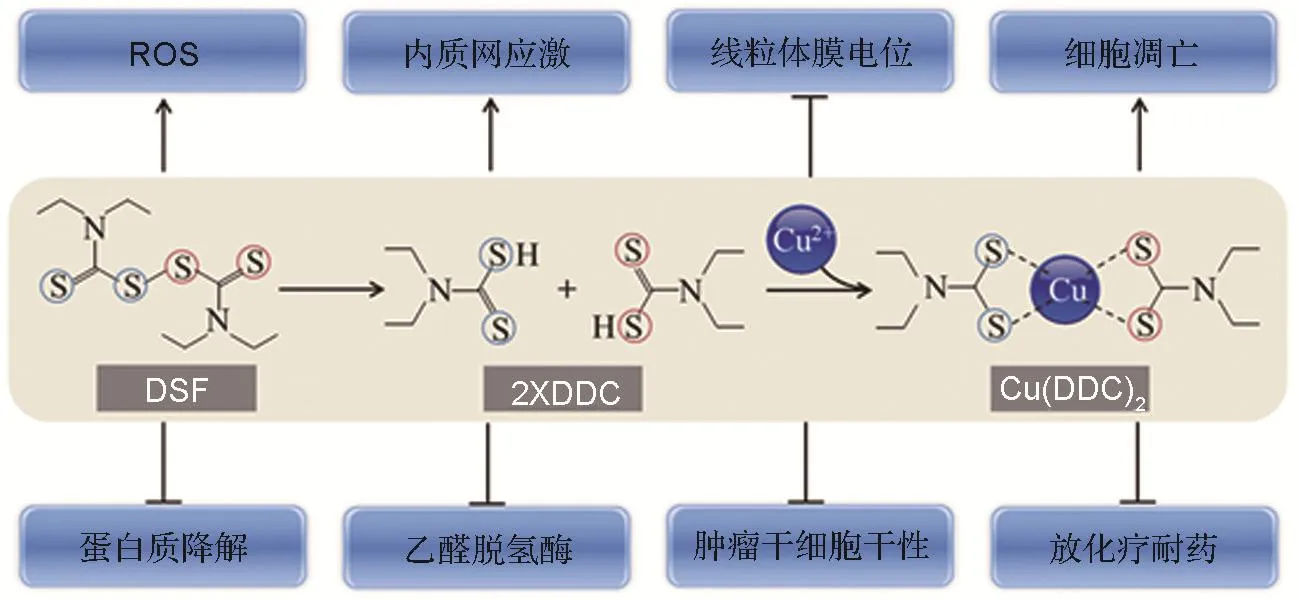
图1 双硫仑(DSF)联合铜离子广泛影响肿瘤细胞生物学功能.DDC:二乙基二硫代氨甲酸酯;Cu(DDC)2:二乙二硫代氨甲酸铜;ROS:活性氧;↑:诱导或促进;⊥:降低或抑制.
2 抗肿瘤作用机制
双硫仑通过多种途径影响肿瘤细胞的生物学功能,如抑制肿瘤细胞增殖、侵袭和转移;促进细胞氧化应激,诱导细胞凋亡;干扰细胞内蛋白质降解。另外,可诱导内质网应激,降低线粒体膜电位,抑制ALDH,削弱肿瘤细胞干性,提高肿瘤细胞对放化疗的敏感性等(图1)。Cu2+可明显增强双硫仑的抗肿瘤效应。
2.1 抑制肿瘤细胞增殖、侵袭和转移
大量细胞和动物实验结果表明,双硫仑抗瘤谱较广,对乳腺癌[18-20]、肝癌[21-22]、肺癌[13,23]、胰腺癌[20,24-25]、胶质瘤[26-27]和前列腺癌[28]等癌细胞增殖具有明显抑制作用。双硫仑对肿瘤细胞增殖的抑制效应可能与其干扰肿瘤细胞的细胞周期有关。对人乳腺癌MCF7、人非小细胞肺癌A549和急性髓系白血病KG-1细胞,单用双硫仑或其联合Cu2+可致G0/G1期和S期细胞周期阻滞[29-31]。
侵袭和转移是恶性肿瘤细胞的基本生物学特性,而血管生成则是影响该过程的重要因素之一。研究表明,双硫仑抑制肿瘤细胞的迁移和侵袭能力,抑制血管形成[32-34]。转化生长因子β1处理人舌鳞癌SCC-25和CAL-27细胞,该细胞出现上皮-间充 质 转 化(epithelial-mesenchymal transition,EMT),而双硫仑可通过调控EMT标志蛋白表达,如上调E钙黏蛋白(E-cadherin)表达、下调波形蛋白(vimentin)和Snail蛋白表达,有效抑制该细胞EMT,阻滞细胞迁移和侵袭[35-36]。双硫仑联合Cu2+可抑制肝癌细胞NF-κB、下调EMT的关键因子Snail和Slug蛋白表达[22]。此外,其通过阻断Ⅳ型胶原酶、基质金属蛋白酶2(matrix metalloproteinases-2,MMP-2)和MMP-9的活性,抑制高转移人肺腺癌CL1-5细胞、人膀胱腺癌NTUB1细胞和人脐静脉内皮细胞的侵袭能力[33]。人恶性胶质瘤U87荷瘤裸鼠给予双硫仑和葡萄糖酸铜治疗,能减少血管内皮生长因子分泌,抑制肿瘤新生血管生成[34]。
2.2 调控氧化应激,诱导细胞凋亡
双硫仑代谢为DDC后,DDC与Cu2+螯合,使细胞内氧化还原反应失衡,活性氧(reactive oxygen species,ROS)水平异常升高,诱发细胞毒性。以双硫仑处理口腔鳞癌细胞系,可上调ROS,激活内质网未折叠蛋白反应,诱导内质网应激和细胞凋亡[37]。双硫仑对内质网应激的作用可能与其激活内质网应激传感器肌醇必需酶1α,使X-盒结合蛋白1(X-box binding protein 1,XBP1)剪切形成功能活跃的转录因子XBP1,调控下游内质网应激相关蛋白CHOP基因表达相关[38]。双硫仑联合Cu2+处理人乳腺癌SUM149细胞后,细胞线粒体和胞浆内超氧自由基水平显著升高,超氧化物歧化酶1和还原型谷胱甘肽含量明显减少[39]。对来自多发性骨髓瘤患者的肿瘤细胞进行体外原代培养,发现双硫仑和Cu2+降低线粒体膜电位,增加ROS生成,活化胱天蛋白酶,引起细胞凋亡,而上述作用可被抗氧化剂N-乙酰半胱氨酸逆转[40]。也有学者指出,双硫仑和Cu2+可能在短期内通过生成ROS触发人乳腺癌MCF7细胞损伤,长期处理可通过其他信号通路引起该细胞死亡[41]。ROS作为信号分子,在体内半衰期短,活性有限[42]。因此,双硫仑和Cu2+必须在肿瘤细胞或邻近肿瘤细胞的位置发挥作用。
2.3 干扰细胞内蛋白质降解
有研究团队指出,双硫仑的抗肿瘤作用并非依赖于对ALDH的抑制。双硫仑代谢产物与Cu2+结合,结合物与核蛋白定位蛋白4结合并促进该蛋白聚集,从而干扰p97/含缬酪肽蛋白介导的细胞内蛋白质降解,诱发人肺癌A549和人骨肉瘤U-2OS等细胞死亡[12,43],提示双硫仑的抗肿瘤效应可能与其干扰细胞内正常蛋白质降解通路有关。细胞内蛋白质主要通过泛素-蛋白酶体和自噬-溶酶体途径降解。研究表明,双硫仑或其联合Cu2+可有效抑制蛋白酶体功能,改变溶酶体酸性环境,使蛋白质得不到及时清除而引起食管鳞癌和乳腺癌细胞损伤[44-45]。
3 提高肿瘤细胞放、化疗敏感性
研究显示,双硫仑可增强化疗药物的作用。双硫仑与其他临床常用化疗药物(如顺铂和紫杉醇等)联合使用,可增强肿瘤细胞对药物的敏感性,提高抑瘤效果[46-47]。睾丸生殖细胞肿瘤患者肿瘤组织高表达ALDH1亚型ALDH1A3[46]。在荷瘤小鼠模型中,双硫仑和顺铂联合用药可降低生殖细胞移植瘤内ALDH1A3的表达,抑制移植瘤在体生长[46]。细胞实验同样证实,双硫仑联合Cu2+可降低紫杉醇耐药人肺癌A549细胞和长春新碱耐药人口腔上皮癌KB细胞内ALDH活性,逆转耐药[47]。
肿瘤干细胞是具有自我更新能力,产生异质性的肿瘤细胞,是导致化疗耐药和放疗抵抗的关键原因。ALDH是ROS清道夫,有助于消除氧化应激,使肿瘤细胞对化疗药物产生耐药,在肿瘤干细胞中表现出较高活性[48]。在乳腺癌来源的肿瘤干细胞中,双硫仑抑制ALDH,抑制肿瘤细胞干性,增加ROS蓄积,诱导肿瘤干细胞凋亡[19]。与单独放疗组相比,软骨肉瘤荷瘤小鼠给予双硫仑联合Cu2+放疗可更有效降低ALDH+CD133+肿瘤细胞百分比,抑制肿瘤细胞干性,阻止肿瘤生长,延长荷瘤小鼠的生存时间[49]。
因此,双硫仑或可作为辅助治疗手段之一,通过抑制ALDH活性提高肿瘤细胞对放化疗的敏感性,用于临床难治性和耐药肿瘤的治疗。
4 抗肿瘤临床试验疗效
目前,双硫仑用于治疗肿瘤的临床试验主要在欧美国家展开。截至2022年1月23日,在临床试验注册网站(https://clinicaltrials.gov/)共检索到21项相关研究,其中最早的1项自2002年启动,部分试验仍在进行中。如表1所示,涉及胶质瘤、黑色素瘤、胰腺癌、乳腺癌和前列腺癌等实体瘤患者的临床Ⅰ,Ⅱ和Ⅲ期研究。在药物干预方面,肿瘤患者除口服给予双硫仑(250或500 mg·d-1)外,部分研究加用Cu2+(如葡萄糖酸铜),联合常规化疗药治疗。部分临床试验已获得初步结果,非小细胞肺癌、胶质瘤等患者对双硫仑的耐受性得到了验证[50-52]。对丹麦2000-2013年间首次确诊的所有肿瘤患者(35~85岁,排除肝和肾疾病)的流行病学分析结果显示,坚持服用双硫仑的患者比停用的患者肿瘤相关死亡率低[12]。在传统化疗方案的基础上加用双硫仑,可延长初诊非小细胞肺癌患者的生存时间[50]。如能在临床试验中获得满意疗效,双硫仑极有可能作为一种全新的廉价肿瘤治疗药物造福肿瘤患者。然而,也有临床试验结果表明,双硫仑和二价铜离子并未显著提高替莫唑胺对胶质瘤的治疗结果[52]。因此,双硫仑抗肿瘤的疗效还需更多的临床试验验证。
5 双硫仑药物递送系统
尽管双硫仑在多项实验中显示出优越的抗肿瘤效应,但因其稳定性差、半衰期短、快速代谢等问题,限制了其临床应用[53]。如何提高双硫仑的稳定性是近期研究的热点之一。因此,研究人员致力于改良药物递送系统,提高双硫仑的抗肿瘤效应。
通过物理封装,将双硫仑包裹在纳米颗粒[54-58]或纳米结晶[59-60]中进行药物递送,有望改善药物的药动学和药效学特征,这些递送系统各具优势。例如,掺杂Cu2+并负载双硫仑的中空介孔二氧化硅纳米颗粒,利用肿瘤微环境,将二者特异性导入肿瘤细胞中,诱导肿瘤细胞死亡,而不影响周围正常细胞[54]。这种纳米催化肿瘤治疗的方法具有靶向性高、特异性强等优势。以修饰改良的脂质纳米颗粒为载体递送双硫仑,提高载药量、包封率和靶向性,延长药物在体内的作用时间[56-58]。双硫仑与紫杉醇纳米晶体可提高紫杉醇耐药人肺癌A549细胞对药物的敏感性[59-60]。改良后的双硫仑制剂,将有助于提高药物稳定性、载药量和特异性,突破肿瘤耐药瓶颈,在提高疗效的同时保证安全性。

表1 双硫仑治疗肿瘤临床试验
6 结语
细胞和动物实验结果表明,双硫仑具有广谱抗肿瘤潜力,为老药新用提供新思路。双硫仑临床应用的安全性已得到广泛确认,研发过程可免去已有的药动学和毒理学评价,因此可大大缩短药物开发时间和研发成本。尽管如此,关于双硫仑治疗肿瘤有效性的临床资料还十分有限,需要更多数据资料支持。在临床试验中,双硫仑多以口服方式给药,由于其生物利用度低、体内易代谢降解等问题,其与Cu2+螯合物在肿瘤组织水平仍然较低,影响抗肿瘤效应的发挥。此外,双硫仑和Cu2+具有不同的药动学特征,单一制剂分别给药难以发挥最优的协同作用。因此,靶向肿瘤治疗的双硫仑新剂型的设计和研发,也将有望弥补其稳定性差、半衰期短等缺陷,使其在临床广泛应用。
