姜黄素纳米混悬液的制备及体内药动学
2022-02-23彭一凡王荣荣庄笑梅张文鹏邓耀辰郑爱萍
彭一凡,王荣荣,2,庄笑梅,张文鹏,邓耀辰,高 静,张 慧,郑爱萍
(1.军事科学院军事医学研究院毒物药物研究所,北京 100850;2.华北理工大学药学院,河北 唐山063210;3.广东医科大学药学院,广东 东莞 523822)
热射病是一种严重的中暑,主要临床表现为核心体温>40℃,皮肤干热,中枢神经系统异常,严重时可出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1]。热射病发病急骤,临床表现凶险,病死率和病残率极高,目前国内外均无用于该病治疗的特效药上市。
姜黄素(curcumin)是一种从姜黄中提取的酸性酚类化合物,在抗炎、抗氧化、抗感染、抗肿瘤和降血脂等方面有很好的疗效,且尚未发现明显的不良反应,具有广阔的开发前景[2-7]。研究表明,姜黄素对热射病引起的肺损伤[8,12]、心肌损伤[9,18]、肝损伤[11]、肾损伤[15]、脑损伤[13]和肠黏膜病理损伤[10,17]均有良好的改善作用,并能维持血液指标稳定[14],纠正电解质紊乱[16],是防治热射病的良好药物。然而,姜黄素属于生物药剂学分类系统4类药物(水中溶解度仅为11 μg·L-1[19]),其难溶性严重制约了其临床应用。
纳米晶制剂具有可提高药物饱和溶解度和溶出速率、降低食物效应、药物剂量调整范围宽、不良反应轻、易于工业化生产和剂型多样化等优势[20-28]。为解决溶解度低的问题,本研究采用目前上市纳米晶药物最常用的介质研磨技术,选用硬度高、杂质残留少、符合美国FDA认证的氧化锆珠进行介质研磨[29],制备稳定的姜黄素纳米晶混悬液,以提高姜黄素的溶解度和溶出速率,进而提高生物利用度,为其临床应用提供参考。
1 材料与方法
1.1 药品、试剂和主要仪器
姜黄素(批号:20201027),陕西亿康龙生物技术有限公司。吐温80(批号:20180801),江西益普生药业有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,批号:WXBC1167V),上海麦克林生化科技有限公司;冰醋酸(批号:20190325),国药集团化学试剂有限公司。激光粒度仪(Nano-ZS90),英国Malvern公司;研磨机(DYNO®-MILL ECM-AP05),华尔宝机械有限公司;溶出试验仪(RC806D),天津市天大天发科技有限公司;磁力搅拌器(HJ-3),常州金坛晨阳电子仪器厂;冷冻干燥机(LGJ-18C),北京四环科学仪器厂;真空干燥箱(DZF-6050),上海一恒科学仪器有限公司;高效液相色谱仪(UltiMate 3000),美国Thermo公司;X射线衍射仪(D8 advance),德国布鲁克公司;差示扫描量热仪(DSC 200F3),德国NETZSCH公司;场发射扫描电子显微镜(JSM-7900F)和透射电子显微镜(JEM-1400Plus),日本电子株式会社;电子分析天平(BT-25S),德国Sartorius公司。
1.2 动物
12只SD大鼠,雄性,体重200~230 g,购自北京科宇动物养殖中心,许可证号:SCXK(京)2018-0010。大鼠置于温控22~25℃、相对湿度40%~50%、12/12 h昼夜明暗交替环境中饲养7 d,自由饮水摄食。本研究涉及的动物实验经军事医学研究院实验动物伦理委员会批准,审查编号IACUCDWZX-2020-639。
1.3 姜黄素纳米晶混悬液制备工艺
采用介质研磨法制备姜黄素纳米晶混悬液。称取处方量的吐温80加蒸馏水溶解,获得稳定剂溶液,将适量姜黄素原料药均匀分散于稳定剂溶液中,然后将混悬液转移到研磨机中(填充60%0.3 mm氧化锆珠),开启研磨机将转速升至3000 r·min-1,研磨得到目标粒径的纳米混悬液。
1.4 Box-Behnken实验优化姜黄素纳米晶处方工艺
预实验研究发现,研磨转速、姜黄素用量和稳定剂与药物的比例是影响纳米晶粒径的关键参数。本研究采用Box-Behnken设计系统研究3种关键参数对纳米晶粒径的影响,根据预实验对3个关键参数范围的筛选,确定稳定剂与原料药质量比(A)为1∶10~1∶2,姜黄素质量百分比(B)为10%~30%,转速(C)为1500~3000 r·min-1。使用软件Design-Expert 8.0.6进行实验设计,共进行17次实验,每次研磨30 min,设计方案见表1。对实验结果进行统计分析,预测最优处方工艺。
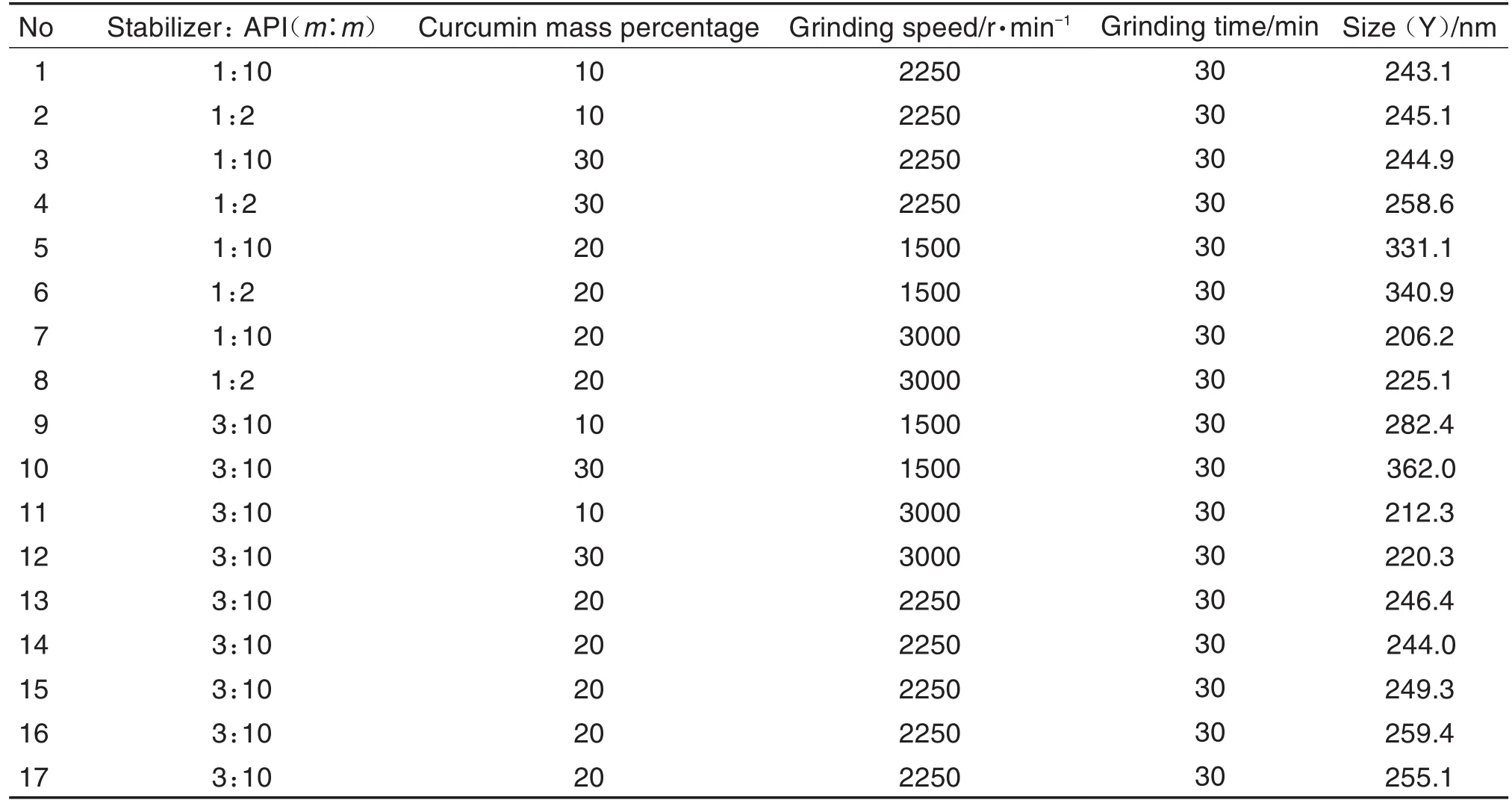
Tab.1 Design and result data on Box-Behnken test for optimizing formation process of curcumin nanocrystalline suspensions
1.5 姜黄素纳米晶混悬液粒度和Zeta电位测定
纳米晶混悬液在不同温度下储存,监测放置期间的稳定性。定期取适量姜黄素纳米晶混悬剂,蒸馏水稀释至40 mg·L-1,采用Nano-ZS90粒度分析仪测定姜黄素纳米晶的粒度、多分散系数和Zeta电位,测定温度25℃,平衡时间60 s,每个样品测量3次。
1.6 姜黄素纳米晶形态观察
分别采用扫描电镜(scanning electron microscope,SEM)和透射电镜(transmission electron microscope,TEM)观察姜黄素纳米晶混悬液的形态及分布特征。取1滴稀释后的纳米晶混悬液滴于SEM样品台上,自然晾干后喷金进行SEM观察;取1滴稀释后的纳米晶混悬液滴于载样铜网上,室温置5 min后用滤纸吸干,加3%磷钨酸负染5 min,自然晾干后在加速电压100 kV下进行TEM观察。
1.7 X-射线粉末衍射分析(X-ray powder diffraction,XRPD)姜黄素纳米晶制剂晶型
取姜黄素原料药、空白辅料(吐温80)、物理混合物(姜黄素原料药和吐温80)、纳米晶混悬液冻干粉末和纳米晶混悬液真空干燥粉末各适量,进行XRPD测定。工作条件为管电压40 kV,管电流40 mA,扫描范围3~40°,扫描速度每步停0.1 s,步长0.02°。所得结果绘制XRPD曲线图,根据姜黄素衍射峰变化判断晶型的变化。
1.8 差示扫描量热分析(differential scanning calorimetry,DSC)姜黄素纳米晶制剂晶型
取姜黄素原料药、空白辅料(吐温80)、物理混合物(姜黄素原料药和吐温80)、纳米晶混悬液冻干粉末和纳米晶混悬液真空干燥粉末各适量于铝坩埚中,盖上扎孔,进行测试。工作条件为氮气流速20 mL·min-1,以 10℃·min-1的速度由 28℃升至300℃,测得结果绘制DSC曲线图,根据姜黄素吸热峰位和强度的变化判断晶型的变化。
1.9 体外溶出实验
参考2020版《中华人民共和国药典》收载的姜黄素高效液相色谱(HPLC)法,结合本研究的特点,对流动相比例进行了相应调整,建立HPLC法测定姜黄素含量。色谱条件:色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-4%冰醋酸溶液(55∶45,V/V);检测波长430 nm;柱温30℃;流速为1 mL·min-1;进样量10 μL。
采用2020版《中华人民共和国药典》中的桨法考察不同粒径姜黄素混悬液的溶出特性。取含姜黄素90 mg的各混悬液,加入900 mL溶出介质(1%SDS水溶液)中,转速75 r·min-1,温度为37℃。分别于5,10,15,20,30,45,60,90,120和180 min取样10 mL,用0.22 μm聚四氟乙烯滤膜过滤,收集滤液,HPLC法测定其中姜黄素浓度,计算累积溶出度并绘制溶出曲线。累积溶出计算公式:Xi累积=Xi+(X1+X2+Xi-1)V2/V1。其中,Xi为第i次实际测得的相对百分溶出度,Xi累积为第i次经校正后的累积百分溶出度,V1为溶出介质总体积,V2为每次取样后的补液体积。
1.10 药动学实验
将12只健康雄性SD大鼠随机分为2组,分别ig给予姜黄素原料药混悬液和姜黄素纳米晶混悬液,给药前禁食12 h,自由饮水。按照剂量为200 mg·kg-1ig给药后,分别于0.125,0.25,0.5,1,2,4,6,8,12 和 24 h 大鼠眼眶采血 0.5 mL,置EDTA-K2抗凝管中,2500×g离心5 min,取上清液转移至空白Ep管中,-20℃保存。
采用HPLC-质谱联用法测定每个时间点的血药浓度。分析条件:流动相A相为水(含0.1%甲酸),B相为乙腈(含0.1%甲酸);梯度洗脱:0~0.3 min,10%B;0.3~2.5 min,10%B→95%B;2.5~3.0 min,95%B;3.0~4.0 min,10%B;流速为0.7 mL·min-1;柱温40℃;采用多反应监测模式测定姜黄素(m/z为369.3/177.1)的浓度,普萘洛尔作内标(m/z为260.1/116.1),离子源为电喷雾离子源。准确度、精密度、基质效应、回收率和稳定性等均符合要求。
取待测血浆样本25 μL,加β-葡萄糖醛酸苷酶2.5 μL,混匀后37℃孵育1 h,再加100 μL内标工作液(50 μg·L-1),混匀后于4℃,2500×g离心10 min;取上清液 70 μL,加 50% 乙腈 210 μL 混匀,于 4℃,2500×g离心2 min,取上清液进样分析。
1.11 统计学分析
采用DAS 2.0软件以非房室模型分析方法计算药代动力学参数,由IBM SPSS 23.0软件进行统计分析,组间比较采用独立样本t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 优化的姜黄素纳米晶处方工艺
按Box-Behnken设计实验优化纳米晶混悬剂的处方工艺,通过Design-Expert 8.0.6软件进行回归拟合,得各实验因子对粒径影响的回归方程:Y=250.84+5.55A+12.86B-56.56C+2.92AB+2.28AC-17.90BC+1.83A2-4.75B2+23.16C2,基中A:稳定剂与原料药质量比;B:姜黄素质量百分比;C:研磨转速,方差分析结果见表2。回归方程拟合模型P值为0.0002,表明模型有效可靠,失拟项P>0.05,表明模型与实际值差异较小,采用该实验设计优化处方工艺可信度高。除线性关系外,各参数间还存在交互影响,其中B,C,BC和C2对粒径的影响最为显著,所考察参数与粒径关系的响应面分析见图1。由图1可知,稳定剂与原料药质量比-姜黄素质量百分比的响应面图坡度平缓,表明二者交互作用弱,对粒径影响小;稳定剂与原料药质量比-转速的响应面图较陡,但作用主要体现在转速方面;姜黄素质量百分比-转速响应面图坡度较陡,说明转速、姜黄素质量百分比以及二者的交互作用对粒径影响显著。根据软件分析结果,得制备姜黄素纳米晶口服混悬剂的最优参数为:稳定剂与原料药质量比1∶10,姜黄素质量百分比30%,转速3000 r·min-1,理论上得到粒径198.731 nm的混悬液,按该参数制备的姜黄素纳米晶混悬液粒径实测值为(202.3±1.2)nm(n=3),与理论值极为接近,说明优化结果预测性优良。
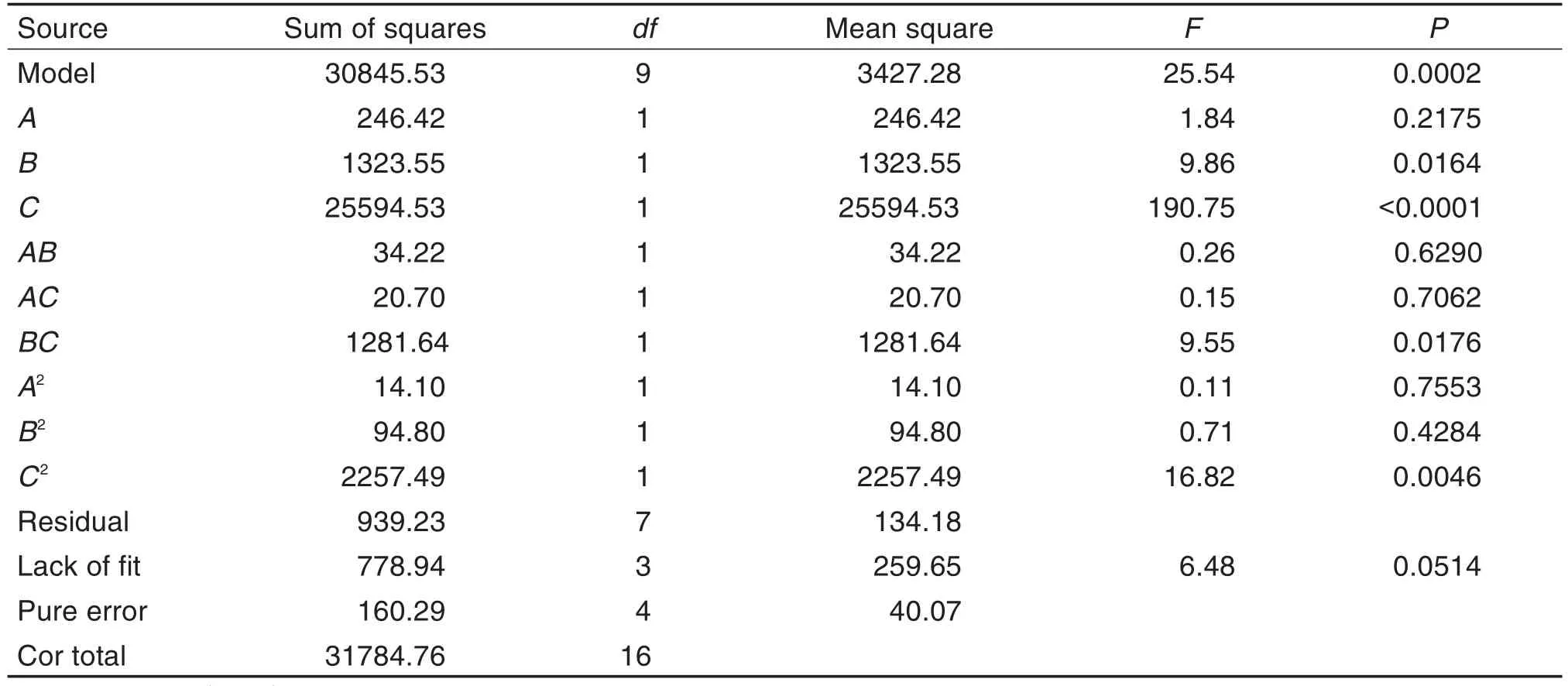
Tab.2 Results obtained from ANOVA of Box-Behnken experiment design
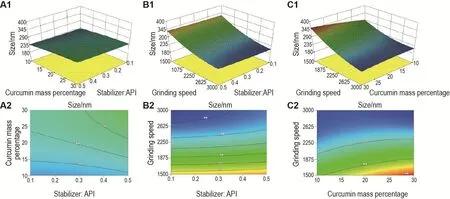
Fig.1 Response surface diagrams of three parameters and their interactions with particle size.See Tab.1 for the results of the 17 experiments designed.The response surface diagrams were drawn with Minitab software.A:the 3D surface(A1)and contour(A2)of stabilizer:API-curcumin mass percentage;B:the 3D surface(B1)and contour(B2)of stabilizer:API-grinding speed;C:the 3D surface(C1)and contour(C2)of curcumin mass percentage-grinding speed.
2.2 纳米晶混悬液粒度和Zeta电位的稳定性
纳米晶混悬液稳定性考察结果(表3)表明,制剂在4,25和40℃条件下,关键质量属性粒径和多分散系数在2个月时间内均无明显变化,姜黄素颗粒尺寸始终维持在约200 nm,且电位无明显变化,表明处方稳定性良好,后续稳定性考察正在进行中。
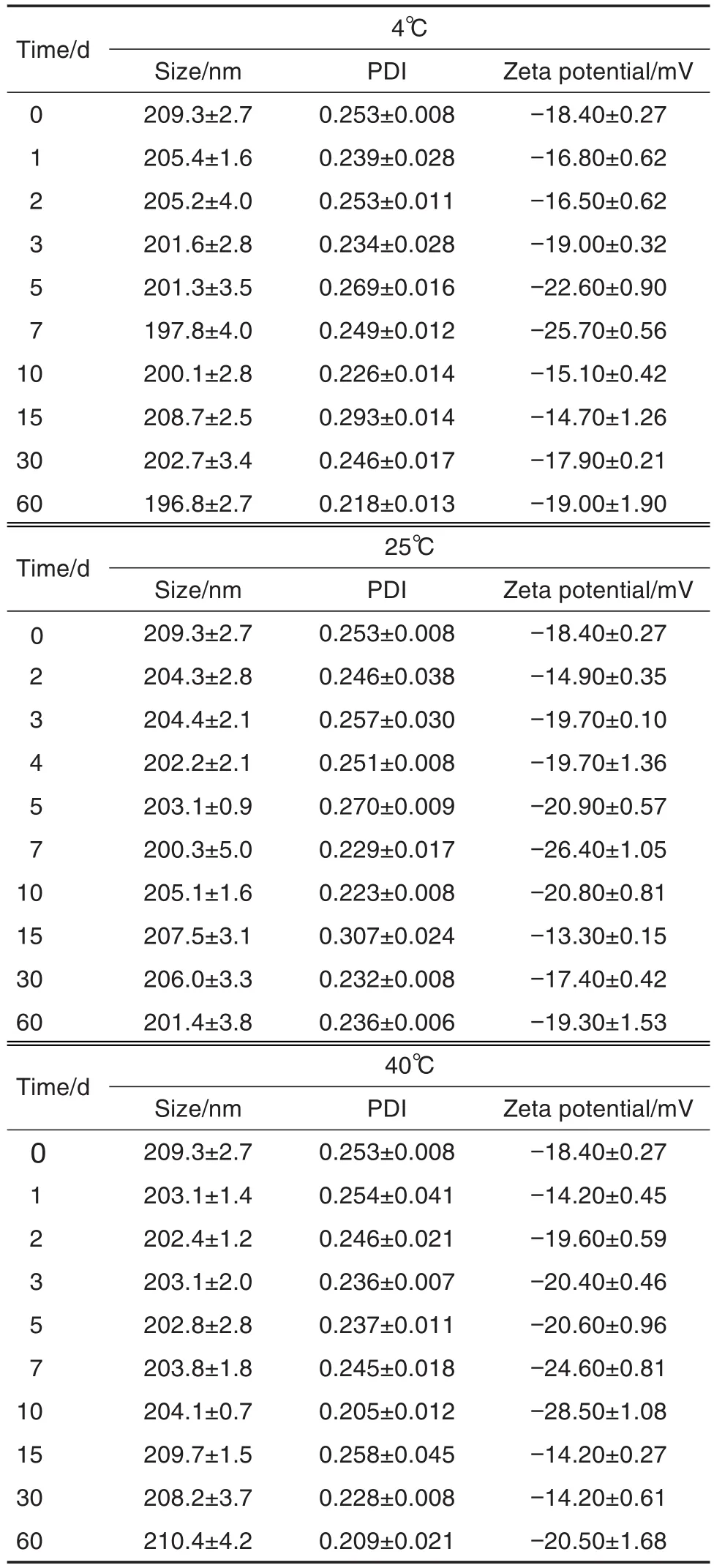
Tab.3 Stability of nanocrystalline suspensions at different temperatures
2.3 姜黄素纳米晶形态
采用SEM和TEM对姜黄素纳米晶的形态及分布进行表征(图2和3)。据2种电镜表征结果,混悬液中姜黄素纳米晶形状不规则,实际粒径约为200 nm,产品粒度分布较为均一,与2.2稳定性考察中粒度分析仪所测结果基本相符。

Fig.2 Scanning electron microscope(SEM)characterization of curcumin nanocrystals.A,B,C and D were the nanocrystals observed under 5000,10 000,10 000,and 20 000 magnifications respectively

Fig.3 Transmission electron microscope(TEM)characterization of curcumin nanocrystals.A,B,C and D were the nanocrystals observed under 10 000,50 000,50 000,and 40 000 magnifications respectively.
2.4 姜黄素纳米晶制剂对晶型的影响
绘制姜黄素原料药、空白辅料、物理混合物和纳米晶的XRPD图谱(图4),可见稳定剂吐温80常温下为液体,无特征衍射峰,而姜黄素原料药在6~30°范围内有特征衍射峰,为结晶态。相比于物理混合物,制成纳米晶后衍射峰位置无显著变化,表明以吐温80为稳定剂的纳米晶晶型未发生显著改变。
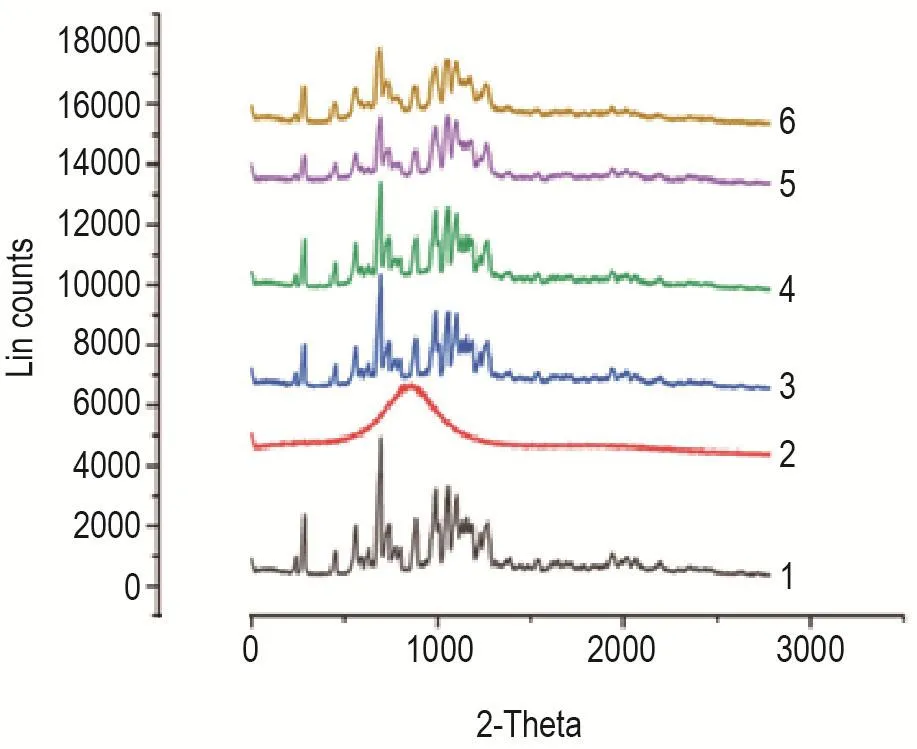
Fig.4 X-ray powder diffraction patterns of curcumin nanocrystalline suspensions,APl and preparation excipients.1:API;2:Tween 80;3 and 4 were the physical mixture of vacuum drying and freeze drying respectively;5 and 6 were vacuum-dried and freeze-dried nanocrystals,respectively.
姜黄素吸热峰约在183℃,吐温80常温下为液体,吸热峰<0℃,对物理混合物和纳米晶峰形无影响。纳米晶吸热峰位置和强度较物理混合物均无明显变化,与XRPD结果相印证,表明该处方晶型基本未发生改变,且干燥方式对晶型无明显影响(图5)。
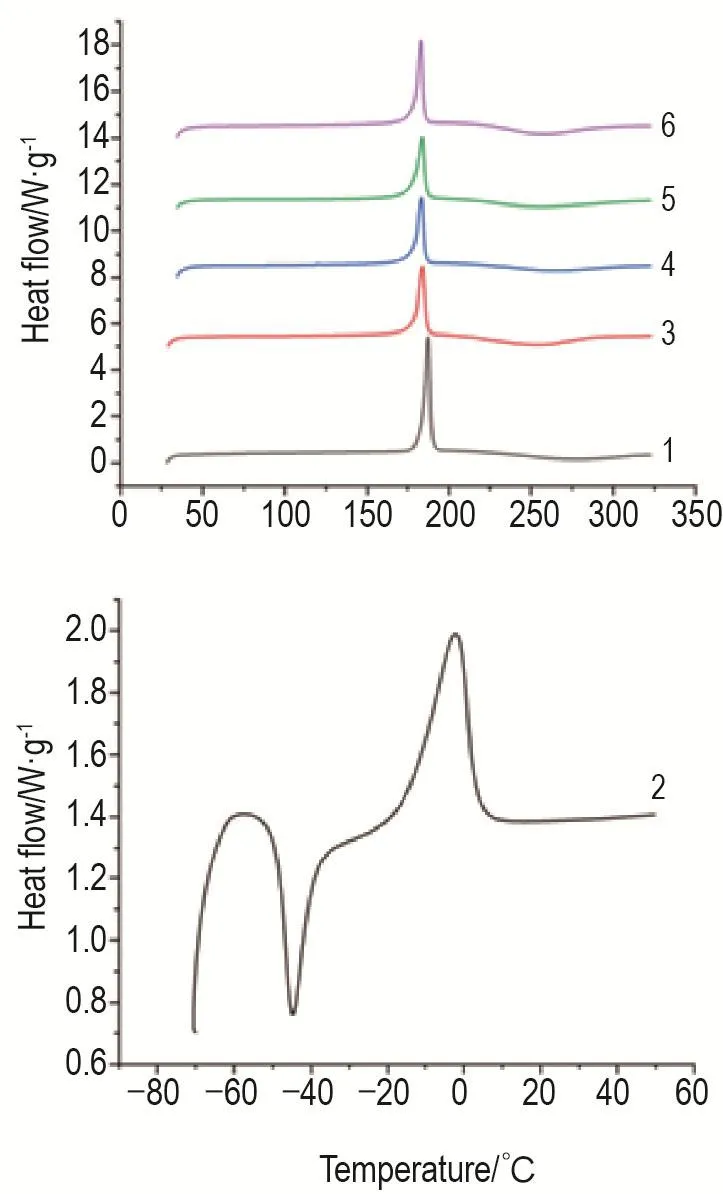
Fig.5 Differential scanning calorimetry(DSC)thermograms of curcumin nanocrystalline suspensions,APl and preparation excipients.1:API;2:Tween 80;3 and 4 were the physical mixture of vacuum drying and freeze drying,respectively;5 and 6 were vacuum-dried and freeze-dried nanocrystals,respectively.
2.5 粒径对姜黄素体纳米晶混悬液外溶出的影响
利用桨法考察不同粒径姜黄素纳米晶混悬液的溶出特性,其体外溶出效果见图6。未经研磨的姜黄素原料药3 h累积释放为(81.5±0.5)%,未完全溶出。与原料药组比较,随着粒径减小,2 μm,500 nm和200 nm组姜黄素溶出速率显著增加(P<0.01),原料药、2 μm、500 nm和200 nm纳米晶样品5 min累积溶出分别为(23.8±1.6)%,(52.1±2.3)%,(84.4±2.6)%和(100.7±1.2)%,其中平均粒径200 nm的姜黄素纳米晶在5 min内即可完全溶出,表明将姜黄素粒径减小到约200 nm能显著提高其溶出度及溶出速率,促进体外释放。
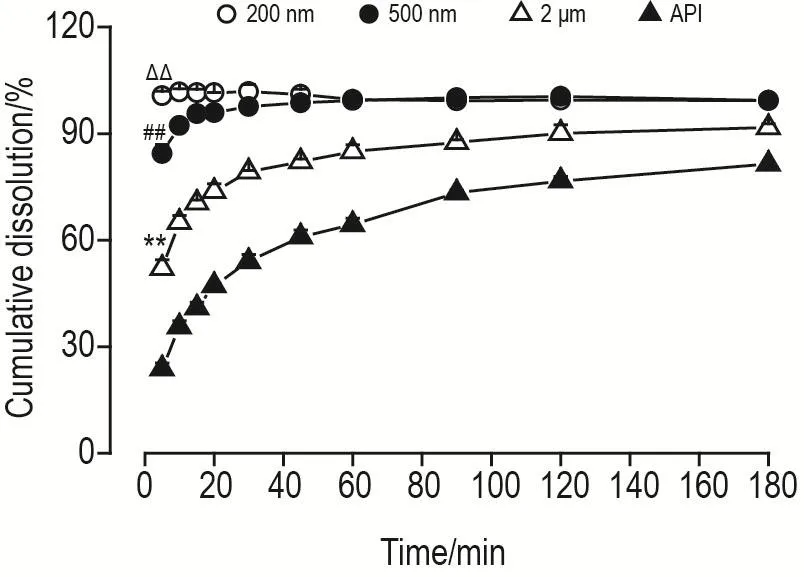
Fig.6 In vitro dissolution curves of curcumin nanocrystalline suspensions and APl of different particle sizes.The suspension samples of each group were added to 900 mL dissolution medium at a speed of 75 r·min-1and a temperature of 37℃.The dissolution samples were collected at 5,10,15,20,30,45,60,90,120 and 180 min,and the concentration of curcumin was determined by HPLC.±s,n=3.**P<0.01,compared with 5 min cumulative dissolution of API;##P<0.01,compared with 2 μm group;ΔΔP<0.01,compared with 500 nm group.
2.6 姜黄素纳米晶大鼠体内药动学
2组药动学参数见表5,药时曲线如图7。姜黄素原料药组和纳米晶混悬液的Tmax与T1/2均无统计学差异,表明制成纳米晶未对姜黄素的达峰时间和半衰期产生显著影响。与原料药混悬液相比,姜黄素纳米晶混悬液的MRT(0-t)明显降低(P<0.05),Cmax和AUC(0-t)均显著升高(P<0.01),姜黄素纳米晶制剂Cmax是原料药的7.75倍,相对生物利用度可达461%,表明将姜黄素原料药制成纳米晶制剂后能显著提高姜黄素的体内生物利用度。
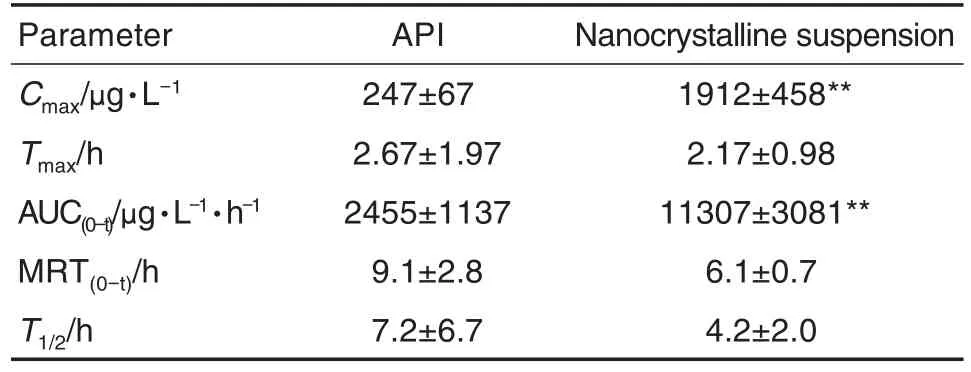
Tab.5 Pharmacokinetic parameters of curcumin nanocrystalline suspension and APl in rats
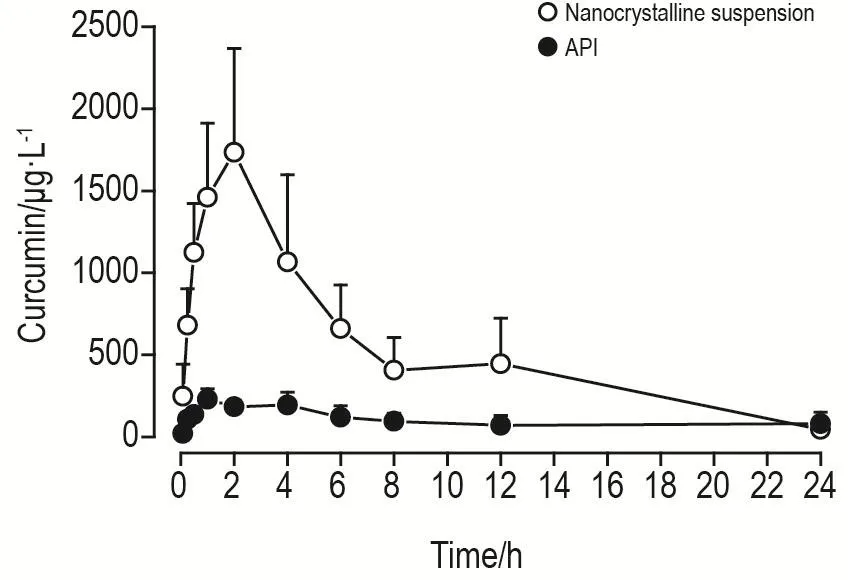
Fig.7 Plasma concentration-time curves of curcumin nanocrystalline suspensions and APl.See Tab.5 for rat treatment.±s,n=6.
3 讨论
本研究采用介质研磨技术制备了姜黄素纳米晶混悬液。为更客观有效地评价各因素对姜黄素粒径的影响,提高纳米晶制备效率,采用Box-Behnken设计对处方工艺进行了优化,确定了最佳参数为姜黄素质量百分比30%,转速3000 r·min-1,稳定剂与原料药质量比为1∶10,按此处方工艺可高效稳定地制备粒度与软件预测结果相符的口服混悬剂。表明实验设计在纳米晶处方工艺优化方面有很高的应用价值,能极大提高处方工艺的筛选效率。SEM、TEM以及粒度分析表征结果一致,表明制备的姜黄素纳米晶粒径接近200 nm且分布较为均一,处方在4℃、室温和40℃条件下粒度均未发生明显改变,具有良好的稳定性(>60 d)。XRPD和DSC考察表明,姜黄素制成纳米晶混悬液前后晶型基本未发生改变。
通过制备不同粒径的姜黄素纳米晶混悬液,比较其体外溶出效果,表明减小姜黄素粒径能有效改善其溶出行为,研磨至200 nm的纳米晶增溶效果显著。本研究结果表明,姜黄素纳米晶混悬液体内吸收迅速,与体外溶出速率的增加相符,该制剂在大鼠体内的峰值浓度和生物利用度分别达到原料药的7.75和4.61倍,优势明显。
本研究制备了室温下放置稳定的姜黄素纳米晶混悬液,确定了最优的处方工艺,显著提高姜黄素的体外溶出度和体内生物利用度,为充分发挥其药理活性奠定了基础。相关研究构建的难溶性药物增溶关键技术体系具有普适性,可为后续新药研发提供新思路。
