YY 0336—2020《一次性使用无菌阴道扩张器》标准解析
2022-02-23姚天平钱心依
姚天平,钱心依
(上海市医疗器械检验研究院,上海 201318)
0 引言
一次性使用无菌阴道扩张器(以下简称“扩张器”)是一种由高分子材料制成的按二类管理的医疗器械,临床上主要用于检查阴道、宫颈口,清洗阴道,刮除或收集组织样本等。
扩张器目前无国际或先进国家的相关标准资料,其历次版本均为国内自主制定。2002年我国发布了第一版强制性行业标准[1-2]。第一版强制性行业标准在实施的10 a中,通过标准复审以及临床医生的反馈,对标准中产品尺寸限定、扩张器抗变形能力试验方法以及环氧乙烷残留量限定等条款进行了较大修改,于2013年我国又发布了第二版强制性标准[3]。从2013年起,结合多年的质量监督抽验的结果,以及标准实施情况的统计分析,对于较为集中的一些细节问题,比如对外观条款的理解缺乏统一原则、使用性能和结构强度表述不够严谨、抗变形能力和结构强度试验方法不够明确等,全国计划生育器械标准化技术委员会决定再次进行全面修订,并于2017年底完成了该标准的修订工作。
2020年3月31日我国发布了YY 0336—2020《一次性使用无菌阴道扩张器》[4],并于2021年4月1日实施。该标准作为医疗器械强制性行业标准,规定了扩张器的结构型式与基本尺寸、要求、试验方法、检验规则、标志、包装和使用说明书、运输、贮存、灭菌失效期的要求。该标准的实施为产品质量的监督抽验提供了依据,也为生产商质量控制提供了相应的指导,推动了产品质量逐步提高。本文主要对比YY 0336新、旧标准主要内容并对新标准中部分重要条款进行分析,为检测人员及生产制造商提供翔实的参考指导,对于统一理解标准条款、统一判定尺度起到一定的推动和规范作用,并为群众的用械安全提供技术支撑。
1 新版标准与旧版标准比较
我国首次发布一次性使用无菌阴道扩张器的行业标准为2002年,并于2013年和2020年进行了2次修订。2013年修订的内容较多,条款和具体指标上都有较大的变化:增加了扩张器的结构型式,删除了前端高度的要求,修改了环氧乙烷残留量的要求,更改了抗变形能力以及结构强度的试验方法。2020版又在2013版的基础上对标准进行了完善,细化了测试方法。一次性使用无菌阴道扩张器行业标准各版本主要内容变化对比见表1。

表1 一次性使用无菌阴道扩张器行业标准各版本主要内容变化对比
2 标准解析
2.1 外观
扩张器的外观属于安全性条款。扩张器外观的检验主要从2个方面考虑:一是扩张器在使用时,其外表面的锋棱、毛刺等会对患者造成伤害;二是医护人员在使用扩张器时,手柄部位的锋棱、毛刺会对医护人员造成伤害。扩张器在制造过程中,尤其是模具使用一定时间后,脱模口会产生一些飞边和毛刺,而修边和毛刺的去除主要依靠工人在线检查的认真程度,如果不严格控制,易造成有瑕疵的产品流入市场。若毛刺等存在于上、下两叶,会对患者的阴道黏膜造成直接的损伤,易引起医源性感染;若毛刺等存在于手柄部位,很容易划伤操作的医护人员。因此,2020版标准对扩张器的使用部位和手柄提出了要求。
2.2 尺寸
扩张器的尺寸属于有效性条款,为医护人员的检查以及样本收集提供了有效保障。扩张器的尺寸从3个方面进行考虑:一是扩张器设计和制造误差,保证其稳定性;二是扩张器的叶长和叶宽,保证其阴道和宫颈口观察以及取样的有效性;三是后端高度,确保医护人员观察的有效性。
扩张器在自然闭合状态时,上、下叶应基本吻合,保证扩张器的结构稳定;在使用过程中,上、下叶应能承受阴道肌肉的张力而有效撑开。2013版的结构强度试验方法可以验证该项性能,若上、下叶左右偏移大于2 mm,加大了在试验过程中扩张器的扭歪程度,意味着扩张器无法有效撑开。
扩张器具有足够的叶长和叶宽是有效观察阴道壁以及宫颈口的保证。该数据主要参考了陈彩霞等[5]主编的《生殖系统病学与遗传学词典》一书中亚洲女性阴道解剖数据以及不同生产商上市的扩张器实测数据,基本满足临床的需求。
后端高度决定视野窗口的大小。视野窗口是为检查者提供从外界观察阴道内部的通道,方便医护人员观察患者阴道内部情况,如视野窗口受阻或高度不够,则会直接影响观察效果。
2.3 抗变形能力
抗变形能力既是扩张器的安全性又是有效性性能。扩张器在使用时,需要承受患者阴道肌肉的“挤压”,若使用过程中变形量过大,则容易引起扩张器严重变形甚至闭合,严重时会发生断裂,给医护人员的观察带来困难,有可能会对患者造成一定伤害,因此抗变形能力十分重要。
抗变形能力的测试方法对抗变形能力数据影响很大,尤其是抗变形能力数据接近30 mm的产品。虽然2013版测试方法较2002版有较大的变化,测试时的数据重现性有了很大的改善,但在相关实验室开展的测量研究中[6],发现载荷的加载方式(加载方向和接触方式)、试验温度、加载速率、载荷持续时间均能影响抗变形能力的测定数据。因此,2020版中对这些影响因素加以限定,比如试验温度修改至(22±2)℃,预载力修改为0~0.5 N,测试速率确定为(90±10)mm/min;增加了推荐的U型夹具示意图等。
2.4 结构强度
结构强度为安全性条款。扩张器在使用过程中,若结构强度达不到规定要求,则随时有滑脱、严重变形甚至断裂的风险,直接影响患者的人身安全。
2020版标准中,结构强度的条款参照了2013版的要求,即施加30 N的力持续1 min。但根据近年来扩张器质量监督抽验中发现的一次性使用无菌阴道扩张器,尤其是聚丙烯材料的扩张器,在施加载荷时会出现以下现象:(1)有裂纹,但未发生断裂;(2)轴销滑脱,导致无法使用,但未发生断裂;(3)严重变形,导致上、下两叶合并而无法观察阴道内情况,但未发生断裂;(4)断裂。因此,在2020版中增加了结构强度的判别依据,由原来的“任何部件不应断裂”修改为“任何部件不应滑脱、裂纹或断裂”,有效保证了扩张器使用的安全性。
2.5 环氧乙烷残留量
环氧乙烷为气体灭菌剂,对细菌、病毒及真菌均有杀灭作用。目前,扩张器通常使用环氧乙烷灭菌,但用环氧乙烷灭菌后,器械中会有一定量的残留。由于环氧乙烷是一种中等毒性的物质,对人与动物具有致突变性、致癌性,对动物的生殖系统也会产生影响,对中枢神经和免疫功能都有一定的抑制作用,因此,应采用GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》对环氧乙烷残留情况进行评价。环氧乙烷残留量的检查应注意3点:(1)环氧乙烷残留量要求,即不大于10 μg/g;(2)环氧乙烷残留量测定时的浸提方法;(3)环氧乙烷检测方法。
2002版行业标准中,环氧乙烷残留量要求为“不大于5 μg/g”。但从实际的标准实施情况来看,由于常用的高分子材料聚丙烯、聚苯乙烯和丙烯腈-丁二烯-苯乙烯对环氧乙烷具有很大的吸附性,若单纯采用塑料袋包装,环氧乙烷残留量很难达到5 μg/g以下,即使采用小部分透析纸包装,也需要很长时间才能达到5 μg/g以下。2013版修订时采用GB/T 16886.7—2001《医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量》[7]进行评价,环氧乙烷残留量“不大于10 μg/g”从收益上已经大于风险,因此,2013版修订时,将环氧乙烷残留量控制在10 μg/g以下。2020版修订时保留了2013版的要求。
不同的浸提方式对环氧乙烷残留量测试结果有很大的影响[8]。在2020版修订时,也有生产商提出改变浸提方式,建议将极限浸提(水、溶剂)修改为模拟产品使用浸提。但考虑到GB/T 16886.7—2015《医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量》[9]中对环氧乙烷残留量控制更加严格,且环氧乙烷具有致突变性和致畸性,故仍建议继续采用水极限浸提法进行浸提,并得到了全国计划生育器械标准化技术委员会委员的一致同意。
考虑到生产商的实际情况,环氧乙烷的分析可以采用比色分析法或气相色谱法,但仲裁时的分析方法为气相色谱法。
3 讨论
扩张器的生产工艺简单,投资少,容易投产,因此生产企业众多,产品质量参差不齐,不良事件发生率也较高[10]。从2015年风险监测以及2016年监督抽验来看[11],各检验项目不符合情况较为严重。表2汇总了2015—2018年一次性无菌阴道扩张器抽验不符合项及不符合率。
从表2可以看出:(1)随着2013年修订标准的实施,生产企业对于强制性标准的执行率越来越高,试验方法得到了统一,扩张器监督抽验的不符合率逐步降低,达到基本可控的安全范围。(2)外观从2002版的总体要求细化到总体要求、上下叶使用部位要求以及手柄要求,且由于标准宣贯到位、生产企业贯标严格,抽验的总体结果非常满意。(3)抗变形能力、结构强度项目的不符合率总体上呈降低趋势,这2项是影响一次性使用无菌阴道扩张器的主要安全性能指标。不符合率的降低,一方面是全国计划生育器械标准化技术委员会对标准中试验方法的完善,使得测量精度和重复性大大提高;另一方面是企业对产品结构的调整以及安全意识的提高。(4)环氧乙烷残留量得到了有效控制,为群众用械提供了安全保证。
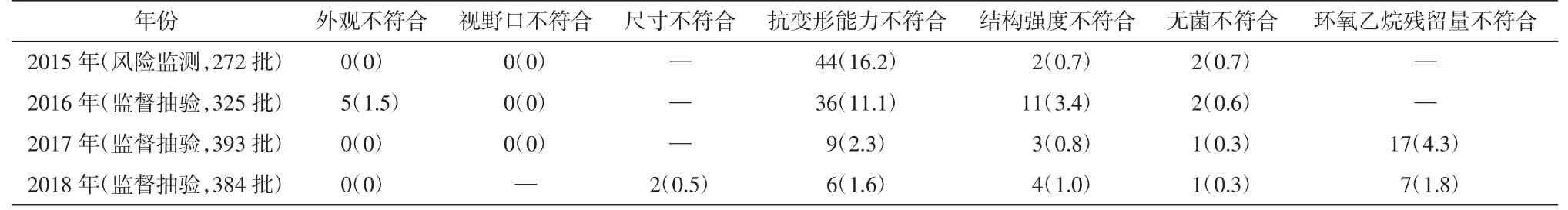
表2 2015—2018年一次性使用无菌阴道扩张器主要检验项目不符合情况汇总单位:批数(%)
虽然各检验项目的不符合率有了大幅下降,但是仍有改善的空间。例如,生产企业可通过及时更换模具以及加强在线检查来消除毛刺、飞边等以便降低外观的不符合率;可通过改进推拉式扩张器槽的大小和深度来改善卡阻的现象;可改进轴转式扩张器的插销匹配性,避免脱销、扭歪甚至断裂现象;可增加上、下两叶的厚度或宽度,提高产品的抗变形能力和结构强度。另外,企业仍需进一步认识到环氧乙烷残留量对人体的危害,通过环氧乙烷灭菌工艺的优化和确认、包装的改进以及仓库通风设施的合理布置,严格控制成品的环氧乙烷残留量。
YY 0336—2020是强制性行业标准,希望进一步强化该标准的宣贯力度,确保企业、监管部门等能够更好地理解该标准的条款,减少歧义,有效指导生产商通过提高研发能力和管理水平来提升产品的质量,降低相关不良事件的发生概率。承担上市后监督检验的单位应严格实施新标准,统一检验方法,统一判罚尺度,同时优化抽验方案,要对占据市场主体的大型生产企业、经营企业、医疗机构进行抽样,也要对小、散、远的生产、经营、使用机构进行抽样,以获得全面、真实的产品质量状况信息。
