基于代谢组学和转录组学的不同生长年限下银杏萜类生物合成关键基因表达分析
2022-02-23刘志强崎1江美芳
刘志强,高 崎1, ,李 航,江美芳,陈 冉
基于代谢组学和转录组学的不同生长年限下银杏萜类生物合成关键基因表达分析
刘志强2,高 崎1, 2*,李 航2,江美芳2,陈 冉2
1. 上海中医药大学中药学院,上海 201203 2. 上海上药杏灵科技药业股份有限公司,上海 201703
以不同发育阶段不同树龄的银杏叶(银杏幼树叶,多年生银杏树叶)为对象,分析次生代谢物变化规律,测定黄酮及萜内酯含量,分析萜类生物合成的通路和关键基因表达,为提高银杏萜内酯产量提供分子生药学数据。采用液相色谱-质谱联用(LC-MS)技术,并进行高通量转录组学测序(RNA-seq),从差异表达基因中寻找次生代谢物生物合成的关联酶基因。代谢数据表明,不同树龄,不同发育阶段的银杏叶次生代谢物明显不同,黄酮类成分,老树叶片与幼树叶4~7月含量均呈下降趋势;同发育阶段,幼树叶含量高于老树叶片含量;萜内酯类成分,老树叶片4~7月含量略微呈上升趋势,幼树叶略微呈缓降趋势;同发育阶段,幼树叶含量高于老树叶片含量。转录组分析出萌发期,老树叶片与幼树叶片生长状态相似,5~7月老树叶与幼树叶基因表达发生较大变化。筛选出49条与萜类合成有关的候选基因,分析后发现甲羟戊酸途径(mevalonate pathway,MVA)中老树叶表达高于幼树叶;甲基赤藻糖醇磷酸途径(methylerythritol 4-phosphate pathway,MEP)中幼树叶表达高于老树叶。幼树叶比老树叶药用活性成分含量更高,适合作为药材。银杏叶内萜类合成途径可能主要依赖于MEP途径,且相关基因表达量与代谢成分相互证明。
银杏;测序;转录组;代谢组;萜类
银杏L.又名白果树,为银杏科银杏属的单科单属落叶乔木。银杏作为传统中药,具有抗氧化、抗凋亡、改善脑血流、抑制血小板活性等多种药理作用[1],可用于治疗脑卒中、脑梗死、冠心病稳定型心绞痛等疾病的治疗[2-3]。《中国药典》2020年版规定,银杏内酯和银杏黄酮为银杏叶提取物的主要药用成分,其中黄酮醇苷质量分数不少于24%,萜内酯不少于6%[4]。随着银杏叶提取物制剂的广泛使用,如何提高银杏药用活性成分的含量成为一个新的问题。一般而言,植物次生代谢物的积累与发育阶段有着密切联系,研究银杏主要次生代谢物的变化,为其生产实践提供理论依据。
目前,有关银杏的基因研究也伴随着测序技术的发展也在被广泛的开展。2016年完成了银杏的基因组测序,为银杏转录组测序提供了可参考基因,这使得银杏次生代谢物生物合成的研究变得更为便利,特别是涉及到黄酮醇苷的类黄酮生物合成通路以及相关的功能基因都被频繁报道[5]。本实验旨在运用代谢组数据结合转录测序结果,采用新型分析软件与更为科学的算法对不同树龄不同生长阶段的银杏叶进行比较分析,筛选银杏叶萜类生物合成的关键表达基因,为阐述其生物合成途径提供依据,为银杏叶种植采摘提供理论数据。
1 材料
银杏叶样品采集自四川省都江堰市申都中药有限公司种植石羊村种植基地(N30°5′40″,E103°41′10″),根据基地实验记录数据分别于2019年4月下旬、2019年5月下旬、2019年6月下旬、2019年7月下旬选取2年生幼树(Y4~7)和20年生老树(L4~7)进行采摘,以液氮速冻后放于−80 ℃保存,用于总RNA提取。为保证采取样品的一致性,采集相同地点银杏叶,干燥后用作化学成分分析。每份样品设置3个生物学重复。对照品信息见表1。
表1 对照品收集信息
Table 1 Reference collection information
化合物CAS批号厂家 奎宁酸77-95-2K29D9B77039上海源叶生物科技有限公司 原儿茶酸99-50-3H21J9Z64031上海源叶生物科技有限公司 没食子儿茶素970-74-11297/17878上海诗丹德标准技术服务有限公司 白果内酯33570-04-6P08J9F52398上海源叶生物科技有限公司 表儿茶素490-46-0C20N6Q5882上海源叶生物科技有限公司 银杏内酯J107438-79-9D29J9G53845上海源叶生物科技有限公司 银杏内酯C15291-76-6C28S6G3986上海源叶生物科技有限公司 3-O-β-D-吡喃葡糖基槲皮素482-35-9P25J9F65872上海源叶生物科技有限公司 3-O-[α-L-吡喃鼠李糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基山柰酚55804-74-58257上海诗丹德标准技术服务有限公司 芦丁153-18-4Y16M9S61523上海源叶生物科技有限公司 银杏内酯A15291-75-5W25A7K13730上海源叶生物科技有限公司 3-O-[α-L-吡喃鼠李糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡糖基异鼠李素104472-68-6Y14S8H43976上海源叶生物科技有限公司 银杏内酯B15291-77-7D15D8G50608上海源叶生物科技有限公司 3-O-[β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-槲皮素143016-74-48301上海诗丹德标准技术服务有限公司 3-O-β-D-吡喃葡萄糖基山柰酚480-10-4Y19M8H36474上海源叶生物科技有限公司 3-O-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基山柰酚17650-84-9Y15N8H48277上海源叶生物科技有限公司 3-O-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡糖基异鼠李素55033-90-45771上海诗丹德标准技术服务有限公司 3-O-[β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-异鼠李素604-80-8S08A8D33447上海源叶生物科技有限公司 3-O-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基丁香亭53430-50-58260上海诗丹德标准技术服务有限公司 3-O-[β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-山柰酚142451-65-88308上海诗丹德标准技术服务有限公司 3-O-[6-O-香豆酰基-β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-槲皮素143061-65-88244上海诗丹德标准技术服务有限公司 3-O-[6-O-香豆酰基-β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-山柰酚111957-48-38258上海诗丹德标准技术服务有限公司 木犀草素491-70-32226/17876上海诗丹德标准技术服务有限公司 芹菜素520-36-5404/17869上海诗丹德标准技术服务有限公司 白果素521-32-4Y15J9L63710上海源叶生物科技有限公司 异银杏素548-19-6Y10N8Y47776上海源叶生物科技有限公司 金松双黄酮521-34-6P03M9F55041上海源叶生物科技有限公司 银杏酸(C13:0)20261-38-5P11D8F50448上海源叶生物科技有限公司 银杏酸(C15:1)22910-60-7Y24M9H57091上海源叶生物科技有限公司 银杏酸(C17:1)111047-30-4Y23M9H62018上海源叶生物科技有限公司
2 方法
2.1 LC-MS测定
2.1.1 样品制备 将采摘的样品烘干磨粉后精确称量各个时期样品粉末0.5 g,置具塞离心管中,加入50%甲醇10 mL,涡旋振荡1 min,超声提取15 min,再振荡1 min,离心(转速6000 r/min)10 min,分取上清液于25 mL量瓶中,重复上述操作1次,合并2次上清液,用50%甲醇定容至25 mL。
2.1.2 色谱条件[6]样品于Waters Acquity UPLC/Xevo G2-XS Q-TOF超高效液相色谱质谱联用仪进行测定,每个样品平行3针,保证平行实验。色谱柱为Waters Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm),柱温45 ℃,体积流量0.2 mL/min,进样体积1 μL。流动相为0.2 mol/L醋酸铵溶液(含0.1%甲酸)(A)-乙腈(B),梯度洗脱:0~60 min,98%~2% A;60~70 min,2% A;70~71 min,2%~98% A;71~75 min,98% A。
2.1.3 质谱条件 负离子模式,Sensitivity模式(分辨率为30 000);毛细管电压−2.5 kV;样品锥孔电压40 V;源偏移电压80 V;源温120 ℃;脱溶剂温度450 ℃;锥孔气50 L/h;脱溶剂气体积流量800 L/h;雾化气压力600 kPa;质量数校正范围/50~1000,校正溶液为0.5 mmol/L甲酸钠溶液,体积流量20 μL/min;实时校正lock spray为1 ng/μL的亮氨酸脑啡肽溶液,/554.2615;数据采集方法为MSE,数据类型为continuum,能量范围10~40 V,扫描时间为0.2 s。采用Waters UNIFI软件进行相关分析。
2.1.4 方法学考察 按照参考文献方法[6],取银杏叶样品进行精密度、稳定性、重复性试验,结果RSD均小于3%,表明该方法稳定可靠。
2.1.5 数据分析 通过在国内外数据库,包括CNKI数据库、PubMed、ScienceDirect、Web of Science等,以“银杏酮酯”“银杏叶提取物”“银杏”“银杏叶”“银杏花”“银杏果”“Ginkgo biloba extract50”“Ginkgo biloba extract”“Ginkgo”“Ginkgo biloba”“Ginkgo biloba flowers”“Ginkgo nut”为关键字检索相关文献,汇总银杏叶中可能的化学成分,将化学成分名称、分子式导入到UNIFI软件(Waters公司)建立银杏酮酯化学成分数据库。将样本质谱分析所得的原始数据导入配套的UNIFI工作站中,根据建立的化学成分数据库,提取所有离子,并对提取离子排除分析,通过对照品对照,进一步确证化合物。
2.2 RNA提取与文库构建
使用TRIzol®试剂(植物组织RNA纯化试剂)按照制造商说明(Invitrogen,Carlsbard,CA,美国)从银杏叶组织中提取总RNA,使用DNase I (TaKara)去除基因组DNA。然后用2100生物分析仪(安捷伦科技公司,圣克拉拉,美国)测定总RNA质量的完整性和纯度,并使用rd-2000(NanoDrop Thermo Scientific,Wilmington,DE,美国)进行定量。符合文库构建要求(260/280=1.8~2.2,260/230≥2.0,RIN≥8.0,28S:18S≥1.0,>2 μg)。利用Illumina TruSeqTM RNA样品制备试剂盒(San Diego,CA)制备银杏双叶RNA-seq转录组文库后,在Illumina Hiseq xten测序仪(Illumina, San Diego,CA)上进行2×150 bp的双端测序,每个样本选择3份进行生物学重复。
2.3 转录组数据与参考基因比对及转录本组装
通过使用SeqPrep(https://github.com/ jstjohn/SeqPrep)和Sickle(https://github.com/najoshi/ sickle)对大量的raw reads进行了裁剪和质量控制得到clean data,用HISAT2(http://ccb.jhu.edu/ software/hisat2/index.shtml)与银杏基因组(http://gigadb.org/dataset/100209)进行序列比对[7],得到mapped reads并进行质量评估。
基于所选参考基因组序列,使用StringTie(http://ccb.jhu.edu/software/stringtie/)软件对Mapped Reads进行拼接,并与原有的基因组注释信息进行比较,寻找原来未被注释的转录区,发掘该物种的新转录本和新基因,从而补充和完善原有的基因组注释信息[8-9]。
2.4 基因功能分析及表达差异基因筛选
将获得的所有Unigene与NCBI蛋白数据库nonredundant(NR)进行比对,以值<1×10−5为阈值,通过BLAST算法进行功能注释[10]。同时,将Unigene在Swiss-Prot、Pfam、COG、GO和KEGG各大数据库的功能注释进行汇总,分析预测其功能分类和参与的生物学途径。
为了识别2个不同样本间的差异表达基因(differential expression genes,DEGs),使用TPM法衡量每个转录本表达水平。借用RSEM(http:// deweylab.biostat.wisc.edu/rsem/)对基因进行了定量分析[11]。利用R统计软件包EdgeR(http://www. bioconductor.org/packages/2.12/bioc/html/edgeR.html)进行差异表达分析。
此外,以Bonferroni为多重验证法,以值≤0.01为阈值,用Goatools(https://github.com/ tanghaibao/Goatools)和KOBAS(http://kobas.cbi.pku. edu.cn/home.do)进行了GO功能富集和KEGG通路分析[12-13]。
3 结果与分析
3.1 LC-MS数据分析
3.1.1 银杏叶化学成分分析 为了对银杏叶的化学成分进行研究,采用50%甲醇溶液超声提取的方法,分别获得不同年限不同发育阶段银杏叶除银杏双黄酮及烷基酚类以外的其余成分。通过UPLC Q-TOF/MS分析得到银杏叶总离子流图(TIC),见图1。根据总离子流图所得到的化合物精确相对分子质量、二级碎片信息,与对照品和实验室构建的数据库比对,共鉴定出55个化合物,其中30个已与对照品比对,结果见表2。
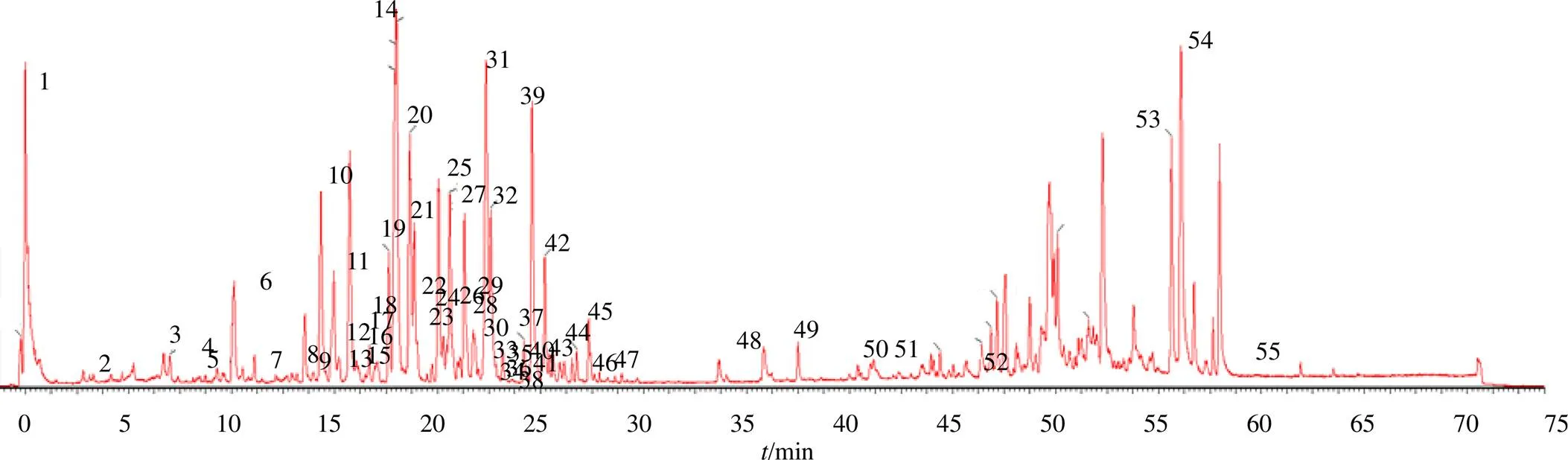
图1 银杏叶总离子流图
表2 银杏叶化合物质谱信息
Table 2 Mass spectrum information of leaves compounds
峰号化合物名称分类分子式m/z[M-H]−误差(×10−6)tR/min二级碎片 1*奎宁酸有机酸类C7H12O6191.055 0−2.81.25173.05 2*原儿茶酸有机酸类C7H6O4153.018 5−2.14.97135.03, 109.03 3*没食子儿茶素黄烷醇类C15H14O7305.065 2−2.07.96243.03, 177.02, 137.02, 125.02, 109.03 4*儿茶素黄烷醇类C15H14O6289.070 72.08.25137.02, 125.02 53-O-β-D-吡喃葡萄糖基二氢山柰酚黄酮类C21H22O11449.107 808.73287.06, 259.06 6*白果内酯萜内酯类C15H18O8325.091 8−0.611.36237.11, 193.12, 163.11 7*表儿茶素黄烷醇类C15H14O6289.070 6−0.411.80273.08, 137.02, 123.04 83-O-[β-D-吡喃葡萄糖 (1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基槲皮素黄酮类C33H40O21771.196 5−0.614.43609.14,462.08, 301.03 9*银杏内酯J萜内酯类C20H24O10423.128 1−0.614.81379.14, 367.14, 349.09 10*银杏内酯C萜内酯类C20H24O11439.123 4−0.115.58411.13, 383.13, 321.13 113-O-[β-D-吡喃葡萄糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基山柰酚黄酮类C33H40O20755.202 3−0.616.03593.15, 463.09, 301.03 123-O-β-D-吡喃葡萄糖杨梅黄酮黄酮类C21H20O13479.082 5−1.116.09316.02, 287.02, 271.02 13*3-O-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基杨梅黄酮黄酮类C27H30O17625.140 31.416.22316.02 143-O-[β-D-吡喃葡萄糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡萄糖基山柰酚同分异构体黄酮类C33H40O20755.201 9−0.316.99593.15, 463.09, 301.03 153-O-[6-O-香豆酰基-β-D-吡喃葡萄糖基(1′′→2′′)]-α-L-吡喃鼠李糖-7-O-β-D-吡喃葡糖基槲皮素黄酮类C42H46O23917.233 3−1.317.94755.18, 609.14, 300.03 16*3-O-β-D-吡喃葡糖基槲皮素黄酮类C21H20O12463.087 3−0.418.86300.03, 271.02, 255.03 173-O-β-D-吡喃鼠李糖基槲皮素黄酮类C21H20O11447.092 0−0.418.86285.04, 271.09, 151.00 18*3-O-[α-L-吡喃鼠李糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′) ]-β-D-吡喃葡萄糖基山柰酚黄酮类C33H40O19739.207 20.318.88447.09, 284.03 19*芦丁黄酮类C27H30O16609.145 8019.18463.09, 300.03, 271.02 20*银杏内酯A萜内酯类C20H24O9407.133 3−0.619.27379.14, 351.15, 319.16 21*3-O-[α-L-吡喃鼠李糖(1′′→2′′)]-[α-L-吡喃鼠李糖(1′′→6′′)]-β-D-吡喃葡糖基异鼠李素黄酮类C34H42O20769.218 1−0.519.30447.11, 284.05
*已与对照品比对鉴定
*identified by comparison with the reference
3.1.2 多元统计分析 为了分析银杏叶不同发育阶段代谢产物组的动态变化,对不同生长年限不同发育阶段的银杏叶进行非监督模式识别的主成分分析(principal component analysis,PCA)图2分别为多年生老树叶与幼苗叶片;多年生老树叶不同生长阶段;幼苗叶不同生长阶段的PCA分析散点图[14]。图2-A显示出多年生老树叶紧密分布在PC1的负半轴,而幼苗叶分布在正半轴;图2-B、C表明多年生老树叶与幼苗叶4~7月逐渐从PC1负半轴过渡至PC1正半轴。结果表明,无论是树龄还是生长阶段对于银杏叶的代谢物质组成均会产生较大变化。为了进一步分析不同生长年限不同发育阶段银杏叶黄酮醇与萜内酯类成分的含量变化,通过半定量方法对其进行相对含量测定。图3可明显看出各类成分的变化趋势,黄酮类成分,老树叶片与幼树叶4~7月含量均呈下降趋势;同时期内,幼树叶含量高于老树叶片量。萜内酯类成分,大树叶片4~7月含量略微呈上升势,幼树叶略微呈缓降趋势;同时期内,幼树叶含量高于老树叶片量。

A-老树与幼树整体成分差异 B-幼树不同生长阶段成分差异 C-老树不同生长阶段成分差异,字母前数字代表月份
3.2 转录转录组数据分析注释分析
3.2.1 银杏转录测序质量分析及注释情况 通过Illumina Hiseq xten测序平台测序,最后处理得到的8组样品数据统计如表3所示。各样品碱基质量超过30的比例均在90%以上,且GC含量均在50%左右,测序组装效果好;与银杏参考基因进行序列比对,对比效率均在90%以上,测序精度高。
组装拼接后共得39 137条Unigene,将转录组组装获得的所有基因和转录本与6大数据库(NR、Swiss-Prot、Pfam、COG、GO和KEGG)进行比对。从图4可以看出NR数据库可注释到31 936条;Swiss-Prot数据库可注释到25 235条;Pfam数据库可注释到21 561条;COG数据库可注释到28 922条;GO数据库可注释到27 503条;KEGG数据库可注释到13 504条;共注释到32 358条,占Unigene 总数的82.68%。
3.2.2 样本间表达量分析 通过基因的表达矩阵,可验证实验设计的合理性,了解样本间特别是生物学重复间的相关性。图5可以表明L4和Y4,Y5和Y6、Y7,L5和L6、L7的基因表达相关性更高。说明在4月树叶处于萌发期,老树叶片与幼树叶片生长状态相似,5~7月老树叶与幼树叶基因表达发生较大变化。
3.3 差异表达基因表达量比较及KEGG通路注释分析
选取不同树龄差异最大的L7与Y7;老树基因表达差异最大的L4与L7;幼树叶基因表达差异最大的Y4和Y5进行差异分析。发现L7vsY7存在3811条显著差异基因,上升2068条,下降1743条;发现L4vsL7存在4836条显著差异基因,上升2527条,下降2309条;发现Y4vsY5存在3060条显著差异基因,上升1510条,下降1550条,结果如图6所示。将上述组别的差异表达基因分别进行KEGG通路注释,由于银杏叶中的活性成分为萜内酯和黄酮醇类,其中黄酮醇类成分为次级代谢产物,因此主要分析“其他次级代谢产物生物合成(biosynthesis of other secondary metabolites)”和“萜类和聚酮类化合物的代谢(metabolism of terpenoidsand polkketides)”。为了更清楚的了解所关注的黄酮类成分及萜内酯类成分与差异表达基. 因是否在有关通路上存在相关性,对3组差异基因再进行KEGG富集分析,筛选出flavonoid biosynthesis和terpenoid backbone biosynthesis 2条代谢通路来分析相关性(表4)。从结果可以看出幼树叶在不同发育阶段表达基因差异最大的Y4和Y5在黄酮和萜内酯的生物合成上均不具有显著性富集;老树叶在不同发育阶段表达基因差异最大的L4与L7在黄酮的生物合成上不具有显著性富集,在萜内酯的生物合成上存在显著性富集;不同树龄表达基因差异最大的L7与Y7在黄酮和萜内酯的生物合成上均具有显著性富集。根据KEGG通路注释结果图7可以看出,Y4Y5、L4L7、L7Y7的差异表达基因都在这2类代谢途径中得到了注释。
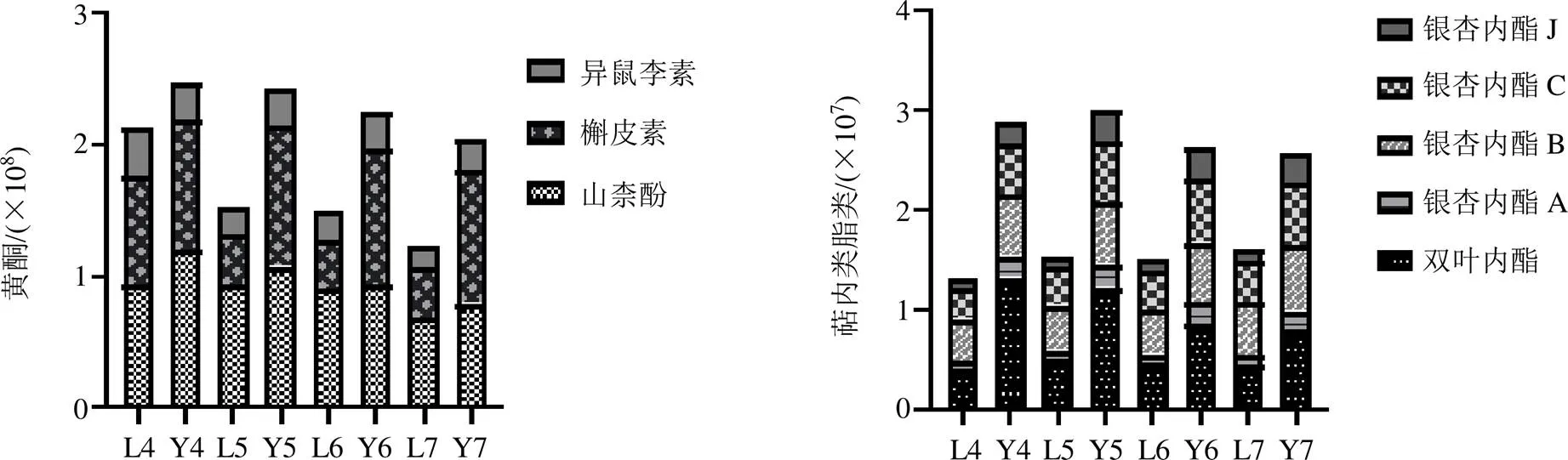
图3 不同发育阶段不同树龄银杏黄酮类与银杏萜内酯类成分相对含量
表3 转录组测序数据质量分析
Table 3 Transcriptome sequencing data quality analysis
编号 clean readsclean bases误差率/%Q20/%Q30/%GC/%总mapped数(占比/%)multiple mapped数(占比/%)Uniquely mapped数(占比/%) L45889750088291619030.023498.6795.7446.2657 040 427(96.85)5 151 043(8.75)51 889 384(88.10) L55276008878450518900.023498.6595.7646.8450 411 574(95.55)8 014 104(15.19)42 397 470(80.36) L65711333885442949530.023498.6895.7946.9854 453 219(95.34)7 026 826(12.30)47 426 393(83.04) L74251996262817080550.024598.2394.6745.1040 438 620(95.11)3 486 004(8.20)36 952 616(86.91) Y45015673675034781590.023398.7495.9046.0048 811 805(97.32)3 122 339(6.23)45 689 466(91.09) Y54677433669910404650.023198.7996.0545.9045 382 803(97.03)3 295 340(7.05)42 087 463(89.98) Y65848607687201654480.023398.7195.8446.6956 448 409(96.52)4 790 414(8.19)51 657 995(88.33) Y74743437069591274450.024298.3494.9846.2445 389 674(95.69)3 925 925(8.28)41 463 749(87.41)

图4 功能注释统计图

图5 表达量分析

图6 差异表达基因Venn图
表4 差异基因与通路相关性
Table 4 Correlation between different genes and pathways
组别黄酮生物合成途径萜类骨架生物合成途径 Y4vsY50.6400.230 L4vsL70.330 0.036* L7vsY7 0.025* 0.021*
表中数值表示差异基因和黄酮、萜类骨架生物合成途径的相关性,*<0.05即差异显著,**<0.01即差异极显著
In the table represents the difference between genes and flavonoid and terpene biosynthesis of skeleton relationship between the way,*< 0.05 says significant difference,**< 0.01 says that the difference is significant
3.4 银杏叶中萜类化合物生物合成相关基因表达分析
对KEGG数据库黄酮生物合成(map00941)和萜类生物合成(map00900)2条途径注释分析,发现相关蛋白均被多条Unigen注释到。注释情况见表5。
有关银杏黄酮类生物合成相关基因表达分析已经被报道[5],这里着重对银杏萜类成分生物合成相关表达基因进行分析。根据药典记载,银杏药用活性成分主要为总黄酮醇苷和萜内酯2类。其中,萜内酯为银杏特有成分,也是银杏叶提取物的质量控制检测标准。

图7 差异基因KEGG富集分析统计图
表5 萜类与黄酮类生物合成相关基因注释
Table 5 Comments on genes related to biosynthesis of terpenoids and flavonoids
通路基因名称中文名称缩写注释到的Unigene数 萜类MVA合成途径acetyl-CoA C-acetyltransferase乙酰CoA酰基转移酶AACT 5 hydroxymethylglutaryl-CoA reductase羟基甲基戊二酰-CoA还原酶HMGCR25 mevalonate kinase甲羟戊酸激酶MK 1 phosphomevalonate kinase磷酸甲羟戊酸激酶PMVK 4 diphosphomevalonate decarboxylase二磷酸甲羟戊酸脱羧酶MVD 2 萜类MEP合成途径1-deoxy-D-xylulose-5-phosphate synthase1-脱氧-D-木桐糖-5-磷酸合酶DXS 6 1-deoxy-D-xylulose-5-phosphate reductoisomerase1-脱氧-D-木酮糖-5-磷酸还原异构酶DXR 1 2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase2-C-甲基-D-赤藓糖醇4-磷酸胞苷酰转移酶CMS 1 4-diphosphocytidyl-2-C-methyl-D-erythritol kinase4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶CMK 2 2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶MCS 2 黄酮类合成途径chalcone synthase查耳酮合成酶CHS17 flavonol synthase黄酮醇合酶FLS19 flavanone 3-dioxygenase黄烷酮3-羟化酶F3H 8 chalcone isomerase查耳酮异构酶CHI 3 flavonoid 3′,5′'-hydroxylase类黄酮3′,5′-羟化酶F3'5'H 8 flavonoid 3′-hydroxylase类黄酮3′-羟化酶F3'H 5 dihydroflavonol 4-reductase二氢黄酮醇4-还原酶DFR19 anthocyanidin synthase花色素合成酶ANS 7 anthocyanidin reductase花色素还原酶ANR11
萜类合成通路主要分为MVA及MEP,通过对萜类合成通路基因进行筛选注释,发现在这2条通路上的关键基因均被注释,且存在显著性差异。本着转录研究为基因动态表达的原则,为了寻找银杏萜类合成的规律,本实验对不同树龄,不同生长阶段的银杏在这2条通路上的多个关键基因表达进行比较分析。发现这些基因虽然大多都被多个Unigene所注释,但Unigene其表达模式趋于一致,故选取表达量最高的Unigene作为丰度衡量。
图8表现出,MVA途径中、、3个基因表达量超过200,且均为老树,、表达较低。从同一发育阶段比较来看,老树4~7月均高于幼树叶;从不同发育阶段来看,老树呈上升趋势,在6、7月表达高于4、5月;幼树叶则出现缓降趋势,6、7月表达低于4、5月。MEP途径中DXR和MCS表达最高,从同一发育阶段来看,幼树叶4~7月表达均高于老树;从不同发育阶段看,幼树叶呈缓降趋势,老树呈上升趋势。
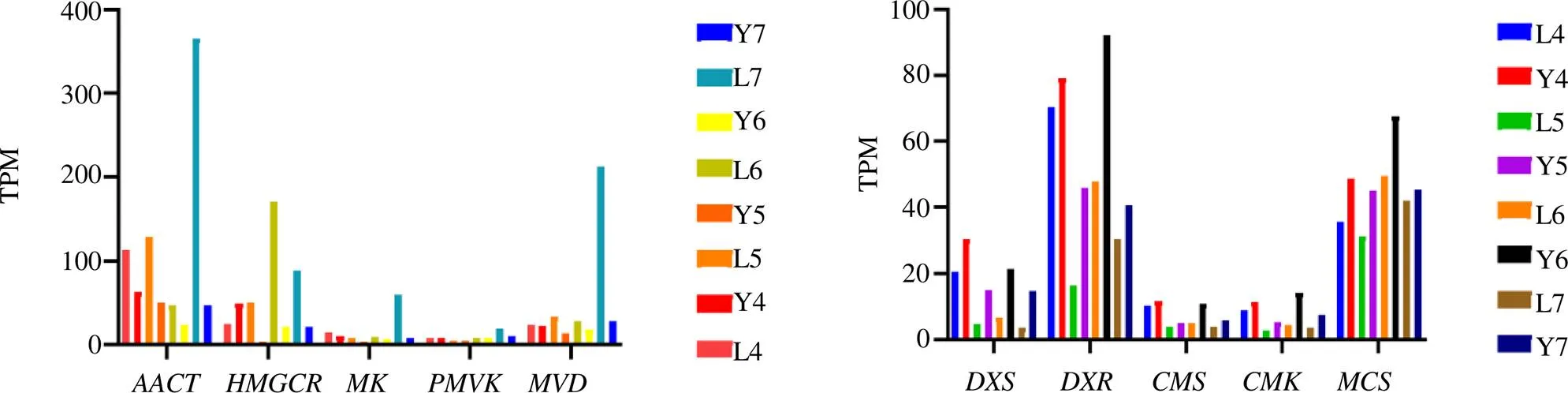
图8 萜类生物合成途径功能基因表达量分析
4 讨论
4.1 不同树龄不同发育阶段银杏叶活性成分代谢差异
通过对不同树龄,不同生长阶段的银杏叶次级代谢物进行PCA分析,发现无论是树龄差异还是生长阶段的不同都会产生明显的差别。银杏叶提取物的药用活性成分主要是黄酮醇苷及银杏内酯2大类次生代谢物,通过对黄酮醇苷(槲皮素、异鼠李素、山柰素)和银杏内酯含量测定,发现幼树叶中2类成分均明显高于老树叶含量,这佐证了选取银杏幼树叶入药的合理性,由于采摘后重新生长的叶片代谢积累会发生较大改变,缺少后续积累数据,对于7月是否为最佳采摘时期有待进一步研究。
4.2 银杏萜类生物合成的关键基因表达
本次转录测序检测到表达基因共39 137个,其中已知基因33 663个,新基因5474个;表达转录本共59 312个,其中已知转录本31 947个,新转录本27 365个。根据基因表达分析发现幼树叶比老树叶代谢更为旺盛,幼树每个月整体基因表达都具有显著性差异,老树叶经历4个月的生长后才表现出整体基因表达差异。经过KEGG富集分析发现与生长阶段这一因素相比,树龄的差异导致银杏黄酮类和萜类的差异更为明显,这也与代谢成分测定的结果相吻合。通过KEGG通路注释,筛选出49条与银杏萜类生物合成的相关基因,并进一步分析了这些基因的表达状况。结果表明,银杏叶萜类合成可能更依赖于MEP通路,MEP上的结构基因表达模式与代谢含量结果相对应,特别是DXS的表达模式几乎与银杏内酯变化一致。DXS可能是银杏内酯生物合成的主要限速基因。利用基因工程技术,提高DXS的表达,从而提升银杏内酯的量是具有一定的可行性,这也是本研究的下一步工作。
利益冲突 所有作者均声明不存在利益冲突
[1] 李思佳, 耿剑亮, 张悦, 等. 银杏药理作用研究进展 [J]. 药物评价研究, 2017, 40(6): 731-741.
[2] 李春雷, 张峰. 维生素、叶酸联合银杏叶提取物对老年脑卒中患者认知功能影响研究 [J]. 中国生化药物杂志, 2015, 35(8): 107-109.
[3] 张鹏飞, 廖丽君, 谭玉萍. 银杏叶提取物治疗慢性阻塞性肺疾病作用机制的研究进展 [J]. 中国全科医学, 2017, 20(15): 1906-1910.
[4] 中国药典 [S]. 四部. 2015: 1491-1493.
[5] 刘伟, 王俊燚, 李萌, 等. 基于转录组测序的银杏类黄酮生物合成关键基因表达分析 [J]. 中草药, 2018, 49(23): 5633-5639.
[6] 何厚洪, 杜昕, 金辉辉, 等. 银杏叶提取物HPLC指纹图谱研究及共有峰的LC-MS鉴定 [J]. 药物分析杂志, 2017, 37(6): 1107-1112.
[7] Grabherr M G, Haas B J, Yassour M,. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J]., 2011, 29(7): 644-652.
[8] 鲁光辉, 李新峰, 冯亮, 等. 银杏内酯B对癫痫大鼠血脑屏障保护作用的研究 [J]. 药物评价研究, 2020, 43(4): 765-772.
[9] Conesa A, Götz S, García-Gómez J M,. Blast2GO: A universal tool for annotation, visualization and analysis in functional genomics research [J]., 2005, 21(18): 3674-3676.
[10] Kanehisa M, Goto S. KEGG: Kyoto encyclopedia of genes and genomes [J]., 2000, 28(1): 27-30.
[11] Li B, Dewey C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome [J]., 2011, 12: 323.
[12] Robinson M D, McCarthy D J, Smyth G K. edgeR: A bioconductor package for differential expression analysis of digital gene expression data [J]., 2010, 26(1): 139-140.
[13] Xie C, Mao X Z, Huang J J,. KOBAS 2.0: A web server for annotation and identification of enriched pathways and diseases [J]., 2011, 39: W316-W322.
[14] 秦伟瀚, 花雷, 郭延垒, 等. UPLC-Q-TOF-MS结合代谢组学分析冬虫夏草不同部位的差异性 [J]. 中国实验方剂学杂志, 2018, 24(21): 69-76.
Expression analysis of key genes in terpenoid biosynthesis ofunder different growth years based on metabolomics and transcriptome
LIU Zhi-qiang1, GAO Qi1, 2, LI Hang2, JIANG Mei-fang2, CHEN Ran2
1. School of Pharmacy, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. Shanghai Xingling Science and Technology Pharmaceutical Co., Ltd., Shanghai 201703, China
leaves (leaves, perennialleaves) at different development stages and ages were used as objects to determine the content of flavonoids and terpene lactones in their secondary metabolites, to analyze the pathways of terpene biosynthesis and the expression of key genes, and to provide molecular biopharmaceutical data for improving the yield of ginkgo terpenolactone.Based on liquid chromatography-mass spectrometry (LC-MS) metabolomic technology, and high-throughput transcriptomics sequencing (RNA-seq) to find the related enzymes of secondary metabolite biosynthesis from differentially expressed genes.It was found that the secondary metabolites ofleaves at different ages and developmental stages were significantly different in metabolomics. Firstly, the content of flavonoids, both in the tree leaves and nursery leaves, was presented by a decreasing trend from April to July. While at the same developmental stage, the content in nursery leaves was higher than that in tree leaves. Secondly, the content of terpene lactones in tree leaves was presented by a slightly increasing trend from April to July, however, a slightly decreasing trend in nursery leaves. While at the same development stage, the content in nursery leaves was higher than that in tree leaves. Then analyzed in the transcriptome, the growth status of old leaves was similar with the nursery leaves in germination stage, and there was a relatively large change in the gene expressions of old leaves and nursery leaves in May, June and July. After screening out 49 candidate genes related to terpenoid synthesis and analyzing them, it was found that the expression of tree leaves in mevalonate (MVA) pathway pathway was higher than that in nursery leaves; The later was higher than the former in methylerythritol 4-phosphate (MEP) pathway.The nursery leaves have a higher content of medicinal active ingredients than tree leaves, which are suitable as medicinal materials. The terpenoid synthesis pathway inleaves may mainly depend on the MEP pathway, and the expression levels of related genes and metabolic components are mutually proven.
L.; transcription; sequencing; metabolic group; terpenoids
R286.12
A
0253 - 2670(2022)04 - 1138 - 10
10.7501/j.issn.0253-2670.2022.04.022
2021-08-06
上海市国资委企业技术创新和能级提升项目(2018010)
刘志强,男,硕士研究生,研究方向为中药创新及其产业化发展。E-mail: 546895057@qq.com
高 崎,男,硕士生导师,教授,研究方向为中药创新及其产业化发展。E-mail: gaoqi@xingling.com.cn
[责任编辑 时圣明]
