基于CX3CL1介导的炎症反应研究淫羊藿苷对缺氧诱导的肺动脉高压小鼠的作用
2022-02-23罗云梅李铭铭熊乙林李利生
罗云梅,李铭铭, 3#,熊乙林,李利生
基于CX3CL1介导的炎症反应研究淫羊藿苷对缺氧诱导的肺动脉高压小鼠的作用
罗云梅1, 2,李铭铭1, 2, 3#,熊乙林1, 2,李利生1, 2*
1. 遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563000 2. 遵义医科大学 贵州省基础药理重点实验室 药学院药理学教研室,贵州 遵义 563000 3. 遵义医科大学第三附属医院(遵义市第一人民医院)药剂科,贵州 遵义 563000
研究淫羊藿苷改善缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)作用与趋化因子C-X3-C基元配体1(chemokine C-X3-C motif ligand 1,CX3CL1)介导的炎症反应的关系。将40只C57BL/6J雄性野生型(wide type,WT)小鼠随机分为对照组、WT模型组和WT+淫羊藿苷(10、20 mg/kg)组,20只雄性CX3CL1−/−小鼠分为CX3CL1−/−模型组和CX3CL1−/−+淫羊藿苷(20 mg/kg)组。除对照组外,各组均于含氧量为10%的低氧环境中连续饲养21 d,于低氧饲养7 d后ig淫羊藿苷2周。采用小动物超声仪检测小鼠肺动脉血流速度和右心室血流动力学,测量右心室肥厚指数(right ventricular hypertrophy index,RVHI);采用苏木素-伊红(HE)和Masson染色观察小鼠肺小动脉重构情况;采用ELISA法检测小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)水平;采用Western blotting检测小鼠肺组织CX3CL1和核因子-κB(nuclear factor-κB,NF-κB)通路相关蛋白表达情况。与对照组相比,WT模型组小鼠肺动脉血流速度明显降低(<0.05),RVHI显著增大(<0.05),右心室收缩末期直径、收缩末期容积和每博输出量升高(<0.05),右心室短轴缩短率和射血分数降低(<0.05),肺小动脉重构明显。与WT模型组相比,淫羊藿苷能够增加WT小鼠肺动脉血流速度(<0.05),降低RVHI、右心室收缩末期直径、收缩末期容积和每博输出量(<0.05),升高右心室短轴缩短率和射血分数(<0.05),肺小动脉重构明显改善,同时,淫羊藿苷降低血清IL-1β和TNF-α水平以及肺组织CX3CL1蛋白表达水平(<0.05),抑制NF-κB通路相关蛋白表达水平(<0.05)。与WT模型组相比,CX3CL1−/−模型组小鼠肺动脉血流速度、肺小动脉重构、右心室血流动力学均有改善(<0.05),血清IL-1β和TNF-α水平降低(<0.05)。敲除CX3CL1−/−后,淫羊藿苷(20 mg/kg)对HPH小鼠的改善作用减弱甚至消失。淫羊藿苷能够通过抑制CX3CL1介导的炎症反应改善小鼠HPH。
淫羊藿苷;趋化因子C-X3-C基元配体1;炎症;缺氧性肺动脉高压;小鼠
缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是由于肺泡广泛缺氧引起的以肺小动脉收缩、重构为病理特征的肺循环疾病,HPH病程中伴有持续的炎症反应[1-3]。趋化因子C-X3-C基元配体1(chemokine C-X3-C motif ligand 1,CX3CL1)是CX3C亚族里的唯一成员,包括溶解型和膜结合型,既有趋化性蛋白的功能也有细胞黏附分子的功能,HPH患者和模型动物血管内皮细胞CX3CL1及趋化因子C-X3-C基元受体1(chemokine C-X3-C motif receptor 1,CX3CR1)表达上调,且伴随巨噬细胞等炎症细胞的浸润,促进了HPH血管炎症[4-5];敲除CX3CR1可显著改善HPH模型的炎症反应和肺动脉平滑肌细胞增殖[6];在野百合碱诱导的肺动脉高压模型大鼠中,甾体类抗炎药地塞米松可通过下调肺组织和mRNA的表达,减少炎症细胞浸润,改善肺动脉重构[7],表明HPH与CX3CL1/CX3CR1有关。淫羊藿苷是淫羊藿的主要活性成分,具有益精气、坚筋骨、补腰膝、强心力之功效[8]。本课题组前期研究证实淫羊藿苷能够降低野百合碱诱导大鼠平均肺动脉压,改善小鼠HPH[9-10],但作用机制仍未阐明。本研究采用缺氧诱导野生型(wild type,WT)和CX3CL1−/−小鼠建立HPH模型,探究淫羊藿苷抗HPH的作用机制。
1 材料
1.1 动物
SPF级C57BL/6J雄性小鼠,8周龄,体质量20~25 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号SCXK(京)2016-0002;雄性CX3CL1−/−小鼠(8周龄,体质量20~25 g)由上海南方模式生物科技发展有限公司提供,生产许可证号SCXK(沪)2017-0010。所有小鼠均饲养于遵义医科大学基础药理教育部重点实验室SPF级动物实验室[使用许可证号SYXK(黔)2014-003],小鼠给予标准颗粒饲料喂养,自由进食进水。动物实验经遵义医科大学动物实验伦理委员会审查批准(批准号[2018]2-128)。
1.2 药品与试剂
淫羊藿苷(质量分数≥98.6%)购自南通飞宇生物科技有限公司;CX3CL1抗体、CX3CR1抗体、p65抗体、磷酸化p65(phosphorylated p65,p-p65)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自英国Abcam公司;磷酸化核因子-κB(nuclear factor-κB,NF-κB)抑制蛋白(phosphorylated inhibitor of NF-κB,p-IκB)抗体、IκB抗体购自美国Santa cruz公司;HRP标记的山羊抗兔IgG抗体、HRP标记的山羊抗小鼠IgG抗体、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;Masson染色试剂盒、牛血清白蛋白、山羊血清购自北京索莱宝科技有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自武汉华美生物工程有限公司。
1.3 仪器
Vevo 2100型小动物超声仪(加拿大Visualsonics公司);Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司);Chemi Dos Xps型电泳仪凝胶成像分体系统(美国Bio-Rad公司);TE2000-S型显微镜和图像分析系统(日本Nikon公司);GM-8000型低氧仓(日本Tokaihit公司)。
2 方法
2.1 分组、造模及给药
将40只C57BL/6J雄性小鼠随机分为对照组、WT模型组和WT+淫羊藿苷(10、20 mg/kg)组,每组10只;20只雄性CX3CL1−/−小鼠分为CX3CL1−/−模型组和CX3CL1−/−+淫羊藿苷(20 mg/kg)组,每组10只。所有小鼠同室饲养,对照组吸入空气,其余各组小鼠置于氧浓度为10%的低氧仓内,以钠石灰和无水氯化钙吸收多余的CO2和水蒸气,每天持续低氧24 h,连续3周。于低氧7 d后,各给药组ig淫羊藿苷(20 mL/kg),对照组和模型组ig等体积0.9%氯化钠溶液,1次/d,连续14 d。
2.2 小动物超声仪检测肺动脉血流速度与右心室血流动力学
末次给药2 h后,小鼠ip 10%水合氯醛(2 mg/kg)麻醉,脱毛,涂抹耦合剂,选择MS400探头(25~40 Hz),PW Mode检测小鼠肺动脉血流速度,M Mode检测右心室短轴缩短率、射血分数、每博输出量、收缩末期容积和收缩末期直径。
2.3 右心室肥厚指数(right ventricular hypertrophy index,RVHI)的测定
分离心脏,去除心耳,分离右心室壁,分别称定右心室壁、左心室与室间隔的质量,计算RVHI。
RVHI=右心室壁质量/(左心室质量+室间隔质量)
2.4 苏木素-伊红(HE)和Masson染色检测小鼠肺小血管病理变化
取小鼠右肺下叶肺组织,于4%多聚甲醛中固定后脱水,经石蜡包埋、切片、脱蜡、HE染色、封片等步骤,倒置显微镜下观察肺小动脉形态学改变并拍照。
切片经苏木素染色、盐酸乙醇分化、Masson蓝化液返蓝、丽春红染色、弱酸处理、磷钼酸清洗、苯胺蓝染色、无水乙醇脱水、二甲苯透明、封片等步骤,于倒置显微镜下观察肺小动脉纤维化情况并拍照。采用ImageJ软件计算管腔面积与血管截面积比值和胶原面积与血管截面积比值。
2.5 ELISA法检测小鼠血清IL-1β和TNF-α含量
小动物超声检测完成后,在麻醉状态下进行小鼠眶静脉采血,4 ℃、3000 r/min离心5 min,分离血清,按照ELISA试剂盒说明书检测血清IL-1β和TNF-α含量。
2.6 Western blotting法检测小鼠肺组织CX3CL1和NF-κB通路相关蛋白表达情况
取各组肺组织,加入RAPI裂解液匀浆提取蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度,95 ℃加热5 min使蛋白变性,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后分别加入CX3CL1、CX3CR1、p65、p-p65、p-IκB、IκB和GADPH抗体,4 ℃孵育12 h;加入HRP标记的山羊抗兔/小鼠IgG抗体,室温孵育2 h,加入ECL发光液,用凝胶成像系统曝光成像,采用Quantity One软件分析条带灰度。
2.7 数据统计与分析
3 结果
3.1 淫羊藿苷改善HPH小鼠肺动脉血流速度和右心室血流动力学异常
如图1所示,WT小鼠于10%氧浓度环境下持续低氧21 d后,肺动脉血流速度明显降低(<0.05),RVHI增加(<0.05),右心室血流动力学明显异常,右心室短轴缩短率、射血分数、每博输出量显著降低(<0.05),收缩末期容积和收缩末期直径增加(<0.05);与对照组相比,CX3CL1−/−模型组小鼠肺动脉血流速度、RVHI以及右心室血流动力学也明显异常,但其严重程度显著低于WT模型组;淫羊藿苷(10、20 mg/kg)可不同程度地缓解WT和CX3CL1−/−模型小鼠肺动脉血流速度和右心室血流动力学异常,但淫羊藿苷(20 mg/kg)对CX3CL1−/−模型小鼠各指标均未见显著影响,表明淫羊藿苷改善HPH呈CX3CL1相关性。

与对照组比较:▲P<0.05;与WT模型组比较:*P<0.05;与WT+淫羊藿苷(20 mgkg−1)组比较:#P<0.05
3.2 淫羊藿苷改善HPH小鼠肺血管重构
如图2所示,WT和CX3CL1−/−模型组小鼠肺血管管壁显著增厚、管腔变窄,并伴有大量胶原纤维沉积,但后者血管重构程度明显低于前者。淫羊藿苷能够减少血管壁厚度,缓解管腔变窄,增大管腔面积与血管截面积比值,并能减少肺血管周围胶原纤维的面积,减小胶原面积与血管截面积比值。但淫羊藿苷对CX3CL1−/−模型组小鼠改善效果不及WT模型组明显,CXC3L1−/−模型组和CX3CL1−/−+淫羊藿苷(20 mg/kg)组比较无显著差异。
3.3 淫羊藿苷降低HPH小鼠血清IL-1β和TNF-α水平
如图3所示,WT模型组小鼠血清IL-1β和TNF-α水平较对照组显著增高(<0.05),分别达11、14倍,CX3CL1敲除后IL-1β和TNF-α水平均显著降低(<0.05);给予淫羊藿苷后,WT小鼠IL-1β和TNF-α水平显著降低(<0.05)。对比淫羊藿苷处理的CX3CL1−/−与WT小鼠发现,淫羊藿苷(20 mg/kg)能够降低CX3CL1−/−小鼠血清IL-1β和TNF-α水平,但其降低幅度远小于WT小鼠。
3.4 淫羊藿苷降低HPH小鼠肺组织CX3CL1和NF-κB通路相关蛋白表达
如图4所示,WT模型组小鼠肺组织CX3CL1蛋白表达水平显著升高(<0.05),淫羊藿苷在缓解HPH小鼠病理改变的同时可降低CX3CL1蛋白表达水平,淫羊藿苷(20 mg/kg)组具有显著差异(<0.05)。WT模型组小鼠肺组织p-p65和p-IκB蛋白表达水平显著升高(<0.05),表明NF-κB信号通路被激活,敲除CX3CL1后显著抑制了NF-κB信号通路的激活(<0.05)。淫羊藿苷(10、20 mg/kg)对HPH小鼠肺组织p-p65和p-IκB蛋白表达水平具有抑制作用,但CXC3L1−/−模型组与CX3CL1−/−+淫羊藿苷(20 mg/kg)组无显著差异,表明淫羊藿苷可以抑制HPH小鼠NF-κB信号通路的激活,敲除CX3CL1后淫羊藿苷对NF-κB信号通路的抑制作用减弱。

A-HE染色 B-Masson染色 C-HE染色统计图 D-Masson染色统计图 与对照组比较:▲P<0.05;与WT模型组比较:*P<0.05;与WT+淫羊藿苷(20 mgkg−1)组比较:#P<0.05

与对照组比较:▲P<0.05;与WT模型组比较:*P<0.05;与WT+淫羊藿苷(20 mgkg−1)组比较:#P<0.05;与CX3CL1−/−模型组比较:■P<0.05
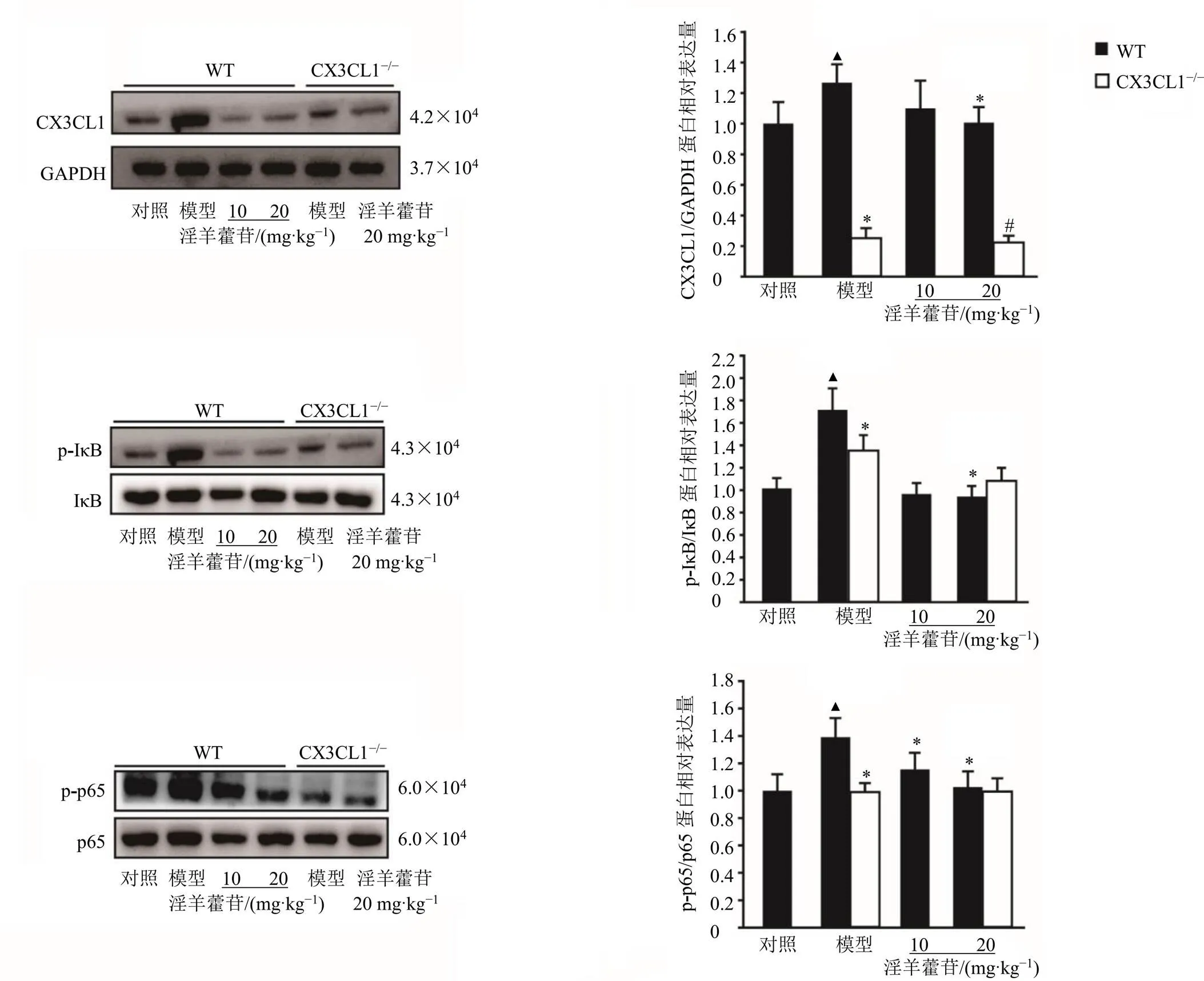
与对照组比较:▲P<0.05;与WT模型组比较:*P<0.05;与WT+淫羊藿苷(20 mgkg−1)组比较:#P<0.05
4 讨论
HPH是严重的肺循环疾病,肺动脉紧张性的进行性增高和肺动脉重构是其主要的病理基础,进行性增加的肺血管压力可加重右心室负荷和心力衰竭,最终导致死亡[11]。右心导管检查测定平均肺动脉压(mean pulmonary artery pressure,mPAP)≥25 mm Hg(1 mm Hg=133 Pa)是诊断肺动脉高压的金标准,但采用右心导管术直接测定小鼠mPAP十分困难,本研究采用小动物超声仪检测肺动脉血流速度和右心室血流动力学,并结合右心室肥厚情况对HPH成模情况进行综合分析,发现WT小鼠在含氧量为10%的低氧仓连续饲养21 d后肺小动脉管壁肥厚、管腔狭窄,肺动脉血流速度显著降低,表明肺动脉阻力增高,受此影响,右心室每博输出量、短轴缩短率和射血分数均显著降低,而右心室收缩末期直径和收缩末期容积显著增高,并导致了右心室压力负荷性的肥厚,提示HPH模型建立成功。
淫羊藿苷是淫羊藿的主要有效成分,药动学研究显示大鼠单次给药后1 h,肺组织淫羊藿苷含量最高(约为脑组织的5倍),其分布特点更适用于治疗肺部疾病[12]。近年来,本课题组就淫羊藿苷抗肺动脉高压作用开展了系列研究,证实淫羊藿苷能够显著改善野百合碱诱导的大鼠肺动脉高压,淫羊藿苷给药剂量为80 mg/kg时,mPAP由(53.5±6.7)mm Hg降低至(31.6±4.7)mm Hg,降幅达41%;模型大鼠的存活率显著增高,同时肺动脉重构特别是血管中膜即平滑肌层也得到改善,管壁与血管截面积比值平均值由49.9%降低至26.5%[9]。本研究采用HPH模型对淫羊藿苷改善肺动脉高压作用进行了重复验证,结果显示,淫羊藿苷能够改善HPH小鼠肺小动脉重构和右心室血流动力学异常,增加肺动脉血流速度,压力负荷性的右心室肥厚也明显缓解,进一步说明淫羊藿苷对HPH具有改善作用。
尽管肺动脉高压的发病机制并未完全阐明,但已有大量研究发现炎症反应是导致肺动脉重构的重要因素[13]。在HPH氧供应不足导致受损的内皮细胞释放大量的细胞因子和趋化因子入血或扩散到周边组织,与循环中的单核细胞或肺泡巨噬细胞表面的相应受体结合,将其募集到损伤部位,趋化因子CX3CL1及其受体CX3CR1在炎症细胞募集过程发挥重要作用[14]。致炎因素或炎症因子主要通过NF-κB信号通路上调CX3CL1的表达,同时,CX3CL1又是NF-κB信号通路的激活物,二者相互作用,迅速放大炎症反应[15]。CX3CL1是CX3C趋化因子亚家族的唯一成员,具有溶解型和膜结合型2种形式,当受到致炎因素刺激时去整合素-金属蛋白酶17(a disintegrin and metalloproteinase 17,ADAM17)被诱导并催化生成大量的溶解型和膜结合型,二者通过其高亲和受体CX3CR1相互作用发挥其生物学功能,膜结合型主要在血管内皮细胞表达,介导炎症细胞黏附,溶解型具有强烈的趋化功能,介导CX3CR1阳性细胞的趋化[16]。在肺动脉高压患者和模型动物内皮细胞CX3CL1和巨噬细胞CX3CR1表达上调[17]。Perros等[18]研究发现,大鼠ip野百合碱12 h后CX3CL1/CX3CR1表达便达到高峰,且始终维持在高表达状态,CX3CL1−/−小鼠TNF-α、IL-6、IL-1β和转化生长因子-β(transforming growth factor-β,TGF-β)水平明显降低,且肺血管壁炎症细胞数量减少,表明CX3CL1介导炎症反应与肺动脉高压关系密切[14]。本研究发现敲除CX3CL1显著改善缺氧所致的肺小动脉重构、肺动脉血流速度和右心室血流动力学异常,并且CX3CL1−/−小鼠血清IL-1β和TNF-α水平明显低于WT小鼠,NF-κB活化被抑制,表明CX3CL1介导的炎症反应参与了HPH的发展过程,与文献报道[14]一致。
已有大量研究发现淫羊藿苷具有较好的抗炎作用。淫羊藿苷能够通过抑制NF-κB信号通路下调、、环氧化酶-2(cyclooxygenase-2,)和诱导型一氧化氮合成酶(inducible nitric oxide synthetase,)mRNA表达,缓解脂多糖诱导的肺部炎症[8],同时淫羊藿苷可抑制NF-κB活化和炎症因子TNF-α、IL-6表达改善缺血再灌注脑损伤模型和痴呆模型的炎症反应[19],但淫羊藿苷改善HPH是否与CX3CL1有关尚不清楚。为此,本研究首先检测了淫羊藿苷对WT小鼠炎症相关指标的影响,发现淫羊藿苷能够显著降低血清中IL-1β和TNF-α水平和肺组织CX3CL1蛋白表达水平,抑制NF-κB信号通路的活化,初步表明淫羊藿苷抗HPH与CX3CL1有关。然后比较了淫羊藿苷(20 mg/kg)对CX3CL1−/−小鼠和WT小鼠HPH模型改善作用的差异,一方面,CX3CL1敲除后淫羊藿苷改善HPH的作用基本消失;另一方面,与改善WT小鼠HPH模型作用相比,淫羊藿苷对CX3CL1−/−小鼠改善的幅度显著降低,表明淫羊藿苷改善HPH与CX3CL1相关。综上所述,淫羊藿苷改善HPH与抑制CX3CL1介导的炎症反应有关。
利益冲突 所有作者均声明不存在利益冲突
[1] 颜涵, 郑秋玉, 杨凯, 等. 低氧诱导因子在肺动脉高压发病中的作用及机制[J]. 中华结核和呼吸杂志, 2021, 44(4): 396-399.
[2] Kemdem A, Lemaitre F, Lovat R,. Acute hypoxic pulmonary hypertension associated with right heart failure [J]., 2020, 75(6): 544-548.
[3] Tuder R M. Pulmonary vascular remodeling in pulmonary hypertension [J]., 2017, 367(3): 643-649.
[4] Xiao L J, Chen Y Y, Lin P,. Hypoxia increases CX3CR1 expression via HIF-1 and NF‑κB in androgen-independent prostate cancer cells [J]., 2012, 41(5): 1827-1836.
[5] Zhang Y, Yan J, Hu R,. Microglia are involved in pruritus induced by DNFB via the CX3CR1/p38 MAPK pathway [J]., 2015, 35(3): 1023-1033.
[6] Zhang J L, Hu H B, Palma N L,. Hypoxia-induced endothelial CX3CL1 triggers lung smooth muscle cell phenotypic switching and proliferative expansion [J]., 2012, 303(10): L912-L922.
[7] Wang W, Wang Y L, Chen X Y,. Dexamethasone attenuates development of monocrotaline-induced pulmonary arterial hypertension [J]., 2011, 38(5): 3277-3284.
[8] 路宇仁, 陈昳冰, 崔元璐, 等. 淫羊藿苷药理作用研究进展 [J]. 中国实验方剂学杂志, 2018, 24(17): 209-220.
[9] Li L S, Luo Y M, Liu J,. Icariin inhibits pulmonary hypertension induced by monocrotaline through enhancement of NO/cGMP signaling pathway in rats [J]., 2016, 2016: 7915415.
[10] 李铭铭, 熊乙林, 罗云梅, 等. 淫羊藿苷抗缺氧诱导小鼠肺动脉高压的作用 [J]. 中国新药与临床杂志, 2020, 39(4): 235-240.
[11] 冯华焯. 慢性缺氧性肺动脉高压大鼠模型肺静脉系统结构和功能改变[J]. 中华结核和呼吸杂志, 2021, 44(2): 107.
[12] Xu S J, Yu J J, Zhan J J,. Pharmacokinetics, tissue distribution, and metabolism study of icariin in rat [J]., 2017, 2017: 4684962.
[13] Rudyk O, Aaronson P I. Redox regulation, oxidative stress, and inflammation in group 3 pulmonary hypertension [J]., 2021, 1303: 209-241.
[14] Amsellem V, Abid S, Poupel L,. Roles for the CX3CL1/CX3CR1 and CCL2/CCR2 chemokine systems in hypoxic pulmonary hypertension [J]., 2017, 56(5): 597-608.
[15] Zhuang Q, Ou J, Zhang S,. Crosstalk between the CX3CL1/CX3CR1 axis and inflammatory signaling pathways in tissue injury [J]., 2019, 20(8): 844-854.
[16] Cormican S, Griffin M D. Fractalkine (CX3CL1) and its receptor CX3CR1: A promising therapeutic target in chronic kidney disease? [J]., 2021, 12: 664202.
[17] Liu W M, Jiang L B, Bian C,. Role of CX3CL1 in diseases [J]., 2016, 64(5): 371-383.
[18] Perros F, Dorfmüller P, Souza R,. Fractalkine-induced smooth muscle cell proliferation in pulmonary hypertension [J]., 2007, 29(5): 937-943.
[19] 刘昌雄, 黄雄杰, 肖湘君, 等. 淫羊藿苷对大鼠皮瓣缺血再灌注损伤后炎症反应的抑制作用 [J]. 中国临床药理学杂志, 2019, 35(6): 532-535.
Effect of icariin on hypoxia-induced pulmonary hypertension in mice based on CX3CL1-mediated inflammation
LUO Yun-mei1, 2, LI Ming-ming1, 2, 3, XIONG Yi-lin1, 2, LI Li-sheng1, 2
1. Key Laboratory of Basic Pharmacology of Ministry of Education and International Cooperarion Joint Laboratory of Ethnomedicine of Ministry of Education, Zunyi Medical University, Zunyi 563000, China 2. Guizhou Key Laboratory of Basic Pharmacology, Department of Pharmacology, School of Pharmacy, Zunyi Medical University, Zunyi 563000, China 3. Department of Pharmacy, The Third Affiliated Hospital of Zunyi Medical University (The First People’s Hospital of Zunyi), Zunyi 563000, China
To study the relationship between ameliorative effect of icariin on hypoxic pulmonary hypertension (HPH) and inflammation mediated by chemokine chemokine C-X3-C motif ligand 1 (CX3CL1).Forty C57BL/6J male wild type (WT) mice were randomly divided into control group, WT model group and WT + icariin (10, 20 mg/kg) group; And twenty male CX3CL1−/−mice were divided into CX3CL1−/−model group and CX3CL1−/−+ icariin (20 mg/kg) group. Except for control group, mice were exposed to hypoxia environment with oxygen content of 10% for 21 d, and were ig icariin for two weeksafter 7 d of hypoxic feeding. Pulmonary artery blood flow velocity and right ventricular hemodynamics of mice were detected by ultrasound, and right ventricular hypertrophy index (RVHI) was measured; HE and Masson staining were used to observe the remodeling of pulmonary artery; Tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) levels in serum was detected by ELISA; Western blotting was used to detect CX3CL1 and nuclear factor-κB (NF-κB) pathway-related protein expressions in lung of mice.Compared with control group, pulmonary artery blood flow velocity of mice in WT model group was significantly decreased (< 0.05), RVHI was significantly increased (< 0.05), right ventricular end-systolic diameter, end-systolic volume and output per stroke were increased (< 0.05), right ventricular short axis shortening rate and ejection fraction were decreased (< 0.05), and pulmonary arteriole remodeling was obvious. Compared with WT model group, pulmonary artery blood flow velocity of mice was increased by icariin (< 0.05), RVHI, right ventricular end-systolic diameter, end-systolic volume and output per stroke were reduced (< 0.05), right ventricular short axis shortening rate and ejection fraction were increased (< 0.05), and pulmonary arteriole remodeling was significantly improved; IL-1β and TNF-α levels in serum and CX3CL1 protein expression in lung tissue were decreased by icariin (< 0.05), NF-κB pathway related protein expressions were inhibited (< 0.05). Compared with WT model group, pulmonary artery blood flow velocity, pulmonary arteriolar remodeling, and right ventricular hemodynamics in mice of CX3CL1−/−model group were improved (< 0.05), IL-1β and TNF-α levels in serum were decreased (< 0.05). After knockout of CX3CL1−/−, ameliorating effect of icariin (20 mg/kg) on HPH mice was attenuated or even disappeared.Icariin can improve HPH in mice through inhibiting inflammation mediated by CX3CL1.
icariin; chemokine C-X3-C motif ligand 1; inflammation; hypoxic pulmonary hypertension; mice
R285.5
A
0253 - 2670(2022)04 - 1068 - 08
10.7501/j.issn.0253-2670.2022.04.013
2021-10-13
遵义医科大学博士启动基金资助项目(F-951);遵义医科大学基础药理教育部重点实验室开放课题(JCYL-K-015);遵义市科技局与遵义医学院联合基金资助项目(遵市科合社字[2018]03号)
罗云梅(1990—),女,实验师,主要从事心血管药理学研究。E-mail: 15022335973@163.com
李利生(1979—),男,教授,硕士生导师,主要从事心血管药理学研究。E-mail: medlls@qq.com
#共同第一作者:李铭铭(1988—),男,主管药师,主要从事心血管药理学研究。E-mail: 315804727@qq.com
[责任编辑 李亚楠]
