动物双歧杆菌乳亚种M8胞外多糖的分离纯化和分子特征
2022-02-22颜准吴朝君张小兰李婉麒梁娟陈紫颖艾连中张汇
颜准,吴朝君,张小兰,李婉麒,梁娟,陈紫颖,艾连中,张汇
(上海理工大学 医疗器械与食品学院,上海食品微生物工程技术研究中心,上海,200093)
胞外多糖(exopolysaccharide,EPS)是益生菌在发酵过程中分泌产生的黏液物质,是益生菌发酵液中的重要活性成分,具有调节肠道菌群结构、抗肿瘤、抗氧化、调节免疫、降胆固醇等生物功能[1-4],此外,EPS还作为天然来源的增稠剂和乳化稳定剂,在乳制品和其他食品中得到越来越广泛的应用[5-7]。双歧杆菌是从婴儿粪便中分离得到的一种专性厌氧、无运动性、无芽孢、无鞭毛及荚膜的革兰氏阳性菌,具有多种益生功能,如抑制肿瘤、抑制病原菌生长、改善肠炎和便秘等,是健康人体肠道微生物菌群的重要组成菌属之一[8]。双歧杆菌发挥益生作用的机制与自身分泌的EPS有着密切关系,研究表明,EPS可通过增强宿主免疫和抗病原菌功能来促进双歧杆菌与宿主的共生相互关系[9]。
目前,关于双歧杆菌EPS的研究比较有限,主要集中于EPS的生物合成机制、化学组成以及生物活性功能等[10]。ROBERTS等[11]首次报道了一种产酸性EPS的长双歧杆菌BB-79,并证明乳糖作为主要碳源时,EPS产量最高。其后,多种双歧杆菌EPS被报道,现有研究表明,双歧杆菌EPS可分为中性多糖和酸性多糖两大类,其单糖主要由半乳糖、葡萄糖和甘露糖组成,具有良好的抗炎、抗氧化、肠道益生等生物功能[4, 12-13],以及增黏、乳化等物理功能[5]。然而,目前在分离纯化双歧杆菌EPS方面,均采用阴离子交换色谱(anion-exchange chromatography, AEC)和凝胶过滤色谱相结合的方式,使得分离纯化效率低、成本高,不适合于大规模的制备生产。建立一种稳定、高效、经济的EPS分离纯化模型,将为双歧杆菌EPS的深入研究和应用开发奠定理论基础。
益生菌产EPS通常都是含有多个级分的杂多糖,部分EPS还可能结合蛋白质或肽类形成糖-蛋白或糖-肽复合物[14],根据EPS的化学组成和分子质量分布,需要选择不同的方法对其进行分离纯化,如有机试剂沉淀法、离子交换色谱、凝胶过滤色谱、膜分离法或不同方法组合等[15],其中,有机试剂沉淀法和离子交换色谱被认为是具有高效、可规模化制备特征的方法,而凝胶过滤色谱成本高、效率低、稳定性差,膜分离法虽可实现大规模制备,但存在成本高、膜孔易堵等问题。因此,本研究以1株分离自内蒙古呼和浩特市健康妇女母乳中的高产EPS菌株——动物双歧杆菌乳亚种M8作为研究对象,通过厌氧发酵生产EPS,分别采用乙醇分级沉淀(ethanol gradient precipitation, EGP)和AEC对EPS进行分级处理,以期建立一种高效的分离纯化工艺,为进一步深入研究M8产EPS的结构与功能及其相互关系奠定科学依据。
1 材料与方法
1.1 菌种与培养基
本研究中所使用的动物双歧杆菌乳亚种M8由内蒙古农业大学筛选、鉴定并保藏。
BS培养基(g/100mL):胰蛋白胨1.0,葡萄糖0.5,牛肉膏0.5,柠檬酸铋铵0.2,磷酸氢二钠0.4,煌绿0.002 5,FeSO4·7H2O 0.03,琼脂1.8。
1.2 主要试剂
无水乙醇、三氯乙酸、苯酚、咔唑,上海泰坦科技股份有限公司;葡萄糖、半乳糖醛酸、牛血清蛋白、考马斯亮蓝,上海源叶生物科技有限公司;NaCl、NaNO3、NaOH、乙酸钠、磷酸、硫酸,国药集团化学试剂有限公司。
1.3 仪器与设备
Avanti JXN-26高速冷冻离心机,美国贝克曼库尔特有限公司;N-1100旋转蒸发仪,上海爱郎仪器有限公司;SP-752紫外可见分光光度计,上海光谱仪器有限公司;多角度激光光散射仪,美国怀亚特技术有限公司;ICS-5000离子色谱仪,戴安科技有限公司。
1.4 实验方法
1.4.1 动物双歧杆菌乳亚种M8的发酵与EPS的提取
配制BS培养基2 L,用高温高压灭菌锅于115 ℃灭菌15 min,将活化后的种子液按2%接种量接入BS液体培养基中,于37 ℃下无氧发酵40 h。发酵结束后,100 ℃煮沸发酵液,并保持10 min,对发酵液进行杀菌。冷却后发酵液在4 800 r/min离心20 min,取上清液,加入10%(体积分数)的三氯乙酸溶液,搅拌均匀后静置12 h,离心,上清液用碱液中和后,缓慢加入3倍体积的无水乙醇,搅拌均匀,静置过夜,离心得到醇沉产物。醇沉物复溶于去离子水,用截留分子质量8 000 Da的透析袋对水透析48 h以上,透析袋浓缩后,真空冷冻干燥得到粗EPS。
1.4.2 总糖、蛋白质和糖醛酸含量测定
以葡萄糖为标准,通过苯酚-硫酸法[16]对多糖样品的总糖含量进行测定;以牛血清蛋白(bovine serum albumin,BSA)为标准,通过考马斯亮蓝法[17]测定样品中的蛋白质含量;以半乳糖醛酸标准,通过硫酸-咔唑法[18]对样品中的糖醛酸含量进行测定。所有实验重复3次,取平均值。
1.4.3 EGP分离纯化
根据ZHANG等[19]的方法对粗EPS进行分级纯化。称取粗EPS 200 mg,加入20 mL去离子水中,水浴加热,充分搅拌溶解后配制成10 mg/mL的溶液。配制的溶液经4 800 r/min离心20 min,上清液转至透明烧杯中。缓慢均匀地向上清液中加入无水乙醇,使溶液变浑浊后停止加入(经计算,此时浑浊液中乙醇的体积分数为35%),置于4 ℃冰箱中静置2 h,离心,将沉淀和上清液分离。沉淀中加入无水乙醇洗涤3次,干燥,得到级分F35%。在上清液中继续加入无水乙醇,使溶液体积分数分别达到45%、55%、75%,重复上述步骤,分别得到级分F45%、F55%、F75%。
1.4.4 AEC分离纯化
采用AEC法对粗EPS进行分级纯化[20]。将DEAE-Sepharose Fast Flow填料进行预处理,湿法装柱,用5倍柱体积的超纯水平衡。将配制的10 mg/mL多糖溶液过滤(0.45 μm滤膜过滤),上样10 mL,依次采用4倍柱体积的超纯水、0.1、0.2、0.5 mol/L NaCl溶液(pH均为6.8)进行梯度洗脱,收集不同梯度的洗脱液。将洗脱液在55 ℃下减压浓缩,透析除盐,真空冷冻干燥,得到纯水洗脱级分Fw,以及0.1、0.2、0.5 mol/L NaCl溶液洗脱级分F0.1、F0.2和F0.5。
1.4.5 单糖组成分析
采用高效阴离子交换色谱串联脉冲安培检测器(high performance anion exchange chromatography-pulsed electrochemical detection,HPAEC-PAD)分析粗分离纯化前后EPS的单糖组成[21]。称取5 mg样品于具塞试管中,冰浴下加入0.5 mL 12 mol/L硫酸,室温下搅拌反应30 min。向试管中加水将硫酸稀释分离纯化后至2 mol/L,100 ℃水解2 h,冷却至室温,将水解液用超纯水稀释50~100倍,稀释液用0.22 μm针孔过滤器过滤,进样分析。采用Dionex ICS-5000离子交换色谱系统,配有脉冲安培检测器,CarboPacTM PA20保护柱和 CarboPacTM PA20分析柱(4 mm×250 mm)。色谱峰与标准品(岩藻糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、核糖、半乳糖醛酸、葡萄糖醛酸)比对,进行定性和定量分析。
1.4.6 多糖样品纯度及分子质量测定
采用高效分子排阻色谱(high performance size exclusion chromatography,HPSEC)测定分离纯化前后EPS的分子质量及其分布[22]。HPSEC串联了多角度激光光散射检测器(multi-angle laser light scattering detector,MALLS)、示差检测器(differential refractive index detector,dRI)、黏度检测器以及紫外检测器(ultraviolet detector,UV),色谱柱为OHpak SB-805 HQ和OHpak SB-803 HQ分析柱(8.0 mm×300 mm)串联,流动相为0.1 mol/L NaNO3,流速0.6 mL/min,进样量100 μL,进样质量浓度为1 mg/mL,检测时间80 min,柱温40 ℃。数据分析采用ASTRA 7.1.3软件进行处理,通过zimm plot拟合,得到样品分子质量Mw、回旋半径Rg、特性黏度[η]及相关溶液构象信息。
1.4.7 数据分析
所有实验平行测量3次,数据采用均值±标准差表示。采用SPSS statistics 17.0软件进行单因素方差分析及多重比较分析,P<0.05为差异显著,有统计学意义。
2 结果与分析
2.1 粗EPS化学成分及分子排阻色谱行为分析
天然来源的多糖一般都具有成分不均一、分子质量分布宽等问题,而化学成分和分子质量的不均一性又大大地限制了多糖的基础研究和应用[23]。因此,对于天然来源的多糖提取物,一般都需要进行分离纯化。根据不同多糖的组成和性质,分离纯化的方法有所不同,常用的方法有EGP法、离子交换色谱、凝胶排阻色谱和膜分离法等[15],其中EGP法和离子交换色谱是多糖分离纯化最常用,也是最容易实现大规模制备的方法。然而,这些方法的应用与多糖的化学组成和分子质量分布有密切关系。对于分子质量分布和级分间溶解性差异显著的多糖样品,可选择EGP法[23];对于分子中带电荷数量差异显著的多糖样品,可通过离子交换色谱来进行分级,如中性多糖与酸性多糖的分离[20];而对于分子质量分布差异不明显,性质比较接近的样品,则需要借用分子排阻色谱等方法来进行细分[24]。因此,在选择分离纯化方法之前,确定待纯化样品的化学组成和分子质量分布非常重要。
本研究采用苯酚-硫酸法、考马斯亮蓝法和硫酸-咔唑法分别测定了M8产粗EPS的中性糖、蛋白质和糖醛酸含量,结果表明,粗EPS中中性糖含量为63.4%,蛋白质含量为5.9%,糖醛酸含量为6.7%(表1)。进一步采用HPAEC-PAD测定了粗EPS的单糖组成,结果表明粗EPS主要由半乳糖、葡萄糖、甘露糖和葡萄糖醛酸组成(表1)。由此推测,粗EPS是由中性多糖和一定量的酸性多糖级分组成,并缀合一定量的蛋白。
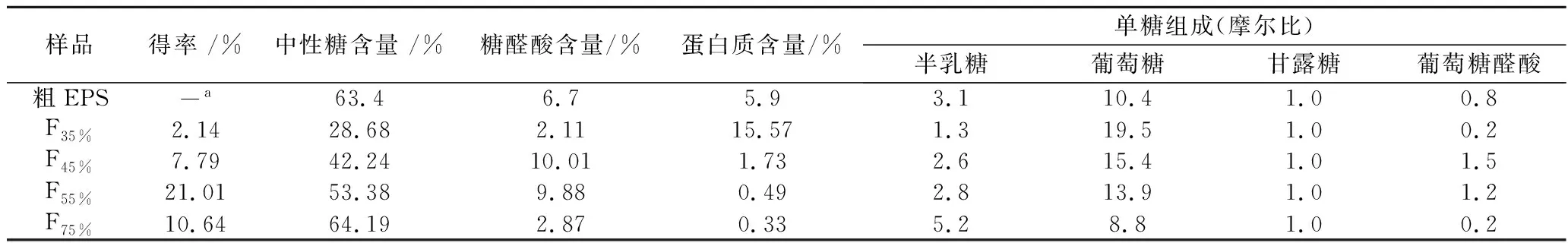
表1 动物双歧杆菌乳亚种M8产胞外多糖乙醇分级沉淀前后化学组成分析比较Table 1 Comparison between the chemical compositions of exopolysaccharides produced by Bifidobacterium Animalis subsp lactis M8 and its fractions fractionated by gradient ethanol precipitation
为了分析粗EPS的分子质量分布,对其进行了HPSEC行为研究,结果如图1所示。通过洗脱曲线(RI检测器)可知,粗EPS主要有2个色谱峰(27、31 min处),此外,在22 min处也出现1个小峰,表明粗EPS中含有至少3个不同分子质量分布的级分。
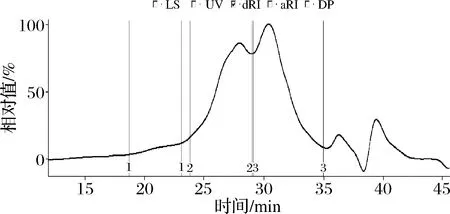
图1 动物双歧杆菌乳亚种M8产胞外多糖的高效凝胶排阻色谱图Fig.1 High performance gel exclusion chromatographic curve of crude polysaccharides produced by Bifidobacterium Animalis subsp. lactis M8
以上结果表明,M8产胞外多糖是一种分子质量分布不均一,含有不同化学组成的多糖混合物,需要进一步的分离纯化,以为M8产胞外多糖的结构鉴定和功能解析奠定科学依据。针对M8产粗EPS的分子排阻色谱行为分析,该多糖分子质量分布较宽,满足EGP所需的基本条件。此外,化学成分分析表明该EPS中含有一定量的葡萄糖醛酸和蛋白质,可能存在带有不同电荷的级分,可通过AEC来进行分离纯化。因此,本研究分别采用EGP法和AEC法对粗EPS进行分离纯化,并通过化学成分分析和分子排阻色谱来评价分离纯化的效果。
2.2 EGP法
采用EGP的方法,对M8产EPS进行分级纯化,依次在乙醇终体积分数为35%、45%、55%和75%,分离沉淀出4个多糖级分,分别记为F35%、F45%、F55%和F75%,经醇洗、冷冻干燥后,4个多糖级分的得率依次为2.14%、7.79%、21.01%和10.64%,总回收率为41.58%(表1)。由此可知,EGP法所得主要级分为F55%,总回收率(41.58%)偏低,这可能与不同级分在乙醇溶液中的相分离效果和沉淀程度有关。EGP本质是在乙醇的作用下,多糖溶液发生不同程度的相分离,低溶解性的多糖级分会先沉淀分离出来,而高溶解性的多糖级分需要在高乙醇浓度下才能沉淀分离。通常来说,多糖在水中的溶解性与其分子质量大小呈反比,分子质量越大,溶解性越低,因此,认为在低乙醇浓度下相分离得到的多糖级分,其分子质量更大,而高乙醇浓度下分离得到的级分,分子质量更小。然而,多糖的化学组成、糖苷键连接方式、主链构成和支链分布等同样会影响多糖的溶解性,因此,EGP法也不仅仅与分子质量有关,还与多糖的化学结构和分子构象有密切关系[23]。
为了评价EGP法的分级效果,分别对F35%、F45%、F55%和F75%4个级分进行了化学组成分析,结果如表1所示。结果显示,级分F35%中性糖含量为28.68%,糖醛酸含量较低(2.11%),蛋白含量相对较高(15.57%),表明该级分可能是富集的蛋白多糖类大颗粒物质,而该级分所测成分的总含量整体偏低,这可能是由于复杂的成分组成干扰了不同成分的显色效果,从而导致比色结果偏低;随着乙醇浓度的提高,级分F45%、F55%、F75%的中性糖含量逐渐升高,糖醛酸成分主要富集在F45%和F55%2个级分,蛋白质含量逐渐降低,表明随着乙醇浓度的提高,多糖纯度提高。单糖组成分析表明,级分F35%主要由葡萄糖组成,含有少量的半乳糖和甘露糖;F45%、F55%和F75%3个级分中,半乳糖含量逐渐增加,葡萄糖含量降低,其中葡萄糖醛酸主要分布在F45%和F55%2个级分中。从单糖组成结果可知,乙醇分级沉淀得到的4个级分将酸性多糖富集在F45%和F55%级分中,同时,该2个级分的单糖组成没有显著性差异,可认为属于同一类杂多糖。
进一步,采用HPSEC对4个级分的分子质量分布进行了分析,结果如图2所示。级分F35%(黑色线)呈现对称的单峰,表明其均一性良好,而F45%、F55%和F75%3个级分均出现肩峰或双峰,表明其不是单一的级分。结合化学成分分析结果,F35%虽然具有良好的均一性,但糖纯度(总糖含量)较低,被认为是非多糖级分,F45%、F55%和F75%的糖纯度虽然提高了,但为非均一组分,因此,认为EGP法无法对M8产胞外多糖进行有效的分离纯化。
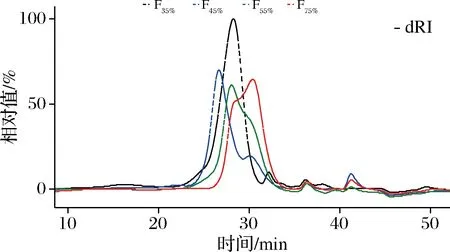
图2 动物双歧杆菌乳亚种M8产胞外多糖乙醇分级沉淀后不同级分的高效凝胶排阻色谱曲线Fig.2 High performance gel exclusion chromatographic curves of fractions fractionated by gradient ethanol precipitation from crude polysaccharides produced by Bifidobacterium Animalis subsp. lactis M8
2.3 AEC法
带电荷的多糖分子可与阴离子交换树脂结合,通过纯水和不同离子强度的洗脱液可将中性级分和带不同电荷的级分分离开,从而用于分离带不同电荷的多糖级分,如中性、酸性多糖、蛋白聚糖等[15]。本研究借助DEAE-Sepharose Fast Flow色谱填料,依次采用纯水、0.1、0.2、0.5 mol/L NaCl溶液作为洗脱液,从粗EPS中分离得到了4个级分,分别记为Fw、F0.1、F0.2和F0.5,各级分的得率如表2所示,Fw是一种中性多糖,不含糖醛酸,也未检测出蛋白质,但其得率最低,表明粗EPS中中性多糖级分含量较少;F0.1和F0.2的得率分别为15.06%和 29.62%,中性糖含量较高,且含有一定量的糖醛酸,其中,F0.2的糖醛酸含量达到8.40%,表明糖醛酸主要富集在F0.2级分中;F0.5级分得率最高,中性糖含量为67.28%,糖醛酸含量较低,主要富集了粗多糖中的蛋白组分,推测可能为一种蛋白聚糖,由于蛋白组分中含有较多的负电荷,可被阴离子交换树脂吸附。从表2可知,通过AEC分离,可对粗EPS进行有效的分级,得到糖纯度较高的中性多糖(Fw)和不同糖醛酸含量的酸性多糖(F0.1和F0.2),以及富集了蛋白的糖级分F0.5,4个级分总回收率为99.35%,明显高于EGP法。

表2 动物双歧杆菌乳亚种M8产胞外多糖乙醇分级沉淀前后化学组成分析比较Table 2 Chemical compositions of exopolysaccharides produced by Bifidobacterium Animalis subsp. lactis M8 and its fractions fractionated by anion exchange chromatography
单糖组成结果表明,Fw可被认为是一种葡聚糖,含有少量的半乳糖和甘露糖;F0.1、F0.2和F0.5均为以葡萄糖为主的酸性杂多糖,其中F0.2相对于其他级分,半乳糖和葡萄糖醛酸比例最高。以上结果与化学成分分析结果一致,表明AEC法可对粗EPS的不同级分进行有效分离。
进一步的,对AEC法分级得到的4个级分进行分子质量分布分析,结果如图3所示。级分Fw和F0.1均不是均一的级分,然而,F0.2和F0.52个级分均呈现单一对称的色谱峰,表明这2个级分均有良好的均一性。此外,通过多检测器在线同时检测,发现级分F0.5的dRI信号与UV(280 nm)检测信号出峰一致,这表明F0.5中的糖组分与蛋白组分是结合态,可认为是一种蛋白聚糖[24]。结合化学成分分析结果,得率较低的Fw和F0.1级分,虽然糖纯度(总糖含量)较高,但分子质量分布不均一,而F0.2和F0.52个级分的糖纯度和均一性均达到分离纯化的要求,其中F0.2为一种酸性杂多糖,而F0.5为一种蛋白聚糖,该2级分的总回收率达80.85%,表明AEC法能够有效将分布不均一的中性级分除去,并将分布均一的酸性级分和蛋白聚糖级分得到有效的分离。
2.4 纯化级分的分子参数分析
采用HPSEC-MALLS对均一级分F0.2和F0.5的分子质量及其溶液性质进行分析,结果如表3所示,F0.2级分的重均分子质量(Mw)为21.4 kDa,多分散系数为1.51,具有良好的均一性,Rg为27.2 nm,特性黏度[η]为0.32 dL/g;而F0.5的Mw比F0.2略大,但其Rg却更小、[η]更大,表明F0.5分子结构更紧凑。
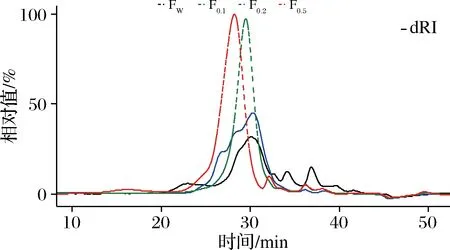
图3 动物双歧杆菌乳亚种M8产胞外多糖阴离子交换色谱分级后不同级分的高效凝胶排阻色谱曲线Fig.3 High performance gel exclusion chromatographic curves of fractions fractionated by anion exchange chromatography from crude polysaccharides produced by Bifidobacterium Animalis subsp.lactis M8

表3 阴离子交换色谱分离纯化级分F0.2和F0.5分子参数分析Table 3 Molecular parameters of fractions of F0.2 and F0.5 fractionated by anion exchange chromatography
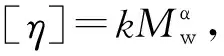
3 结论
本研究比较分析了EGP法和AEC法分离纯化动物双歧杆菌乳亚种M8产EPS的效果,确定了M8产EPS的分离纯化工艺为:阴离子交换色谱分级,柱填料为DEAE-Sepharose Fast Flow,梯度洗脱溶剂依次为纯水、0.1、0.2、0.5 mol/L NaCl溶液,由此制备得到糖纯度和均一性均良好的多糖级分F0.2和F0.5。分子结构特征分析表明,F0.2为一种酸性杂多糖,主要由葡萄糖、半乳糖、甘露糖和葡萄糖醛酸组成,在水溶液中呈刚性较强的松散线团结构;而F0.5则为一种蛋白聚糖,糖链组成与F0.2相似,但糖醛酸含量更低,并缀合了蛋白组分,使得F0.5在水溶液中呈紧凑的柔性卷曲状结构。本研究确定的分离纯化方法具有高效、经济、回收率高等特点,可实现大规模制备,同时,本研究也为动物双歧杆菌乳亚种M8产EPS的结构与功能及其相互关系研究和M8在食品工业中的应用奠定科学依据。
