葛根异黄酮对高尿酸血症小鼠炎症、应激反应的影响研究
2022-02-22李桐朱天麒方少婷欧阳军艳向惠芳陈赛珍王耀霆姚雨涵黄春霞
李桐,朱天麒,方少婷,欧阳军艳,向惠芳,陈赛珍,王耀霆,姚雨涵,黄春霞
随着居民饮食习惯的改变,高尿酸血症(hyperuricemia,HUA)发病率逐年递增,已成为临床常见病、多发病,受到诸多学者的高度关注,且寻求安全、有效的治疗方法对改善患者临床症状非常关键。HUA是因嘌呤代谢紊乱而导致的尿酸排泄异常的代谢性疾病,其作为痛风的前期状态,不仅会侵犯骨和关节,而且易累及肾脏和心血管系统,导致肥胖症、高脂血症、高血压、糖尿病、动脉粥样硬化等慢性病发生风险增加[1]。当前,临床主要采用西药抑制尿酸合成和促进尿酸排泄,诸如丙磺舒、磺吡酮、苯溴马隆的效果较好,但易导致肝肾功能损伤,极大地限制其临床应用;尿酸酶可催化尿酸转化为尿囊素,但其价格高昂而不宜推广应用。因此,寻找避免HUA患者肾功能损伤的天然药物具有重要意义[2]。中医学对HUA的认识已有数千年的历史,朱丹溪《格致余论》:“痛风者,因血受热……或涉冷水,或立湿地,或扇风取凉,或卧当风……汗浊凝涩所以作痛,夜则痛甚,行于阴也”。因此,基于中医学相关理论,探究中草药材或食物组分对疾病的长期影响,可为疾病症状、疗效改善提供依据[3];研究还显示,HUA病情持续会加速脂类物质沉积到血管壁,引发炎症反应,继而导致血管内皮损伤、应激反应过度,甚至介导细胞因子而影响肾小球内皮细胞的通透性,若能有效抑制内皮细胞炎症或应激状态,或许能对肾脏起到一定的保护作用,而现有研究已证实葛根异黄酮具有明确的降糖、降脂作用[4]。基于上述研究背景及理论基础,本研究旨在探究葛根异黄酮对HUA小鼠炎症、应激反应的影响,以期为其推广应用提供理论支持。
1 材料与方法
1.1 实验时间 本实验时间为2020年12月至2021年6月。
1.2 实验动物 48只SPF级昆明小鼠(2月龄)由长沙医学院动物实验中心提供(动物许可证SCXK湘2020-110504),雌雄各半,初始体质量30~50 g、平均(36.8±4.2)g,分笼饲养,室内昼夜温度维持在(25.0±3.0)℃,适应性饲养7 d后开始实验。本研究获长沙医学院医学伦理委员会批准(批准号:CY伦20201102)。
1.3 实验主要药品、试剂和仪器
1.3.1 主要药品 葛根(陕西康盛堂药业有限公司生产,产品批号:20140506),羧甲基纤维素钠(天津市恒兴化学试剂制造有限公司生产,产品批号:20110728),盐酸乙胺丁醇(杭州民生药业集团有限公司生产,产品批号:20110547),非布司溶液(江苏万邦生化医药股份有限公司生产,产品批号:20144060)。
1.3.2 主要试剂配制 (1)葛根异黄酮提取和纯化:①粉碎:葛根用蒸馏水多次冲洗,随后用恒温干燥箱于60 ℃烘干至恒重,用料理机粉碎,80目过筛待用;②脱脂:用石油醚对药材进行脱脂处理,再用70%乙醇加热回流提取2 h(投料比为1∶8),趁热过滤,弃去药渣,用旋转蒸发仪回收乙醇,浓缩至无醇味,用LS-46D大孔树脂纯化;③提取:用乙醇浸泡葛根后进行漉液提取,将滤液浓缩成稠膏状,真空干燥后得到干浸膏;④纯化:用树脂法进行纯化(采用AB-8大孔吸附树脂串联柱,洗脱剂乙醇体积分数为70%,工作液流速28 V/h,浸提浓缩液pH=5)。(2)造模试剂的配制:称取4 000 mg腺嘌呤和40片盐酸乙胺丁醇(研成粉末状),先用少量的0.5%盐酸乙胺丁醇溶解,然后再定容到400 ml,此时腺嘌呤浓度为100 mg/kg、盐酸乙胺丁醇浓度为250 mg/kg,混匀待用[5]。(3)0.5%羧甲基纤维素钠的配制:称取羧甲基纤维素钠4 g,而后用蒸馏水配成800 ml。
1.3.3 主要仪器 电子分析天平(奥豪斯公司),TG-16W型高速离心机(长沙湘锐离心机有限公司),BK-400型全自动生化分析仪(济南好来宝医疗器材有限公司),DHG-9030A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),JJ-12J型脱水机(武汉俊杰电子有限公司),RM2016型病理切片机(上海徕卡仪器有限公司),DS-U3型正置光学显微镜成像系统(日本尼康公司)。
1.4 实验分组和干预方法 采用随机数字表法将小鼠分为正常组、模型组、条件对照组、实验组,各12只。正常组小鼠每天灌胃0.5%羧甲基纤维素钠(给药剂量1 ml/20 g体质量);其余三组小鼠每天灌胃等体积造模试剂制备HUA模型[6],共计30 d。造模成功后正常组小鼠继续用混合饲料饲养,不予其他药物;模型组小鼠继续灌胃0.5%羧甲基纤维素钠(给药剂量1 ml/10 g体质量),不予其他药物;条件对照组小鼠继续灌胃0.5%羧甲基纤维素钠(给药剂量1 ml/20 g体质量),同时灌胃非布司溶液(给药剂量20 mg/d);实验组小鼠继续灌胃0.5%羧甲基纤维素钠(给药剂量1 ml/20 g体质量),同时灌胃葛根异黄酮(给药剂量20 mg/d);四组干预时间均为30 d。
1.5 观察指标 (1)分别于干预前和干预后(30 d后)取小鼠空腹状态下尾部静脉血,3 500 r/min离心15 min(离心半径13.5 cm),检测血清尿酸(uric acid,UA)、炎症指标〔包括P物质(substance P,SP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素6(interleukin 6,IL-6)〕、应激反应指标〔包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)、一氧化氮合酶(nitric oxide synthase,NOS)〕。(2)干预结束后处死小鼠,取主动脉弓,置于甲醛溶液中固定,采用蒸馏水反复漂洗,用超薄切片机制作薄切片,用伊红染色液或苏木素染液进行染色处理,显微镜观察主动脉弓内皮细胞病理学特征。
1.6 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料经K-S检验均符合正态分布且方差齐,以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,组内干预前后比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 四组小鼠干预前后血清UA比较 干预前,四组小鼠血清UA比较,差异无统计学意义(P>0.05);干预后,四组小鼠血清UA比较,差异有统计学意义(P<0.05)。干预后,模型组、条件对照组、实验组小鼠血清UA高于正常组,条件对照组、实验组小鼠血清UA低于模型组,差异有统计学意义(P<0.05)。模型组、条件对照组、实验组小鼠干预后血清UA分别高于本组干预前,差异有统计学意义(P<0.05),见表1。
表1 四组小鼠干预前后血清UA比较(±s,n=12,μmol/L)Table 1 Comparison of serum UA in four groups before and after intervention
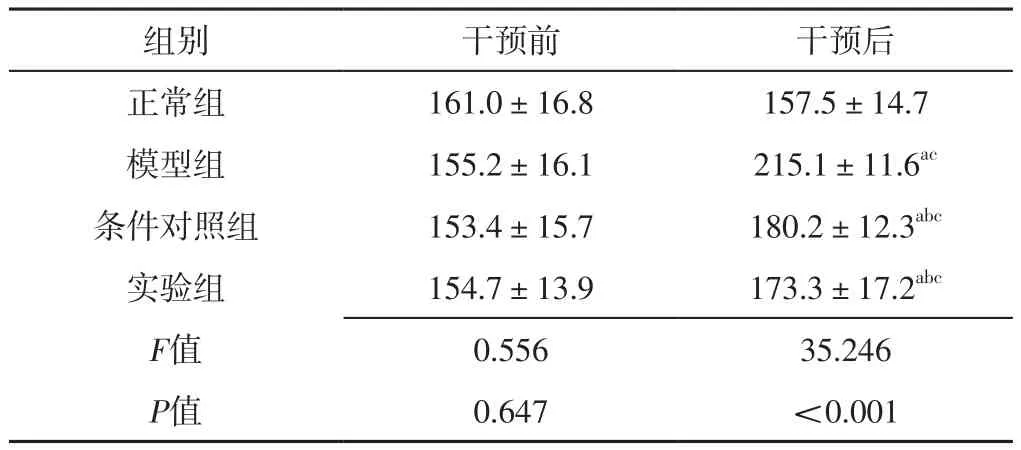
表1 四组小鼠干预前后血清UA比较(±s,n=12,μmol/L)Table 1 Comparison of serum UA in four groups before and after intervention
注:a表示与正常组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与本组干预前比较,P<0.05
组别 干预前 干预后正常组 161.0±16.8 157.5±14.7模型组 155.2±16.1 215.1±11.6ac条件对照组 153.4±15.7 180.2±12.3abc实验组 154.7±13.9 173.3±17.2abc F值 0.556 35.246 P值 0.647 <0.001
2.2 四组小鼠干预前后血清炎症指标比较 干预前,四组小鼠血清SP、ESR、CRP、TNF-α、IL-6比较,差异无统计学意义(P>0.05);干预后,四组小鼠血清SP、ESR、CRP、TNF-α比较,差异有统计学意义(P<0.05);干预后,四组小鼠血清IL-6比较,差异无统计学意义(P>0.05)。干预后,模型组、条件对照组、实验组小鼠血清SP、ESR、CRP、TNF-α高于正常组,条件对照组、实验组小鼠血清SP、ESR、CRP、TNF-α低于模型组,实验组小鼠血清SP、ESR、CRP低于条件对照组,差异有统计学意义(P<0.05)。模型组、条件对照组、实验组小鼠干预后血清SP、ESR、CRP、TNF-α分别高于本组干预前,差异有统计学意义(P<0.05),见表2。
表2 四组小鼠干预前后血清炎症指标比较(±s,n=12)Table 2 Comparison of serum inflammatory indexes in four groups before and after intervention

表2 四组小鼠干预前后血清炎症指标比较(±s,n=12)Table 2 Comparison of serum inflammatory indexes in four groups before and after intervention
注:a表示与正常组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与条件对照组比较,P<0.05;d表示与本组干预前比较,P<0.05;P物质=SP,ESR=红细胞沉降率,CRP=C反应蛋白,TNF-α=肿瘤坏死因子α,IL-6=白介素6
组别 SP(pg/ml) ESR(mm/1 h) CRP(μg/ml) TNF-α(pg/ml) IL-6(pg/ml)干预前 干预后 干预前 干预后 干预前 干预后 干预前 干预后 干预前 干预后正常组 72.6±4.6 72.0±3.5 28.3±3.4 28.5±4.4 20.0±4.1 20.5±4.5 25.3±3.3 25.0±4.4 126.2±12.7 127.0±13.5模型组 73.0±6.6 102.4±8.4ad 27.9±5.5 44.2±4.4ad 20.7±3.3 49.7±5.7ad 25.2±2.1 36.7±1.5ad 125.6±11.3 127.4±13.6条件对照组 73.0±7.2 88.5±6.3abd 28.7±4.1 36.2±4.0abd 21.1±4.5 40.2±4.8abd 24.9±3.6 30.0±3.4abd 126.2±10.7 128.4±10.8实验组 72.6±5.3 79.7±2.5abcd 28.5±5.1 32.5±2.1abcd 21.0±4.1 25.6±3.0abcd 25.0±3.6 28.0±2.6abd 125.7±4.2 126.0±3.3 F值 0.018 63.430 0.066 36.283 0.183 101.484 0.039 29.599 0.018 0.085 P值 0.997 <0.001 0.978 <0.001 0.908 <0.001 0.990 <0.001 0.997 0.962
2.3 四组小鼠干预前后血清应激反应指标比较 干预前,四组小鼠血清SOD、GSH-Px、MDA、NO、NOS比较,差异无统计学意义(P>0.05);干预后,四组小鼠血清SOD、GSH-Px、MDA比较,差异有统计学意义(P<0.05);干预后,四组小鼠血清NO、NOS比较,差异无统计学意义(P>0.05)。干预后,模型组、条件对照组、实验组小鼠血清SOD高于正常组,血清GSH-Px低于正常组,差异有统计学意义(P<0.05);干预后,模型组、条件对照组小鼠血清MDA高于正常组,差异有统计学意义(P<0.05);干预后,条件对照组、实验组小鼠血清SOD、MDA低于模型组,血清GSH-Px高于模型组,差异有统计学意义(P<0.05);干预后,实验组小鼠血清SOD、MDA低于条件对照组,血清GSH-Px高于条件对照组,差异有统计学意义(P<0.05)。模型组、条件对照组、实验组小鼠干预后血清SOD、MDA分别高于本组干预前,血清GSH-Px分别低于本组干预前,差异有统计学意义(P<0.05),见表3。
表3 四组小鼠干预前后血清应激反应指标比较(±s,n=12)Table 3 Comparison of serum stress response indexes in four groups before and after intervention

表3 四组小鼠干预前后血清应激反应指标比较(±s,n=12)Table 3 Comparison of serum stress response indexes in four groups before and after intervention
注:a表示与正常组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与条件对照组比较,P<0.05;d表示与本组干预前比较,P<0.05;SOD=超氧化物歧化酶,GSH-Px=谷胱甘肽过氧化物酶,MDA=丙二醛,NO=一氧化氮,NOS=一氧化氮合酶
组别 SOD(U/ml) GSH-Px(mg/L) MDA(μmol/L) NO(μmol/ml) NOS(mol/L)干预前 干预后 干预前 干预后 干预前 干预后 干预前 干预后 干预前 干预后正常组 68.3±7.4 69.3±8.3 205.3±12.8 207.2±11.3 1.69±0.25 1.72±0.51 43.7±6.3 44.8±5.7 13.6±4.5 14.0±6.2模型组 69.1±6.7 136.5±9.3ad 206.0±10.7 127.6±15.0ad 1.73±0.29 3.03±0.17ad 45.0±7.3 44.9±6.4 14.2±5.5 13.9±4.7条件对照组 67.2±8.3 118.3±9.5abd 204.9±14.5 147.8±12.8abd 1.58±0.43 2.42±0.26abd 43.8±7.0 45.2±4.8 14.0±3.6 14.2±4.2实验组 71.5±8.4 89.6±9.0abcd 207.1±15.8 160.1±12.6abcd 1.65±0.39 1.99±0.25bcd 45.2±5.8 44.4±5.1 14.4±3.5 13.9±4.9 F值 0.668 130.833 0.060 453.547 0.406 37.391 0.168 0.043 0.074 0.010 P值 0.576 <0.001 0.980 <0.001 0.749 <0.001 0.917 0.988 0.974 0.999
2.4 四组小鼠干预后主动脉弓内皮细胞病理学特征正常组小鼠主动脉弓内皮细胞排列规则,结构清晰,无坏死区域,无明显裂缝。模型组小鼠主动脉弓内皮细胞有明显水样变性,胞质以及细胞核有轻微肿胀,部分区域有淋巴细胞聚集和炎症细胞浸润。条件对照组和实验组小鼠主动脉弓部分内皮细胞有双核,为增生表现,水样变形不明显;此外,条件对照组仍有少量炎症细胞浸润表现,实验组小鼠内皮细胞恢复情况较好,细胞形态比较完整,少见空洞、排列紧密,见图1。

图1 四组小鼠干预后主动脉弓内皮细胞病理学特征(HE染色,×40)Figure 1 Pathological characteristics of aortic arch endothelial cells in four groups of mice after intervention
3 讨论
众所周知,HUA可引发心血管疾病,其机制主要为血液中持续高水平尿酸激活了人体的肾素-血管紧张素系统,微观层面引发平滑肌细胞增殖,同时促进血小板黏附作用加强,使血栓形成风险增加,进而加速动脉粥样硬化形成[7]。近年随着对HUA的深入研究,HUA的治疗药物也呈现多样化趋势,嘌呤类似物及非甾体类、糖皮质激素类、秋水仙碱类药物对其治疗效果明显,但不良反应较多[8],因此研发新型、高效、安全的HUA治疗药物仍为诸多学者的重点研究方向。黄酮是临床研究较为广泛且富含于众多中药材中的化学物质,根据三碳链的氧化程度、B环连接的位置及三碳是否成环,黄酮类化合物可分为黄酮、黄酮醇、二氢黄酮、异黄酮等衔生物[9]。葛根是从豆科植物野葛或干葛藤的根中提取的一种异黄酮类化合物,具有提高免疫力、扩血管、降压等药理作用。现有研究表明,葛根可通过抑制黄嘌呤氧化酶的活性而减少UA的生成,但关于其对内皮细胞影响的研究甚少[10]。能否缓解内皮细胞炎症或应激状态,继而增加机体清除氧自由基的能力,甚至通过减少脂质过氧化来降低UA,是近年来异黄酮类化合物药理机制的研究热点。葛根是富含异黄酮类化合物的古老中药材,本实验前期准备期间对原材料葛根进行了成分提取和纯化,显示葛根包含葛根素、羟基葛根素、甲氧基葛根素、葛根素-木糖苷、大豆苷元、大豆苷等组分,其中异黄酮含量较多,因此从葛根中提取异黄酮有一定实用及经济价值[11]。
本实验结果显示,干预后,模型组血清UA、SP、ESR、CRP、TNF-α、SOD、MDA高于正常组,血清GSH-Px低于正常组,说明HUA小鼠血管内皮细胞普遍存在异常炎症、应激反应,也客观说明本实验使用的造模方法可行,HUA的发生会对小鼠体内炎症或应激状态造成明显影响。原因在于血液中高水平UA会诱发胰腺β细胞功能障碍,继而导致晶体沉积于组织、关节,若嘌呤代谢持续紊乱或UA排泄障碍,则会引发急性特征性关节炎或相关肾脏疾病[12]。本实验结果还显示,条件对照组、实验组小鼠干预后血清UA、SP、ESR、CRP、TNF-α、SOD、MDA分别高于本组干预前,血清GSH-Px分别低于本组干预前,说明羧甲基纤维素钠联合非布司溶液、羧甲基纤维素钠联合葛根异黄酮均可在一定程度上降低HUA小鼠血清UA,并有效缓解体内炎症或应激反应。HUA小鼠发病时,基本病理特征表现为饱和状态的UA持续沉积于肾小管,持续刺激局部并引起淋巴细胞、单核细胞及浆细胞浸润[13]。TNF-α作为影响多种病理生理过程的重要炎症因子,兼有激活单核细胞和巨噬细胞、抗肿瘤的作用,其水平升高与实验组小鼠应用葛根异黄酮后组织局部抗炎作用有关[14-15]。但本实验尚未对小鼠肾脏进行病理学观察,非布司溶液和葛根异黄酮能否对肾小管功能产生长远的积极影响尚不得知。此外,本实验结果显示,干预后,实验组小鼠血清SP、ESR、CRP、SOD、MDA低于条件对照组,血清GSH-Px高于条件对照组,提示非布司溶液的治疗效果不及葛根异黄酮,这主要与HUA疾病进展过程的特殊性有关。HUA会严重损伤模型小鼠的肾功能,长期使用非布司溶液虽然会在一定程度上减轻病灶局部应激程度,但亦会进行性加重小鼠肾脏负担,而葛根异黄酮主要通过影响黄嘌呤氧化还原酶活性而改善HUA病情,持久使用亦不会对小鼠肾脏产生过重的额外负担[16-17]。有研究显示,葛根异黄酮可通过调节嘌呤核苷酸代谢来有效促进UA排泄,从而极大程度地减少UA对动脉血管的刺激或破坏作用[18]。因此,葛根异黄酮发挥HUA治疗作用不局限于控制UA的产生途径,还通过改善心血管功能来促进UA的排泄,并最终促进HUA病情转归[19-20],这为其药理机制研究、药效开发应用奠定了一定基础。本实验结果还显示,条件对照组和实验组小鼠主动脉弓部分内皮细胞有双核,说明经过非布司溶液或葛根异黄酮治疗后,HUA小鼠病灶局部有明显的细胞增殖现象;实验组小鼠内皮细胞恢复情况较好,细胞形态比较完整,进一步说明葛根异黄酮可更有效地改善HUA小鼠的心血管功能。
综上所述,与非布司溶液相比,葛根异黄酮可更有效地减轻HUA小鼠的病情严重程度,同时减轻炎症和应激反应,改善心血管功能。但本研究仅阐释了葛根异黄酮对HUA小鼠血清炎症、应激反应指标的影响,尚未深入探究其影响血管内皮细胞炎症和应激反应的具体信号通路,因此无法从代谢组学角度透彻地阐述葛根异黄酮治疗HUA的机制,尚需后续研究进一步探索。
作者贡献:李桐、朱天麒进行文章的构思与设计、数据整理,撰写论文;李桐进行研究的实施与可行性分析;朱天麒、方少婷进行数据收集;欧阳军艳、向惠芳进行统计学处理;李桐、欧阳军艳、向惠芳、陈赛珍进行结果的分析与解释;李桐、朱天麒、王耀霆、姚雨涵、黄春霞进行论文的修订;黄春霞负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
