小麦赤霉病菌对叶菌唑的抗性风险分析
2022-02-22张亚妮邓渊钰
张 铭, 张亚妮, 李 伟, 邓渊钰,
曹淑琳2, 孙海燕*,2, 陈怀谷*,1,2
(1. 南京农业大学 植物保护学院,南京 210095;2. 江苏省农业科学院 植物保护研究所,南京 210014)
病原菌对杀菌剂的抗性风险主要与其遗传特性、药剂作用机制及特点、施药方式和频率以及发病环境条件等多方面因素相关,明确杀菌剂的抗性风险,对于指导该药剂的科学使用以及制定合理有效的抗性治理策略具有重要意义[1-2]。
由禾谷镰孢菌Fusarium graminearum等侵染引起的小麦赤霉病是我国小麦生产上最具威胁的流行性病害之一[3]。该病害的流行不仅可造成小麦大幅减产,还可产生脱氧雪腐镰孢菌烯醇 (DON)等多种毒素,污染谷物,威胁人和动物的健康[4-5]。目前生产中对该病害的防治主要以种植抗病品种和施用化学药剂为主。我国自20 世纪70 年代以来一直使用苯并咪唑类杀菌剂多菌灵防治小麦赤霉病,由于长期依赖该药剂,很多省份已经出现抗药性问题[6]。麦角甾醇脱甲基抑制剂类(DMIs)杀菌剂戊唑醇已被广泛用于我国小麦赤霉病的防治,目前也已有抗性产生的相关报道[7-8]。氰烯菌酯是我国自主研发的一种新型氰基丙烯酸酯类杀菌剂,对小麦赤霉病有良好的防效,虽然目前还未见关于其田间抗性的报道,但已有研究表明小麦赤霉病菌对该药剂存在较高的抗性风险,不能长期单一使用[9]。因此,及时引进和开发新杀菌剂,对延缓小麦赤霉病菌抗药性的产生和有效控制该病害具有重要意义。
DMIs 杀菌剂叶菌唑于2019 年起在我国登记用于小麦赤霉病防治,但目前尚未见关于其抗性水平及抗性风险方面的系统报道。明确我国小麦赤霉病菌对叶菌唑的敏感性水平、抗性风险和抗性机制,可为制定该药剂的使用策略提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 用于测定敏感性水平的100 株小麦赤霉病菌于2012‒2014 年采集自江苏、安徽、山东和河南4 个省份的小麦穗部病样,采用组织分离法分离获得。菌株进行单孢分离后转入PDA 斜面试管,于4 ℃冰箱中保存。所有菌株经tef-1α基因扩增比对鉴定为禾谷镰孢菌Fusarium graminearum,以F + 年份 + 序号进行命名。从中选取4 株菌株 (F1405、F1407、F1321 和F1330)以及本实验室分离鉴定并保存的1 株小麦赤霉病菌株 (F1095,采自江苏省) 用于药剂驯化,经测定这些菌株均对叶菌唑敏感。
1.1.2 供试小麦 品种为淮麦33,按照常规方法进行种植和田间管理。
1.1.3 药剂及试剂 98%叶菌唑 (metconazole) 原药,高邮市丰田农药有限公司;95%戊唑醇 (tebuconazole)原药,拜耳 (中国) 有限公司;97% 丙硫菌唑(prothioconazole) 原药,安徽久易农业股份有限公司;97%咪鲜胺 (prochloraz) 原药,江苏辉丰农化股份有限公司;95% 丙环唑 (propiconazole) 原药,江苏耕耘化学有限公司;95%三唑酮 (triadimefon)原药,江苏剑牌农化股份有限公司;95%氰烯菌酯 (phenamacril) 原药,江苏农药研究所股份有限公司。所有原药均用甲醇配制成1.0 × 104和1.0 ×103μg/mL 的母液备用。
1.1.4 供试培养基 PDA 培养基:去皮马铃薯200 g,蔗糖20 g,琼脂20 g,用蒸馏水定容至1000 mL,于121 ℃高温高压灭菌30 min。胡萝卜培养基:胡萝卜200 g,加蒸馏水500 mL 后于121 ℃高温高压灭菌10 min, 匀浆后加入20 g 琼脂,用蒸馏水定容至1000 mL,再次于121 ℃高温高压灭菌30 min。6%绿豆汤培养基:绿豆60 g,煮沸后的绿豆汤经4 层纱布过滤,用蒸馏水定容至1000 mL 并分装,于115 ℃高温高压灭菌25 min。V8 培养基:V8 果汁160 mL,酶水解酪素 1 g, 碳酸钙 1 g, 琼脂20 g,蒸馏水1000 mL,于121 ℃高温高压灭菌30 min。
1.1.5 基因检测试剂 真菌DNA 提取试剂盒 (货号:D2300-50) ,北京索莱宝科技有限公司;Trizol RNA 分离试剂 (货号:15596026) ,Invitrogen-赛默飞世尔中国;PrimeScriptTM∏ 1st Strand cDNA Synthesis 试剂盒 (货号:6210A) ,宝日医生物技术 (北京) 有限公司。
1.2 小麦赤霉病菌对叶菌唑的敏感性测定
采用菌丝生长速率法[10]。将药剂与PDA 培养基混匀,配制成药剂最终质量浓度分别为0.03、0.1、0.3、1 和3 μg/mL 的含药平板,以加入等体积甲醇的PDA 平板为对照。在预先培养好的小麦赤霉病菌近边缘处制取直径为5 mm 的菌碟,菌丝面向下接种于平板中央,25 ℃恒温培养。每处理重复3 次。3 d 后采用十字交叉法测量各处理的菌落直径,计算菌丝生长抑制率。根据浓度和抑制率,利用DPS 软件计算EC50和r值。
1.3 抗性突变体驯化获得及生存适合度研究
1.3.1 药剂驯化 采用分生孢子萌发抑制法[10]测定叶菌唑对亲本菌株孢子萌发的最小抑制浓度(MIC) 。收集分生孢子悬浮液,均匀涂布到含MIC 浓度药剂的V8 平板上,每个平板涂布孢子量约为2 × 104个,每个菌株涂布50 个含药平板。25 ℃恒温培养,30 d 后挑取角变区或生长较大的菌落转接到含相同浓度药剂的V8 平板上,将能在含药平板上快速生长的菌丝转移到空白V8 平板上保存,即为疑似抗性突变体。疑似抗性突变体在空白V8 平板上转接4 次后,如果抗性仍然存在,则确定为抗性突变体,将驯化所得抗性突变体在空白PDA 平板上再转接4 次,进一步验证其抗性遗传稳定性。按照 (1) 式计算抗性倍数 (RI) 。
式中,EC50(R)为抗性突变体的EC50值,EC50(S)为亲本菌株的EC50值。
按照 (2) 式计算用于区分敏感菌株和抗性突变体的抗性倍数 (RID) 。
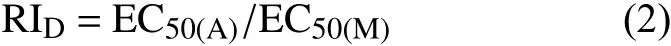
式中,EC50(A)为敏感性基线中最不敏感菌株的EC50值;EC50(M)为敏感性基线的平均EC50值。
抗性分级标准:R I ≤R ID为敏感菌株;RID
1.3.2 生存适合度研究
菌丝生长能力测定:在预培养2 ~ 3 d 的菌落近边缘打取直径5 mm 的菌碟,菌丝面向下转接到空白PDA 平板中央,25 ℃下黑暗培养,3 d 后用十字交叉法测量菌落直径。每个菌株重复3 次,试验重复2 次。
产分生孢子能力测定:在预培养2 ~ 3 d 的菌落近边缘打取直径5 mm 的菌碟,接种于6% 绿豆汤培养基中,每瓶接种3 个菌碟,于25 ℃、120 r/min 下振荡培养,2 d 后用血球计数板测算孢子浓度。每个菌株设3 个重复,每个重复统计3 次分生孢子数,试验重复2 次。
穗期致病力测定:于小麦扬花期采用单小花滴注接种法[11]接种浓度为1 × 105~ 2 × 105个/mL的病原菌分生孢子悬浮液。每个菌株接种10 个麦穗,每个麦穗接种10 μL 孢子悬浮液。接种后每天喷雾保湿,第28 天时统计发病小麦穗数。
1.4 交互抗性测定
采用菌丝生长速率法[10],分别测定亲本菌株和抗性突变体对DMIs 杀菌剂戊唑醇、丙环唑、丙硫菌唑、三唑酮、咪鲜胺和氰基丙烯酸酯类杀菌剂氰烯菌酯的敏感性,分析叶菌唑与这6 种杀菌剂之间有无交互抗性关系。
1.5 CYP51 基因序列以及基因表达分析
1.5.1 样品收集与处理 菌株在空白PDA 平板上预培养4 d 后收集菌丝,按照DNA 提取试剂盒说明提取DNA,采用Trizol 提取总RNA,按照PrimeScriptTM∏ 1st Strand cDNA Synthesis 试剂盒说明书方法合成cDNA。
1.5.2 引物的设计合成 根据EnsemblFungi 基因库中小麦赤霉病菌的14α-脱甲基酶P450 (CYP51)基因序列 (CYP51A,FGSG_04092;CYP51B,FGSG_01000;CYP51C,FGSG_11024) 设计基因开放阅读框 (ORF) 和启动子区域的扩增引物及荧光定量PCR 引物。所有引物由上海生工生物股份有限公司合成,引物序列以及扩增长度见表1。

表1 小麦赤霉病菌CYP51 基因扩增以及荧光定量分析引物Table 1 Primers used for amplifying CYP51 genes of Fusarium graminearum and qRT-PCR
1.5.3 PCR 反应体系和反应条件 ORF 和启动子区域扩增PCR 反应体系为50 μL,包含:dd H2O 18 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL, 10 mmol/L dNTP Mix 1 μL, 2 × Phanta Max Buffer 25 μL,10 μmol/L 上下游引物各2 μL,模板DNA 1 μL。PCR 反应条件:95 ℃预变性3 min;95 ℃变性15 s,退火15 s,72 ℃延伸(30 s/kb ),共35 个循环;72 ℃终延伸5 min。扩增产物于1%琼脂糖凝胶中电泳检测。使用Axy PreP TM DNA Gel Extraction Kit 回收目的扩增片段,将回收产物送上海生工生物股份有限公司测序,通过Blast 软件进行亲本和抗性突变体中CYP51基因序列比对。
qRT-PCR 反应体系为20 μL,包含:dd H2O 6 μL,2 × SYBR Premix Ex Taq 10 μL (TaKaRa),ROX reference dye ∏ 0.4 μL,10 μmol/L 上下游引物各0.8 μL,模板cDNA 2 μL。扩增曲线PCR 反应条件:95 ℃预变性20 s;95 ℃变性3 s,60 ℃退火30 s,循环40 次;72 ℃单点检测信号。溶解曲线PCR 反应条件:95 ℃变性15 s,60 ℃退火1 min,95 ℃变性15 s,连续检测信号。采用 2−△△Ct法对基因表达数据进行相对定量分析。
1.6 数据分析
试验结果数据采用DPS 处理系统的LSD 法进行统计分析。
2 结果与分析
2.1 小麦赤霉病菌对叶菌唑的敏感性
供试100 株小麦赤霉病菌对叶菌唑的敏感性分布见图1。其中,EC50值最高为0.51 μg/mL,最低为0.04 μg/mL,相差12.75 倍;平均EC50值为(0.18 ± 0.09) μg/mL。供试菌株群体对叶菌唑的敏感性频率分布呈近似正态的连续性单峰曲线,尚未出现抗药性亚群体,因此可将所得平均EC50值作为其敏感性基线的参考值,用于监测田间抗药性的演化。
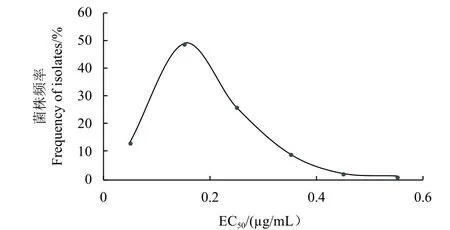
图1 供试100 株小麦赤霉病菌对叶菌唑的敏感性频率分布Fig. 1 Sensitivity distribution of 100 isolates of Fusarium graminearum to metconazole
同一省份中不同菌株对叶菌唑的敏感性存在差异,其中差异最大的是山东省的菌株,其EC50最大值和最小值相差9.9 倍;差异最小的是河南省的菌株,最大值和最小值相差3.9 倍。不同省份菌株之间对叶菌唑的敏感性差异不显著,4 个省份菌株的平均EC50值范围为0.15 ~ 0.20 μg/mL (表2) 。
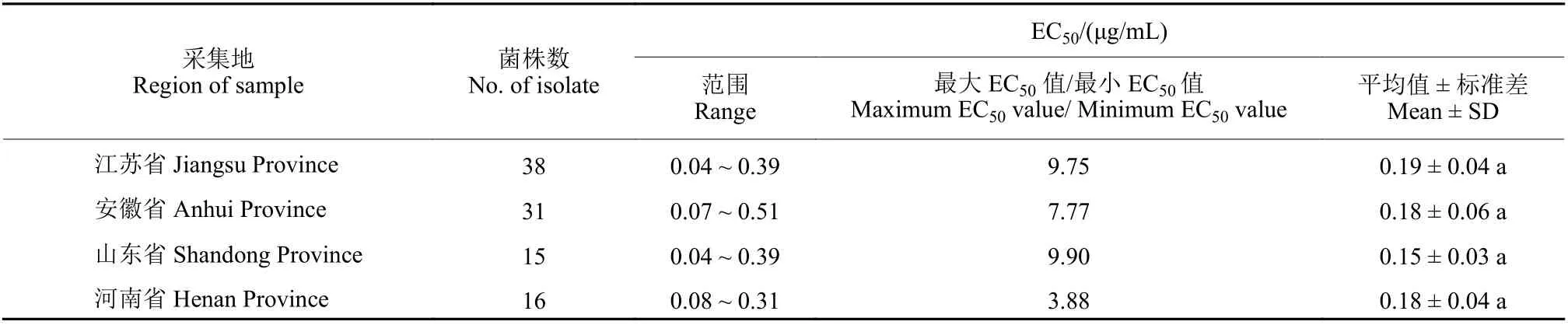
表2 不同省份小麦赤霉病菌对叶菌唑的敏感性Table 2 Sensitivity of F. graminearum from different provinces to metconazole
2.2 抗性突变体及其抗性水平
叶菌唑对5 株亲本菌株分生孢子萌发的MIC值为2 μg/mL。通过药剂驯化共获得46 株疑似抗性突变体,在空白平板上转接8 代后,有12 株仍表现为抗性,其中2 株抗性水平分别为14.20 和15.80 倍,表现为中抗,其余10 株抗性水平在3.25 ~ 9.05 倍之间,表现为低抗 (表3) 。

表3 抗性突变体及亲本菌株对叶菌唑的敏感性Table 3 Sensitivity of mutants and their parent isolates to metconazole
2.3 抗性突变体的生存适合度
与亲本菌株相比,部分抗性突变体的菌丝生长速率及产分生孢子能力下降,部分抗性突变体与亲本菌株相似;所有抗性突变体对小麦穗的致病力均显著降低,其中F1405-M1、F1405-M10和F1407-M1 菌株几乎完全丧失了致病力 (表4) 。

表4 抗性突变体及亲本菌株的生存适合度Table 4 Fitness of metconazole-resistant mutants and their parent isolates
2.4 交互抗性
在12 株叶菌唑抗性突变体中,由F1321 诱导获得的4 株抗性突变体抗性倍数较高,因此选择这4 株抗性突变体及其亲本菌株进行交互抗性研究。结果 (表5) 表明:5 种DMIs 杀菌剂对亲本菌株F1321 的抑制活性存在差异,其中,丙硫菌唑、戊唑醇和咪鲜胺活性较好,三唑酮活性较差。4 株叶菌唑抗性突变体对戊唑醇均表现为抗性,抗性倍数在3.68 ~ 16.73 之间;对丙硫菌唑和三唑酮均表现为敏感;F1321-M1 和F1321-M4 对丙环唑和咪鲜胺表现为抗性。所有抗性突变体对氰烯菌酯均表现为敏感。
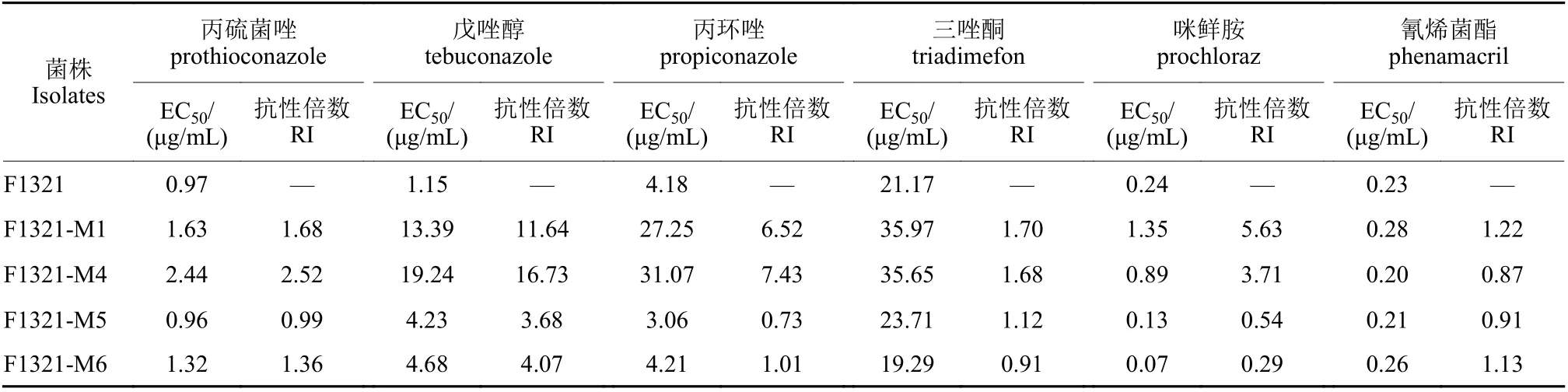
表5 亲本菌株F1321 及其叶菌唑抗性突变体对其他杀菌剂的敏感性Table 5 Sensitivity of parent isolate F1321 and its metconazole-resistant mutants to other fungicides
2.5 CYP51 基因序列及基因表达
与亲本菌株F1321 相比,4 株抗性突变体的CYP51A、CYP51B和CYP51C基因的ORF 及启动子区域序列均未发生突变。其中,CYP51C基因在亲本菌株和抗性突变体中表达量均较低,无法定量进行差异分析;CYP51A基因在4 株抗性突变体中表达量均上调,上调倍数范围为1.33 ~ 10.28;CYP51B基因在抗性突变体F1321-M1 中表达量上调,在F1321-M4、F1321-M5 及F1321-M6中表达量下调 (图2) 。

图2 CYP51A (FGSG_04092) 和CYP51B (FGSG_01000)在抗性突变体及其亲本菌株中的相对表达量Fig. 2 Relative expression levels of CYP51A(FGSG_04092), and CYP51B (FGSG_01000) in metconazole-resistant mutants and their corresponding parental isolate
3 讨论与结论
近十多年来,我国小麦赤霉病流行形势仍然严峻,病害防控中主要还是依赖氰烯菌酯、戊唑醇和丙硫菌唑等杀菌剂,为了延缓现有杀菌剂的使用寿命,开发使用一些全新的或者还未在我国小麦赤霉病防治上登记使用的杀菌剂迫在眉睫。
建立病原菌对杀菌剂的敏感性基线对检测田间菌株敏感性变化具有重要意义,目前已有一些关于小麦赤霉病菌对叶菌唑敏感性的研究报道。Spolti 等[12-13]的研究表明,叶菌唑对 2009–2010 年采自巴西不同地区的50 株小麦赤霉病菌的EC50值范围为0.001 ~ 0.324 μg/mL,对2011 年采自美国纽约州不同地区的50 株小麦赤霉病菌的EC50值范围为0.05 ~ 0.86 μg/mL。段亚冰等[14]测得叶菌唑对我国江苏省67 株小麦赤霉病菌的EC50值范围为0.02 ~ 0.08 μg/mL。本研究测定的100 株小麦赤霉病菌对叶菌唑的敏感性水平与Spolti 等和段亚冰等的结果相近,EC50值范围为0.04 ~ 0.51 μg/mL。所测100 株小麦赤霉病菌对叶菌唑的敏感性频率分布呈近似正态的连续性单峰曲线,尚未出现抗药性亚群体,因此可将其平均EC50值作为田间小麦赤霉病菌对叶菌唑抗性监测的参考指标。本研究采用的菌株样本覆盖了我国多个小麦主产区省份,因此所建立的敏感性基线参考值具有更广的适用性。
DMIs 具有广谱的抗菌活性,常用于医学和农业领域多种真菌病害的防治。该类药剂主要作用于细胞膜上麦角甾醇的合成过程,病原菌对其产生抗性与靶标基因14α-脱甲基酶P450 基因(CYP51)的点突变或过量表达、ABC 和MFS 转运蛋白的过量表达相关[15]。虽然杀菌剂抗性行动委员会 (FRAC) 把该类药剂划分为低到中等抗性风险[15],但由于长期重复使用,部分病原菌对其已经产生抗性[7-8,16-21]。欧美等国家1990 年左右已将DMIs 药剂广泛用于小麦上病害的防治,其中叶菌唑、丙硫菌唑以及丙硫菌唑和戊唑醇的复配药剂都被认为是防治小麦赤霉病的有效药剂[22]。近几年来,DMIs 在我国已被广泛用于小麦赤霉病的防治,其中主要以戊唑醇单剂、咪鲜胺和戊唑醇复配药剂以及氰烯菌酯和戊唑醇复配药剂为主,但关于小麦赤霉病菌对DMIs 抗性的研究报道仍较少。Spolti 等[13]测定了50 株采自美国纽约地区的小麦赤霉病菌对戊唑醇和叶菌唑的敏感性,发现这50 株菌株对叶菌唑仍表现为敏感,其中2 株菌株对戊唑醇表现为低抗。尹燕妮等[7]于2009 年检测了159 株小麦赤霉病菌对戊唑醇的敏感性,其中3 株表现为低抗。因此,根据已有报道看,小麦赤霉病菌对DMIs 的田间抗性风险较小。本研究发现,部分叶菌唑抗性突变体对戊唑醇、丙环唑及咪鲜胺也表现为抗性,对丙硫菌唑和三唑酮则未表现抗性;部分突变体仅对戊唑醇表现为抗性,对其他DMIs 药剂则不表现抗性,这种现象在已有的研究中也有报道。段亚冰等[14]测定了5 株叶菌唑抗性突变体对其他DMIs 药剂的敏感性,发现有2 株对种菌唑 (ipconazole) 、咪鲜胺、氟环唑 (epoxiconazole) 、苯醚甲环唑和戊唑醇也表现为抗性,有3 株对种菌唑和咪鲜胺表现为敏感,对氟环唑、苯醚甲环唑和戊唑醇表现为抗性。Spolti 等[13]研究发现,田间戊唑醇抗性菌株对叶菌唑表现为敏感。上述研究表明DMIs 药剂之间存在复杂的交互抗性关系。本研究中获得的4 株抗性突变体的CYP51A基因表达量均上调,但它们对其他DMIs 药剂的交互抗性表现却不一致,表明可能还存在其他的抗性机制。后续需要进一步针对DMIs 药剂的抗性机制进行研究,以便进一步明确它们之间的交互抗性关系。
相关报道表明,病原菌对DMIs 杀菌剂产生抗性的机制主要与CYP51基因的点突变或过量表达相关[15]。本研究对4 株叶菌唑抗性突变体的CYP51基因进行了检测,发现4 株抗性突变体的CYP51A、CYP51B和CYP51C基因序列均未发生突变,但CYP51A基因表达量均有所上调,上调倍数最高为10.28。Schnabel 等[23]比较了未使用过和使用过多年DMIs 杀菌剂果园采集的苹果黑腥病菌Venturia inaequalis CYP51A的表达量,发现抗性菌株的CYP51A表达量显著高于敏感菌株,且部分抗性菌株的CYP51A启动子区域有553 bp片段的插入。Stammler 等[24]研究发现,110 株小麦叶锈病菌Puccinia triticina对氟环唑的敏感性与其CYP51基因的表达具有一定相关性 (r=0.56),部分对氟环唑敏感性下降的菌株其CYP51基因表达量高于敏感菌株。Liu 等[25]的研究表明,DMIs杀菌剂戊唑醇能够激活病原菌体内的高渗透甘油(H O G) 激酶信号途径,该途径上被激活的Hog1 激酶进入细胞核,进而磷酸化转录因子FgSR,磷酸化的FgSR 将染色质重塑复合体SWI/SNF 插入到CYP51s基因的启动子区域,从而引起CYP51A和CYP51B基因的高水平转录。本研究中4 株叶菌唑抗性突变体的3 个CYP51基因启动子区域均未发生改变,其CYP51A和CYP51B基因表达量改变的机制还需进一步研究。
综上所述,本研究通过药剂驯化方法获得小麦赤霉病菌抗叶菌唑突变体,并对突变体的适合度进行了研究,发现在离体条件下小麦赤霉病菌对叶菌唑易产生抗性,但抗性水平较低,且抗药性菌株的适合度下降,表明小麦赤霉病菌对叶菌唑的抗性风险较低。因此,叶菌唑可作为我国小麦赤霉病防治药剂,但需做好其田间抗性监测,建议与作用机制不同的药剂混合或交替使用,以延缓抗性产生,延长药剂使用寿命。
