氧化苦参碱对皮肤创面愈合中PCNA、α-SMA及Type Ⅰ collagen的影响
2022-02-21刘俊梅刘彦红戴贵东
刘俊梅,刘彦红,李 娟,戴贵东,郑 萍
氧化苦参碱(OMT)是宁夏苦豆子中单体化合物,是一种具有四环喹嗪啶类结构的生物碱,分子式为C15H24N2O2。相关文献表明,氧化苦参碱具有多种药理作用,如抗血管、抗心律失常、抗肿瘤、杀菌、抗炎等[1-4]。创面愈合过程中,多种炎症因子及细胞修复共同参与其中,而氧化苦参碱对其是否具有作用,目前国内外未见相关报道。本实验旨在以小鼠背部全层皮肤缺损为实验模型,应用氧化苦参碱进行干预,探讨其对小鼠皮肤创面愈合的影响及可能机制,为临床创面愈合提供实验依据。
1 资料与方法
1.1 一般资料:清洁级♂昆明种小鼠,体重(22±2)g,由宁夏医科大学实验动物中心提供,动物合格证号:SYXK(宁)2009-0003。
1.2 药品与试剂:氧化苦参碱购自宁夏紫荆花药业股份有限公司,纯度:99.8%,批号:P0100226;戊巴比妥钠和多聚甲醛购自Sigma公司;α-平滑肌肌动蛋白(α-SMA)检测试剂盒和血清增殖细胞核抗原(PCNA)检测试剂盒购自ImmunoWay公司;细胞Ⅰ型胶原蛋白(Collagen Ⅰ)检测试剂盒购自abcam公司;实验用水为超纯水。
1.3 主要仪器:PMZ000型病理图像分析系统(德国LEICA公司);MIAS2000病理图像分析软件(川大智胜软件公司);Rm2015型切片机(德国LEICA公司);数码相机(日本尼康公司);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
1.4 实验方法
1.4.1 小鼠皮肤创面制备及实验动物分组:1%戊巴比妥钠麻醉小鼠,背部去毛,暴露皮肤,用2%碘酒和75%酒精依次消毒后,背部正中剪除全层皮肤,制备1.5 cm×1.5 cm正方形伤口,创面自然干燥,止血。制备创面后,24只♂小鼠随机分为4组:创面对照组,氧化苦参碱低、中、高剂量组(20、40、80 mg/kg),除创面对照组给予等体积生理盐水外,其余各组分别按20、40和80 mg/kg给予氧化苦参碱灌胃,每天1次,共14 d。实验第3、5、7、9、11、14 d,每组分别取6只小鼠称重,戊巴比妥钠过量麻醉处死。
1.4.2 小鼠皮肤创面观察:①观察指标:每天观察并记录小鼠毛色、摄食、饮水及活动情况,包括创面色泽、质地、有无渗液、是否感染、水肿、肉芽组织生长情况等。在1、3、5、7、9、11、14 d时麻醉小鼠,描绘未愈合皮肤创面。②描绘创面面积:将描绘的创面区域均匀涂黑,采用清华紫光A900扫描仪及美国Image-Pro PlusVersion6.0(IPP)图像分析软件分析并计算各组小鼠未愈合创面面积,与原创面面积比较,评价创面愈合情况。③小鼠皮肤创面组织的Van Gieson染色:实验第 3、5、7、9、11和14 d 时,从创面组织正中线处剪开,取左侧一半创面组织及周边正常皮肤,10%多聚甲醛内固定24 h后,用流水冲洗3 h,然后梯度乙醇脱水、常规石蜡包埋、切片。酸性复红和苦味酸以1∶9比例混合,配成VG染色液染色30 s,用分化液分化4 s后脱水,透明,用中性树胶封片。载玻片置于400倍光学显微镜下,观察小鼠皮肤创面处胶原纤维生长情况并采图。
1.5 小鼠皮肤创面组织中PCNA、α-SMA和Type Ⅰ collagen的免疫组织化学方法检测:石蜡切片脱蜡、梯度乙醇脱水后,对组织进行高压热抗原修复,室温冷却,PBS冲洗3次,2 min/次(检测α-SMA的切片不修复)。3%H2O2阻断内源性过氧化物酶,置于室温孵育20 min,甩去液体,PBS冲洗3次,2 min/次,滴加一抗,室温孵育1.5~2 h(PCNA Polyclonal Antibody (YT3617)1∶400、α-SMA Polyclonal Antibody(YT5053)1∶1000、Anti-CollagenⅠantibody (ab34710)1∶800。PBS冲洗3次,2 min/次;除去PBS溶液后滴加二抗,室温孵育30 min,PBS冲洗3次,2 min/次;除去PBS溶液后,将新配置的DAB显色工作液滴于载玻片上,显微镜下观察2~8 min;自来水终止反应;切片经梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。阴性对照用PBS代替一抗。

2 结果
2.1 氧化苦参碱对小鼠皮肤创面愈合的外观观察:小鼠皮肤创面随时间逐渐被新生肉芽组织填充,上皮覆盖,部分毛发生成。第1 d,各组小鼠皮肤创面边缘收缩,创面无感染。第3、5 d,创面对照组创面较干燥,分泌物较少,创面有肉芽组织充填,肉芽较粗大;氧化苦参碱各组创口周围毛发明显生长,创面较为湿润,肉芽组织色泽红润、肉芽略显细小,生长良好。第7、9 d,各组创面已形成瘢痕,触之较硬,结痂易碎。第11 d,各组小鼠皮肤创面微小,已无结痂覆盖。第14 d,各组小鼠皮肤创面基本愈合。
2.2 氧化苦参碱对小鼠皮肤创面未愈合面积的影响:描绘小鼠皮肤未愈合创面面积结果显示,各组小鼠皮肤创面描绘面积随时间推移不断缩小,直至创面愈合。与创面对照组相比,氧化苦参碱20 mg/kg组在第5 d,氧化苦参碱40 mg/kg组在第7、11 d 时小鼠未愈合面积显著减小(P<0.05);其余各时间点,氧化苦参碱组与创面对照组小鼠创面未愈合面积差异无统计学意义(P<0.05),见表1。
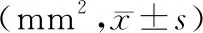
表1 氧化苦参碱对小鼠皮肤创面未愈合面积的影响
2.3 氧化苦参碱对小鼠皮肤创面组织VG染色的影响:伤后第11 d,创面对照组的创面几乎被肉芽组织充填,皮肤创面中纤维细胞呈细长梭状,排列紊乱,胶原纤维增生不明显;氧化苦参碱各给药组创面几乎完全被肉芽组织充填,且成纤维细胞减少,纤维细胞明显增多,肉芽组织新生胶原纤维排列整齐。镜下可观察到阳性细胞在近创缘组织、创面基底部、新生的肉芽组织和表皮细胞中逐渐增加表达,但维持水平及时间各实验组存在差异。氧化苦参碱20 mg/kg组创面中α-SMA第3 d 最低,之后开始上升,在愈合中、后期表达量大幅度增加,到第9、11 d 时达最高峰。氧化苦参碱40、80 mg/kg组中α-SMA的表达呈现较平稳趋势。氧化苦参碱40 mg/kg组Type Ⅰ collagen表达在第3 d 时最低(P<0.05),到第5 d 时达高峰,之后下降再上升,呈波浪形表达。氧化苦参碱80 mg/kg组Type Ⅰ collagen第3 d 最低(P<0.05),之后开始迅速上升,到第7 d 时表达显著性升高(P<0.05),之后逐渐下降,见表2。

表2 小鼠皮肤创面组织中PCNA、α-SMA、Type Ⅰ collagen含量组织学评分结果(分,
3 讨论
在皮肤创面形成早期,机体免疫系统被激活,较多中性粒细胞浸润,随后出现单核细胞、巨噬细胞浸润[5]。入侵微生物被炎症细胞吞噬,并通过炎症细胞释放各种细胞因子和生长因子促进创面的修复。研究结果显示,氧化苦参碱使小鼠创面愈合过程的中、后期未愈合创面面积显著减小;Van Gieson染色结果显示,氧化苦参碱组创面被新生表皮覆盖,新生纤维胶原与表皮平行生长,呈现有序排列,较创面对照组肉芽组织填充更快,新生毛细血管增多,促进创面早期修复[6-7],以给药第9 d及第11 d效果最为明显。提示氧化苦参碱可促进小鼠皮肤创面愈合。
PCNA是评价细胞增殖状态的重要指标[8-9]。静止的细胞PCNA几乎不表达。皮肤组织中的PCNA主要定位于表皮基底层细胞、毛囊上皮细胞、血管内皮细胞及部分成纤维细胞的细胞核内,在皮肤组织的发生与修复过程中PCNA表达增强[10]。研究表明,通过YAG 激光及强脉冲光激光多次刺激小鼠皮肤,增强了PCNA 表达,使皮肤细胞增殖活性增强,促进皮肤结构重建,达到促进创面愈合的效果[11]。本实验研究结果显示,在愈合过程中,氧化苦参碱(20、40、80 mg/kg)组在7 d 时PCNA 表达高于创面对照组,对小鼠创面组织细胞的增殖具有促进作用。提示在小鼠创面愈合过程中、后期,氧化苦参碱使PCNA表达显著增加。
α-SMA是一种异常的纤维细胞-肌纤维母细胞,与创面收缩关系密切[12-13]。目前认为,α-SMA 的表达使肌成纤维细胞的收缩能力增加,使肉芽组织纤维化,促进结缔组织的形成[14]。本实验研究发现,α-SMA 在创面形成初期3 d 时开始表达。氧化苦参碱(20 mg/kg)组的α-SMA随时间表达量逐渐增加,到创面愈合中、后期α-SMA表达量较高,而未愈合创面面积明显减小。提示氧化苦参碱促进小鼠皮肤创面愈合与α-SMA表达有关。
成纤维细胞是创面愈合过程中的主要细胞,成纤维细胞合成的胶原是细胞外基质的主要成分,其中包括Type Ⅰ collagen,细胞依附其生长。当成纤维细胞生长受到抑制,细胞形态会发生明显改变,Type Ⅰ collagen分泌减少,从而影响创面愈合[15]。本实验研究发现,创面对照组的VG染色显示新生纤维胶原的增加主要见于真皮全层,可见分布均匀、排列稀疏、呈波浪样、红色深染胶原纤维束,而氧化苦参碱各组小鼠损伤部位皮肤胶原纤维染色略深,成熟胶原增加,但以浅层变化较为明显。免疫组织化学结果显示,小鼠皮肤创伤后,Ⅰ型胶原纤维在创伤愈合早、中期排列较为紊乱;愈合后期第7、9 d时Ⅰ型胶原纤维排列较为规律;组织学评分结果显示,氧化苦参碱各给药组Ⅰ型胶原纤维的表达在愈合过程各时间点的整体水平高于创面对照组,各组呈现由低到峰值再下降的趋势。提示氧化苦参碱可增加小鼠皮肤创面中Ⅰ型胶原纤维的表达。
综上所述,氧化苦参碱能增加皮肤创面的愈合中PCNA、α-SMA及Type Ⅰ collagen的表达。由于创面愈合过程复杂,影响因素众多,氧化苦参碱对创面愈合的影响是否通过其他作用靶点,还需要进一步研究。
