酵母硒和亚硒酸钠对育肥湖羊组织硒含量、抗氧化能力、肉品质及货架期的影响
2022-02-20寇宇斐李发弟张兆才
白 雪 寇宇斐 郭 涛 李 飞 李发弟 张兆才 郭 龙*
(1.兰州大学草地农业科技学院,兰州大学草地农业生态系统国家重点实验室,农业农村部草牧业创新重点实验室,兰州 730020;2.甘肃润牧生物工程有限责任公司,金昌 737100)
硒是人和动物必需的微量元素,参与机体多种生理活动。有研究表明硒元素具有预防和治疗癌症的潜力[1-2],可降低心脏病死亡率[3]、有效预防骨骼疾病[4]。在动物生产中,适量的补充硒有利于提高动物的生产性能并增加肌肉等组织中硒的沉积[5-7],可生产富硒动物产品。现阶段,我国畜牧行业发展不仅仅着眼于扩大生产量,也将重点转移至如何生产出符合消费者要求的高质量产品,富硒动物产品就是其中之一。世界卫生组织建议成年人每日硒摄入量为55 μg[8],普通的饮食和饮水很难满足该标准,因此通过在动物饲养过程中添加硒添加剂生产天然富硒动物产品成为增加人类每日硒摄取量的有效途径。湖羊是我国广泛养殖的肉绵羊品种,其产肉性能优良,同时具备高繁殖力。利用湖羊生产高品质的富硒羊肉,不仅可提高湖羊羊肉产品的经济价值和湖羊自身的繁殖能力,同时可为人类提供优良的富硒羊肉产品,解决缺硒带来的健康问题。基于此,本试验在基础饲粮中分别添加0.4 mg/kg(以硒计)的酵母硒与亚硒酸钠,比较有机硒与无机硒对于育肥湖羊组织硒含量、抗氧化能力、肉品质及货架期的影响,为科学高效生产富硒湖羊肉产品提供理论依据。
1 材料与方法
1.1 试验材料
试验用酵母硒(硒含量为2 000 mg/kg)和亚硒酸钠(硒含量为10 000 mg/kg)添加剂均为市购。
1.2 试验设计
试验选取24只4月龄湖羊公羔[初始体重(31.99±3.60) kg],随机分为3组,每组8只。3组湖羊分别饲喂基础饲粮(CON组,作为对照组)、基础饲粮+0.4 mg/kg(以硒计)酵母硒(SY组)和基础饲粮+0.4 mg/kg(以硒计)亚硒酸钠(SS组),各组饲粮实际硒含量见表1。基础饲粮参照我国《肉羊饲养标准》(NY/T 816—2004)与《饲料中硒的允许量》(GB 26418—2010)配制,并制成全混合颗粒饲料,其组成及营养水平见表2。整个饲养试验包括14 d的过渡期和42 d的正试期。

表1 各组饲粮实际硒含量(干物质基础)Table 1 Selenium actual content of diets in different groups (DM basis) mg/kg

表2 基础饲粮组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of the basal diet (DM basis) %

续表2项目 Items含量 Content营养水平 Nutrient levels有机物 Organic matter93.54粗脂肪 Ether extract3.27粗蛋白质 Crude protein14.51中性洗涤纤维 Neutral detergent fiber48.51酸性洗涤纤维 Acid detergent fiber19.44
1.3 饲养管理
饲养试验在兰州大学草地农业科技学院民勤试验基地完成。每组的8只试验羊群饲,每天08:00和18:00各饲喂1次,自由采食、饮水。试验过渡期开始前,对试验用地进行规划、清扫与消毒。
1.4 消化代谢试验
在正试期结束前6天,每组随机选取6只试验羊放入代谢笼中,栏位适应期3 d,采样期3 d。将3 d收取的粪样充分混匀后,一部分用10%盐酸固氮放于棕色瓶中保存,用于粪氮含量测定;一部分放于铝盒中65 ℃烘干,用于常规养分分析,计算各养分消化率。
1.5 屠宰试验
全部试验动物于正试期结束后第2天早晨分批饲喂,饲喂2 h后通过颈动脉放血法屠宰,采集瘤胃液、背最长肌、心脏、肝脏、肾脏、毛发及尾脂,-80 ℃冷冻保存。用便捷式pH计(雷磁PHB-4,上海)测定瘤胃液pH,然后采集10 mL瘤胃液于冻存管中,-20 ℃保存,用于测定瘤胃发酵参数,并取适量背最长肌进行肉品质测定。
1.6 测定指标及方法
1.6.1 养分消化率测定
根据张丽英[9]提供的常规方法测定饲粮及粪便的干物质(dry matter,DM)、粗蛋白质(crude protein,CP)、粗脂肪(ether extract,EE)、粗灰分(Ash)、中性洗涤纤维(neutral detergent fibre,NDF)及酸性洗涤纤维(acid detergent fibre,ADF)含量,饲粮及粪便的酸不溶灰分含量参考董淑慧[10]的方法测定。采用酸不溶灰分法测定饲粮各养分消化率。
1.6.2 瘤胃液挥发性脂肪酸(VFA)含量测定
参照梁玉生[11]的方法提取瘤胃液中的VFA:将瘤胃液于4 ℃解冻后2 500×g离心5 min,取5 mL离心后的上清液加入到已有1 mL 25%偏磷酸的离心管中,4 ℃静置约3 h。放置完成后4 ℃条件下3 000×g离心10 min,之后取2 mL上清液再在4 ℃条件下12 000×g离心15 min,结束后用0.45 μm有机滤膜过滤,吸取1 mL滤后液体与200 μL的1%巴豆酸充分混合后待测。使用气相色谱仪(Thermo Scientific,TRACE 1300,Milan,意大利)测定瘤胃液VFA含量,根据王志兰[12]的方法进行测定。
1.6.3 肉品质测定
屠宰后45 min测定湖羊背最长肌的肉色与pH,测定完成后,将肌肉样品放于4 ℃、90%湿度条件下排酸24 h,再进行后续肉品质指标的测定。
弹性(springiness)、胶黏性(gumminess)、咀嚼性(chewiness):将背最长肌修剪为长、宽、高均为1 cm的正方体,通过质构仪(TMS-Pro)测定弹性、胶黏性及咀嚼性,测定3次,计算平均值。
肉色:对宰后45 min和24 h的背最长肌进行肉色检测。通过手持式色差仪(CR-400/410)测定肌肉亮度(lightness,L*)、红度(redness,a*)和黄度(yellowness,b*)值。
pH:用便捷式pH计测定屠宰后45 min和24 h背最长肌的pH,每个样品测定3次,取平均值。
滴水损失(drip loss):以5 cm×3 cm×2 cm的标准修剪背最长肌,将修剪后的3个相似长条肌肉一头挂在塑料瓶中,在4 ℃冰箱中静置24 h后称重,计算滴水损失。
滴水损失(%)=[(贮存前重量-贮存后重量)/贮存前重量]×100。
失水率(water loss rate):修剪直径约3 cm的圆形背最长肌肉样3块,称重记录,上下各垫18层定性滤纸,设定压力值为135 kPa,时间为5 min,取出称重,计算失水率。
失水率(%)=[(压前重量-压后重量)/压后重量]×100。
蒸煮损失(cooking loss):取背最长肌200 g左右,称重后用纱布包裹并编号,置于蒸锅的笼屉上,1 000 W状态下加热30 min,拿出待冷却至室温时用滤纸吸干表面水分,称重,计算蒸煮损失。
蒸煮损失(%)=[(蒸煮前重量-蒸煮后重量)/蒸煮前重量]×100。
剪切力(shear stress):将测定蒸煮损失后的肉样延肌纤维方向修剪为长短、粗细相似的圆柱体约10块,通过肌肉嫩度剪切力仪(NDY-100-200-A)测定剪切力,计算平均值。
挥发性盐基氮(TVB-N)含量:参照食品安全国家标准《食品中挥发性盐基氮的测定》(GB 5009.228—2016)[13],将背最长肌样品去除脂肪、骨等组织,绞肉机绞碎拌匀,称取肉样约5.0 g置于烧杯中,记录数值,准确加入30 mL水,搅拌均匀,浸渍30 min后过滤,留滤液,4 ℃冰箱保存待测。TVB-N含量用半自动凯氏定氮仪(K9840,海能仪器股份有限公司,济南)测定。
货架期:根据3组背最长肌样品于4 ℃冰箱中储藏24、48、72、96和120 h后测定的挥发性盐基氮含量(mg/100 g),以国家标准中规定的挥发性盐基氮=15 mg/100 g为标准拟合CON组、SY组和SS组的标准曲线,得到相关线性方程以计算3组肉样到达国家标准的时间,即为货架期。
1.6.4 抗氧化指标测定
在正试期第1、21和42天晨饲前进行颈静脉采血,血液样本3 000 r/min离心15 min后取上清,用于检测抗氧化指标。血清中过氧化氢酶(CAT,A007-1-1)、超氧化物歧化酶(SOD,A001-3)、谷胱甘肽过氧化物酶(GPx,A005)活性和总抗氧化能力(T-AOC,A015-1)以及血清与肌肉中丙二醛(MDA,A003-1)含量均使用南京建成生物工程研究所生产的试剂盒检测,并严格根据试剂盒说明书进行操作。
1.6.5 硒含量测定
采用微波消解法对不同样品进行前处理,消解仪器为多通量密闭微波化学工作站(JUPITER-B,新仪微波化学科技有限公司,上海),消解操作如下。
饲粮样品:事先粉碎,准确称取0.500 0 g左右,记录数值,向消解管中加入10 mL硝酸,浸泡过夜,后补加1 mL过氧化氢,上机运行,消解程序设定为150 ℃ 10 min、180 ℃ 5 min、200 ℃ 25 min。
背最长肌样品:切薄片冻干48 h,准确称取0.200 0 g左右,记录数值,加入7 mL硝酸和2 mL过氧化氢,上机消解,消解程序设定为150 ℃ 10 min、180 ℃ 5 min、200 ℃ 25 min。
各内脏样品:冻干48 h,准确称取0.200 0 g左右,记录数值,加入8 mL硝酸和1 mL过氧化氢,上机消解,消解程序为150 ℃ 10 min、190 ℃ 15 min。
尾脂样品:直接剪碎,称取0.300 0 g左右,记录数值,加入8 mL硝酸和1 mL过氧化氢,上机消解,消解程序为150 ℃ 10 min、190 ℃ 15 min。
血清样品:取0.5 mL,加入8 mL硝酸,放置1 h,上机消解,消解程序为150 ℃ 10 min、190 ℃ 10 min。
毛发样品:温水洗净晾干,取0.200 0 g,加入6 mL硝酸和1 mL过氧化氢,上机消解,消解程序为150 ℃ 10 min、180 ℃ 10 min。
消解结束后使用赶酸仪(BHW-09A45,博通化学科技有限公司,上海)160 ℃赶酸至最后1滴液体,超纯水冲洗转移至50 mL容量瓶中定容,用0.45 μm水系滤膜过滤杂质,4 ℃冰箱保存待测。
硒含量的检测使用电感耦合等离子体质谱仪(ICP-MS 7800, Agilent Technologies,日本),标准溶液使用无机元素混合溶液标准物质[GBW(E)081531,中国计量科学研究院,北京]。
1.6.6 肌肉中GPx基因表达测定
参考郭龙[14]的方法进行mRNA提取与cDNA合成。内参基因使用磷酸甘油醛脱氢酶(GAPDH),选取GPx1、GPx2、GPx3、GPx4基因进行实时荧光定量PCR,引物序列参考金海峰[15]设计的引物序列,具体信息见表3,引物由北京奥科鼎盛生物合成试验室合成。用CFX96荧光定量PCR仪(Bio-Rad,美国)进行PCR,反应体系为10 μL:cDNA 0.5 μL,SYBR Green Supermix 5 μL,上、下游引物各0.5 μL,RNase-free dH2O 3.5 μL;反应程序设定为95 ℃ 3 min,95 ℃ 3 s,40个循环,60 ℃ 30 s。目的基因mRNA表达量计算采用2-ΔΔCt方法。

表3 内参基因和目的基因的引物序列Table 3 Primer sequences of reference gene and target genes
1.7 数据统计与分析
血清抗氧化指标的显著性分析使用SPSS 25.0软件中的双因素方差分析(2个因子分别为硒源和作用时间),其他指标使用单因素方差分析来完成,并采用Duncan氏多重比较法来分析组间差异显著性。在本试验中P<0.05视为差异显著,0.05≤P≤0.10视为差异有显著的趋势,P>0.10视为差异不显著。
2 结果与分析
2.1 酵母硒和亚硒酸钠对育肥湖羊组织硒含量的影响
酵母硒和亚硒酸钠对育肥湖羊组织硒含量的影响如表4所示。各脏器中以肾脏的硒含量最高,心脏的硒含量最低。与CON组相比,2种硒源的添加显著提高了湖羊背最长肌和毛发的硒含量(P<0.05),2种硒源之间无显著差异(P>0.10)。SY组肝脏、肾脏与心脏的硒含量显著高于CON组(P<0.05)。与CON组和SY组相比,SS组血清的硒含量有显著降低趋势(0.05≤P≤0.10),而尾脂的硒含量不受硒源的显著影响(P>0.10)。

表4 酵母硒和亚硒酸钠对育肥湖羊组织硒含量的影响Table 4 Effects of selenium yeast and sodium selenite on selenium content in tissues of fattening Hu sheep (n=8)
2.2 酵母硒和亚硒酸钠对育肥湖羊血清抗氧化指标的影响
酵母硒和亚硒酸钠对育肥湖羊血清抗氧化指标的影响如表5所示。2种硒源对血清T-AOC和MDA含量有显著影响(P<0.05)。与CON组相比,添加酵母硒和亚硒酸钠显著提高了血清T-AOC(P<0.05),显著降低了血清MDA含量(P<0.05),对血清CAT、SOD和GSH-Px活性无显著影响(P>0.10)。

表5 酵母硒和亚硒酸钠对育肥湖羊血清抗氧化指标的影响Table 5 Effects of selenium yeast and sodium selenite on serum antioxidant indices of fattening Hu sheep (n=8)
分析硒作用时间对湖羊血清抗氧化指标的影响发现,随硒作用时间的增加,各组湖羊血清T-AOC和SOD活性均显著增加(P<0.05)。第42天时血清CAT和GSH-Px活性显著高于第1天和第21天时(P<0.05)。与第1天相比,第21天时血清MDA含量显著升高(P<0.05)。除血清CAT和SOD活性外,各血清抗氧化指标均存在硒源与作用时间的交互作用(P<0.05)。
2.3 酵母硒和亚硒酸钠对育肥湖羊肌肉抗氧化指标的影响
酵母硒和亚硒酸钠对育肥湖羊GPx基因在肌肉中表达的影响如图1所示。与CON组和SY组相比,SS组肌肉中GPx3的mRNA表达量显著上调(P<0.05);SS组肌肉中GPx4的mRNA表达量显著高于CON组(P<0.05);与CON组相比,SY组肌肉中GPx2的mRNA表达量显著降低(P<0.05);与CON组相比,添加酵母硒和亚硒酸钠对肌肉中GPx1的表达无显著影响(P>0.10)。
酵母硒和亚硒酸钠对育肥湖羊肌肉中MDA含量的影响如图2所示。SS组肌肉中MDA含量显著高于SY组(P<0.05),与CON组无显著差异(P>0.10)。

图2 酵母硒和亚硒酸钠对育肥湖羊肌肉中MDA含量的影响Fig.2 Effects of selenium yeast and sodium selenite on MDA content in muscle of fattening Hu sheep (n=8)
2.4 酵母硒和亚硒酸钠对育肥湖羊肉品质及货架期的影响
酵母硒和亚硒酸钠对育肥湖羊肉品质的影响如表6所示。SY组湖羊屠宰后24 h背最长肌pH显著低于CON组和SS组(P<0.05)。与CON组相比,添加酵母硒和亚硒酸钠均显著降低了屠宰后24 h背最长肌的亮度和黄度值(P<0.05),SY组与SS组之间无显著差异(P>0.10)。与CON组相比,SY组背最长肌的滴水损失显著增加(P<0.05),SY组与SS组背最长肌的胶黏性有显著增加的趋势(0.05≤P≤0.10)。其余肉品质指标各组均无显著差异(P>0.10)。

表6 酵母硒和亚硒酸钠对育肥湖羊肉品质的影响Table 6 Effects of selenium yeast and sodium selenite on meat quality of fattening Hu sheep (n=8)
图3显示了酵母硒和亚硒酸钠对育肥湖羊肌肉货架期的影响。3组湖羊背最长肌的TVB-N含量均随存放时间的延长呈上升趋势。CON组、SY组及SS组背最长肌达到判定为肉质腐败的国家标准中TVB-N含量的时间分别是85.8、87.2和71.2 h。

图3 酵母硒和亚硒酸钠对育肥湖羊肉货架期的影响Fig.3 Effects of selenium yeast and sodium selenite on meat shelf-life of fattening Hu sheep (n=8)
2.5 酵母硒和亚硒酸钠对育肥湖羊瘤胃发酵参数及养分消化率的影响
酵母硒和亚硒酸钠对育肥湖羊瘤胃发酵参数的影响如表7所示。SS组戊酸比例显著高于CON组和SY组(P<0.05),且有显著降低总挥发性脂肪酸(TVFA)含量的趋势(0.05≤P≤0.10)。与CON组相比,添加酵母硒和亚硒酸钠均显著降低了乙丙比(P<0.05),且有显著提高丙酸比例的趋势(0.05≤P≤0.10)。其余瘤胃发酵参数各组之间无显著差异(P>0.10)。
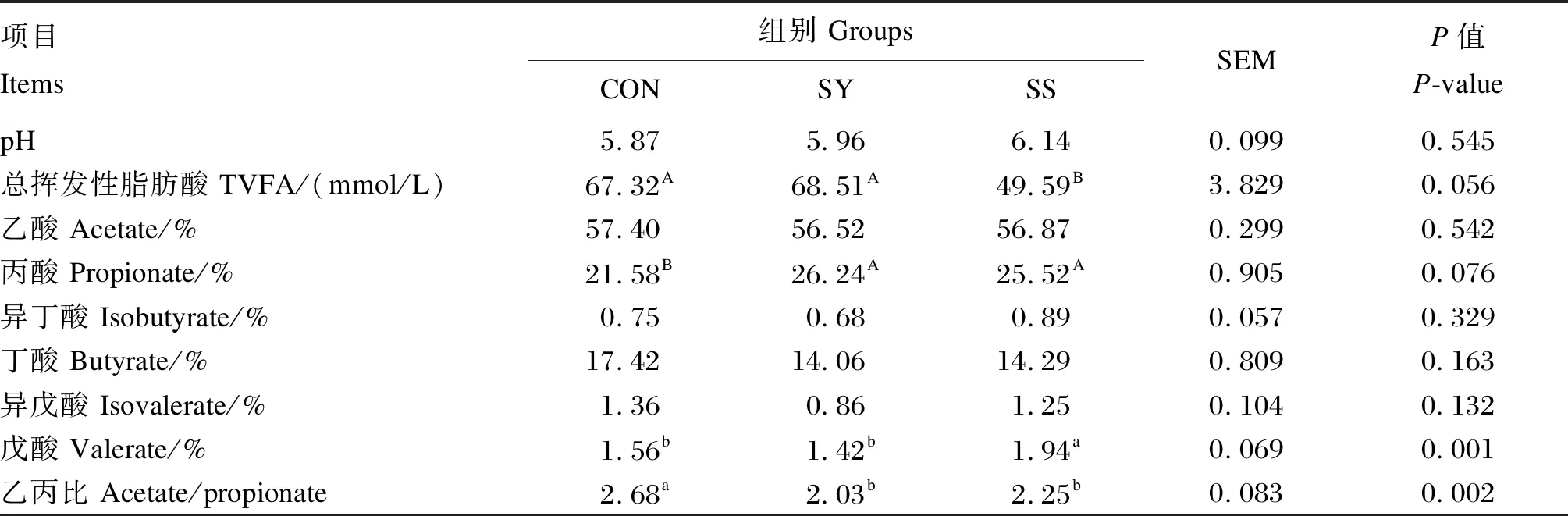
表7 酵母硒和亚硒酸钠对育肥湖羊瘤胃发酵参数的影响Table 7 Effects of selenium yeast and sodium selenite on rumen fermentation parameters of fattening Hu sheep (n=8)
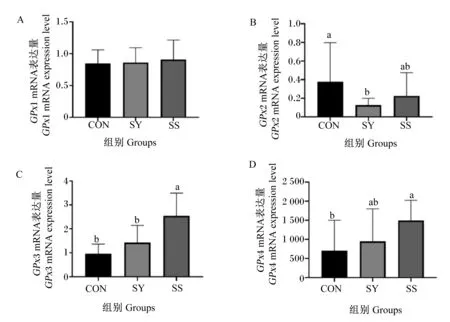
数据柱标注相同字母或无字母表示差异不显著(P>0.10),不同小写字母表示差异显著(P<0.05)。图2同。Data columns with the same letters or no letters mean no significant difference (P>0.10), while with different small letters mean significant difference (P<0.05). The same as Fig.2.图1 酵母硒和亚硒酸钠对育肥湖羊GPx基因在肌肉中表达的影响Fig.1 Effects of selenium yeast and sodium selenite on GPx gene expression in muscle of fattening Hu sheep (n=8)
由表8可知,与CON组相比,SS组和SY组CP消化率显著降低(P<0.05),ADF消化率显著提高(P<0.05),且SS组与SY组之间差异不显著(P>0.10)。

表8 酵母硒和亚硒酸钠对育肥湖羊养分消化率的影响Table 8 Effects of selenium yeast and sodium selenite on nutrient digestibility of fattening Hu sheep (n=8) %
3 讨 论
3.1 酵母硒和亚硒酸钠对育肥湖羊组织富硒规律的影响
不同组织硒含量不同,本试验中肾脏硒含量最多,这与Juniper等[6]和Taylor等[16]的研究结果相似。但Juniper等[17]还报道饲喂高剂量酵母硒饲粮(含硒6.30 mg/kg DM,饲喂91 d)的羔羊肝脏中硒的沉积量最高,其次是肾脏和心脏,与本研究结果不同可能是该研究中硒补充剂量更大且试验周期更长造成的。进一步分析动物体内脏器硒沉积规律是否与硒的饲喂剂量及硒源有关,本试验发现,与无机硒亚硒酸钠相比,添加有机硒酵母硒对于提高湖羊各脏器硒沉积量效果更佳。与之相似,Gresakova等[18]通过给羔羊饲粮中添加0.3 mg/kg的酵母硒和亚硒酸钠,显著提高了肝脏、肾脏和心脏的硒沉积量,且酵母硒富集效果显著高于亚硒酸钠。施力光等[19]研究发现,0.3 mg/kg有机硒[蛋氨酸硒(Se-Met)]的添加可显著提高奶山羊肝脏、脾脏、肾脏和肺脏的硒含量。但也有研究显示有机硒与无机硒对提高动物器官硒沉积的效果相似,例如,朱翱翔等[20]研究发现添加0.3、0.5 mg/kg酵母硒或0.3 mg/kg亚硒酸钠均可显著提高湖羊母羊肝脏的硒含量;Zhan等[21]研究发现,与对照组相比,添加0.3 mg/kg亚硒酸钠和蛋氨酸硒均可提高育肥猪肝脏和肾脏的硒含量。综上所述,不同硒源在湖羊组织中的沉积量与硒补充量和硒添加形式有关,但在机体内不同硒源的存在形式对沉积规律的影响还需进一步研究。
本试验中,饲粮添加酵母硒和亚硒酸钠显著提高了湖羊背最长肌中硒含量,2种硒源之间无显著差异。对冻干肌肉硒含量与肌肉中的水分含量进行换算,结果得出SY组与SS组鲜肉样中硒含量分别为198.34和150.33 μg/kg,均可达到多地关于富硒肉的地方标准中规定的硒含量[22-23],说明添加0.4 mg/kg DM的酵母硒和亚硒酸钠可用于商业化生产富硒羊肉,提高经济效益。
3.2 酵母硒和亚硒酸钠对育肥湖羊血清抗氧化能力的影响
硒的抗氧化功能主要通过GPx催化还原型谷胱甘肽氧化,吸收机体过剩的活性氧自由基(ROS),ROS作为机体有氧代谢的产物,当其超过机体自净范围后会产生脂质过氧化作用,破坏细胞的完整性,损害机体健康[24-25]。动物机体硒状态除了可以通过组织硒含量直接判定外,Rowntree等[26]和Gong等[27]曾报道血液和组织中GPx活性可以间接反映硒的状态。在本试验中,血清GPx的活性不受硒源的影响,这与各组血清硒含量无显著差异的结果相一致,Khalili等[28]也曾在奶牛的研究中报道过类似的结果。此外,本试验中有机硒和无机硒的添加均可有效减少脂质过氧化,改善血清抗氧化状态。与本结果相似,一些文献报道也说明低水平硒的添加可以提升机体抗氧化能力,例如,Sun等[29]比较了补充羟基硒代蛋氨酸(0.1、0.3、0.5 mg/kg DM)和亚硒酸钠(0.3 mg/kg DM)对奶牛抗氧化状态的影响,发现有机硒可显著提高血清GPx活性;武晓英等[30]给岢岚绒母山羊饲喂添加0.5 mg/kg纳米硒的饲粮,结果显示母羊血清中GPx与SOD活性显著上升。同时,血清中所有抗氧化酶的活性均随着时间的增加而升高,说明试验期内在动物体内硒有效富集并发挥抗氧化作用,抵御应激。
3.3 酵母硒和亚硒酸钠对育肥湖羊肌肉抗氧化能力的影响
硒蛋白是硒在反刍动物体内发挥生物学作用的重要载体,分别分布在不同组织中发挥抗氧化功能。其中GPx1广泛存在于各类细胞中;GPx2主要存在于动物肠胃中,对胃肠道中有效代谢脂质过氧化物有一定作用;GPx3主要存在于动物血浆及乳汁中,可把氢过氧化物还原成磷脂过氧化物,起到保护动物细胞膜的作用;GPx4在大多组织中均存在,对于雄性动物的精子发生至关重要[31]。本试验结果表明,在0.4 mg/kg DM硒添加水平下,亚硒酸钠更有利于GPx基因在肌肉中的表达,而酵母硒对于GPx2基因在肌肉中的表达存在抑制作用,具体原因仍需进一步研究。有报道表明亚硒酸钠可提高肌肉中硒蛋白的表达,Juszczuk-Kubiak等[32]通过在基础饲粮中添加0.5 mg/kg亚硒酸钠,显著上调了美利奴绵羊背最长肌中GPx1基因的表达,但对GPx2与GPx4基因的表达无显著影响,这与本研究结果相似。
本试验中SS组湖羊肌肉中MDA含量显著高于SY组和CON组。这或是因为无机硒(例如亚硒酸钠)可能充当助氧化剂,而有机硒则是有效的抗氧化剂,由此导致SS组肌肉中MDA含量较高[33]。Bakhshalinejad等[34]研究发现,与无机硒(亚硒酸钠)相比,有机硒(蛋氨酸硒、酵母硒和纳米硒)的添加显著降低了罗斯308肉鸡肌肉中MDA含量,且以添加0.4 mg/kg蛋氨酸硒效果最佳。相反的,Vignola等[35]研究发现,饲喂不同水平(0.30、0.45 mg/kg DM)的亚硒酸钠和酵母硒对羔羊背最长肌MDA含量无显著影响。
3.4 酵母硒和亚硒酸钠对育肥湖羊肉品质及货架期的影响
本试验中添加0.4 mg/kg的酵母硒和亚硒酸钠对于湖羊生产性能和屠宰性能均无显著影响,说明基础饲粮中含有的硒即可满足湖羊生长发育的需求。与之相似,Alimohamady等[36]研究发现,在基础饲粮中添加0.2、0.4 mg/kg酵母硒及亚硒酸钠不会对羔羊的生长性能产生显著影响。Alejandro等[37]研究表明,在妊娠期80 d到哺乳期240 d中每60 d为安格斯母牛注射0.05 mg/kg BW的亚硒酸钠,对试验动物体重和体况评分均无显著影响。
能量代谢对屠宰后肌肉pH起到了主要决定作用,动物死亡后机体原来的循环系统和氧供应便停止,肌肉中的化学变化发生改变,有氧代谢转换为厌氧酵解,使乳酸形成加快,降低肌肉pH[38]。本试验中SY组湖羊屠宰后24 h背最长肌pH显著降低,且滴水损失显著提高。这说明酵母硒的添加可以加快肌肉中肌糖原的酵解,从而促进乳酸的产生,不利于肉质的长期储存和防止肉质酸败,但其原因还需进一步探索。滴水损失的提高可能与背最长肌pH降低有关,较低的pH会引起肌肉系水力的降低。一些研究与本试验结果相反,Mateo等[39]研究发现添加0.1、0.2和0.3 mg/kg酵母硒对PIC猪屠宰后24 h肌肉pH无显著影响;同样,戴五洲[40]研究发现添加0.1、0.3和0.5 mg/kg有机硒(纳米硒)未对杜长大三元杂交肥育猪屠宰后24 h肌肉pH产生显著影响。占秀安等[41]研究发现,与对照组相比,添加0.3 mg/kg蛋氨酸硒可显著降低杜长大三元杂交育肥猪屠宰后8和16 h的滴水损失分别降低了1.21%和1.74%,而添加同剂量的亚硒酸钠则未产生显著影响。
肌肉中肌红蛋白的含量与肉色的鲜艳程度成正比,可以直接影响肉色[42]。本试验中,添加酵母硒和亚硒酸钠均可显著降低湖羊屠宰后24 h背最长肌的黄度和亮度值,改善肉色。与本结果相似,高爱琴等[43]研究发现0.15、0.30 mg/kg的有机硒与100、200 IU/kg的维生素E混合添加可以显著降低肉仔鸡肌肉的亮度值。但赵亚伟等[44]研究结果与本研究结果不一致,即添加0.3 mg/kg的亚硒酸钠、酵母硒、羟基-硒代蛋氨酸和纳米硒对肉鸡胸、腿肌黄度与亮度值无显著影响。
现阶段我国羊肉销售主要以冷鲜肉为主,适当延长肌肉货架期可以促进高质量羊肉供给并增加消费者的购买欲望。本试验中,CON组、SY组及SS组湖羊背最长肌达到判定肉质腐败的国家标准TVB-N含量的时间分别是85.8、87.2和71.2 h,可见亚硒酸钠有缩短肌肉货架期的消极作用,可能因为该组肌肉中MDA含量较高,亚硒酸钠增加了肌肉脂质过氧化程度,加快了肌肉的氧化速度,从而缩短了货架期。而CON组与SY组肌肉中MDA含量无显著差异,2组湖羊背最长肌货架期也仅仅相差1.4 h,说明肌肉的抗氧化状态一定程度上可反映肉品货架期。与本结果相似,张少涛[45]研究发现,与无机硒(亚硒酸钠)相比,添加0.3 mg/kg蛋氨酸硒可显著降低储存第1天和第5天猪肉中TVB-N含量。
3.5 酵母硒和亚硒酸钠对育肥湖羊瘤胃发酵参数及养分消化率的影响
瘤胃微生物影响硒在瘤胃中的代谢,包括对硒的同化与还原[46]。参与还原作用的微生物包括变形菌门、厚壁菌门等,瘤胃中硒通过微生物的同化作用被合成硒蛋白参与代谢[47],主要通过影响瘤胃液pH、产气量、氨态氮浓度、瘤胃微生物生长、饲粮消化率及VFA含量与比例等来调节瘤胃发酵参数[48]。本试验中,酵母硒与亚硒酸钠的添加显著降低了湖羊瘤胃液乙丙比,对瘤胃液乙酸比例无显著影响,但丙酸比例较CON组有显著增加的趋势,因而导致2个硒添加组乙丙比显著降低,改变瘤胃发酵模式。关于低水平硒添加降低乙丙比也有一些相似的报道,张清月等[49]研究发现,奶牛瘤胃液体外发酵6 h时,0.1、0.2和0.3 mg/kg的亚硒酸钠与有机硒(蛋氨酸硒、酵母硒)均可显著降低乙丙比,以0.3 mg/kg硒添加水平最佳,显著低于0.1和0.2 mg/kg硒添加水平。异位酸指具有4~5个碳的支链脂肪酸,一般包括异戊酸、异丁酸等,而戊酸在实际应用中也被归为异位酸,可以充当瘤胃中纤维分解菌繁殖的生长因子,促进纤维分解[50],本试验中亚硒酸钠的添加显著提高了湖羊瘤胃液中戊酸的比例和ADF的消化率,说明硒可以通过调节瘤胃发酵模式提高饲粮中纤维素的消化率。除此之外,酵母硒的添加也显著提高了ADF消化率,但硒的添加使CP消化率显著下降,具体原因还需进一步研究。
4 结 论
① 0.4 mg/kg添加水平下,酵母硒与亚硒酸钠均可生产富硒羊肉,提高湖羊血清T-AOC,降低MDA含量。
② 酵母硒可显著提高湖羊肝脏、肾脏和心脏的硒含量;亚硒酸钠可上调肌肉GPx3和GPx4基因的表达,但存在缩短肌肉货架期与增加肌肉脂质过氧化的负面作用。
③ 在生产富硒湖羊肉产品时,酵母硒相对亚硒酸钠在增加机体脏器硒含量、肉质保鲜储存方面效果更佳。
