FOXO3基因过表达对鹅卵泡颗粒细胞凋亡和自噬相关基因mRNA表达水平的影响
2022-02-20曹中赞盖叶丹陈美月王皓宇栾新红
曹中赞,盖叶丹,陈美月,刘 梅,高 明,王皓宇,栾新红
(沈阳农业大学动物科学与医学学院,辽宁沈阳 110161)
属于叉头基因(Forkhead)转录因子家族成员,参与调节包括细胞凋亡、增殖、分化、自噬等多个生理过程。利用外源FOXO3蛋白处理体外培养的鸡卵泡颗粒细胞可使促凋亡相关基因表达量上升。利用携带基因的重组腺病毒感染体外培养的大鼠卵泡颗粒细胞,发现过表达会增加促凋亡蛋白Bim的表达。此外,还可以通过改变某些凋亡相关基因的转录水平影响自噬,当过表达时可以促进促凋亡基因的转录,由于自噬调控蛋白Beclin1锚定在Bim的BH3区域,与微管相关蛋白l轻链3(LC3)相连,一旦Bim被激活,Beclin1就会被释放到细胞质中启动自噬系统。被上游相关因子激活后,可以通过调控下游凋亡、自噬、增殖相关基因来调节动物的生殖过程。在鸡卵泡发育的各个阶段中均有的表达,干扰表达时卵泡颗粒细胞中和表达量均显著下降。卵泡颗粒细胞凋亡是卵泡发生闭锁的重要而直接的因素。细胞自噬与凋亡关系密切,颗粒细胞的自噬通过影响凋亡直接参与卵泡发育各个阶段的闭锁。在猪卵巢中呈现卵泡发育阶段特异性和细胞特异性表达,在卵泡的生长和闭锁过程中发挥重要作用。对健康、早期闭锁和发展中闭锁阶段的猪卵泡颗粒细胞进行表达量的检测发现,在闭锁卵泡中表达量显著增加,且随着闭锁程度的加重不断升高。目前关于基因在鹅卵泡颗粒细胞凋亡和自噬中可能发挥的作用还未见报道。本研究通过构建基因真核表达载体,转染至鹅卵泡颗粒细胞,检测其对细胞凋亡和自噬相关基因表达的影响,旨在为进一步探讨基因对鹅卵泡发育及闭锁的调控作用提供理论基础。
1 材料与方法
1.1 实验动物和样品采集 产蛋期健康雌鹅取自辽宁省辽阳市某种鹅场,颈部放血处死。剥净腹部羽毛,打开腹腔取出卵巢,采集等级卵泡,置于4℃预冷的PBS中清洗干净,以便进行后续颗粒细胞的分离。将剩余组织置于冻存管中,迅速放入液氮,后转移至-80℃超低温冰箱中保存。
1.2 主要试剂与仪器 pMD18-T克隆载体、PrimeScriptRT reagent Kit with gDNA Eraser、SYBRPremix Ex TaqII、T4 DNA连接酶、限制性内切酶III、I购于宝生物工程(大连)有限公司;pcDNA3.1表达载体购自Invitrogen公司;DH5大肠杆菌感受态细胞、2×Taq PCR MasterMix、质粒小提和大提试剂盒购于天根生化科技(北京)有限公司;Trizol试剂盒、DNA Marker、凝胶回收试剂盒购于南京诺唯赞生物科技有限公司;M199培养基、双抗购于以色列BI生物公司;胎牛血清购于杭州四季青有限公司;IV型胶原酶购于美国Sigma公司;LipoFiter转染试剂购于汉恒生物科技(上海)有限公司。Myc标签抗体购于碧云天生物技术有限公司;GAPDH抗体购于巴基斯坦Santa Cruz公司;山羊抗兔二抗购于美国Proteintech公司;ECL化学发光染料、硝酸纤维素膜、RIPA蛋白提取试剂盒、BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司。
-80℃超低温冰箱(赛默飞世尔科技公司);核酸蛋白分析仪、高速冷冻离心机(BECKMAN仪器有限公司);实时荧光定量PCR仪、凝胶成像分析仪、PCR仪、电泳仪、Western Blot转印制胶系统(伯乐生命医学产品(上海)有限公司);恒温震荡培养箱(上海一恒科学仪器有限公司);二氧化碳培养箱(香港Heraeus有限公司);全自动细胞计数仪(深圳博大博聚科技有限公司);化学发光型凝胶成像系统(以色列DNR公司)。
1.3基因CDS序列的扩增与克隆 根据GenBank上的鹅基因序列(XM_013175636.1)和pMD18-T载体以及pcDNA3.1载体上的多克隆酶切位点,应用Primer Premier 5.0软件设计引物,并在正、反向引物的5′端分别插入Hind III、Nhe I酶切位点。正向引物为5′-CTAGCTAGCGCCACCATGAACTCAATCCGGC AC-3′,反向引物为5′-CCCAAGCTTTCAGCCTGGTA CCCAACTC-3′,下划线部分分别为III、I酶切位点。预期扩增片段大小为1 404 bp。引物由生工生物工程(上海)股份有限公司进行合成。
用Trizol试剂盒提取鹅卵巢组织总RNA,用核酸蛋白分析仪测定其浓度和纯度。按照PrimeScriptRT reagent Kit with gDNA Eraser反转录试剂盒说明书进行反转录获得cDNA。以cDNA为模板,利用SYBRPremix Ex TaqII试剂盒和上述基因特异性引物进行PCR扩增。PCR反应程序为:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸90 s,30个循环;72℃再延伸10 min。对PCR反应产物进行琼脂糖凝胶电泳检测,用DNA胶回收试剂盒回收纯化目的片段。将纯化的目的基因PCR产物连接于pMD18-T克隆载体,转化至DH5大肠杆菌,通过菌液PCR鉴定阳性克隆,送生工生物工程(上海)股份有限公司测序。
1.4真核表达载体的构建与鉴定 提取阳性克隆菌液pMD18-T-质粒。用III和I双酶切pMD18-T-和pcDNA3.1质粒,用凝胶回收试剂盒回收酶切产物,用T4 DNA连接酶连接,转化大肠杆菌DH5感受态细胞,均匀涂布至含氨苄青霉素的LB琼脂平板上,37℃培养12 h。挑取单菌落进行PCR和双酶切鉴定,阳性克隆菌液送生工生物工程(上海)股份有限公司测序,用NCBI上BLAST工具进行序列分析。测序正确的克隆菌液用质粒大提试剂盒提取质粒备用。
1.5 鹅原代卵泡颗粒细胞的分离培养与转染 取在PBS中清洗干净的等级卵泡,用镊子将卵泡外层的结缔组织剥去,再次清洗,用眼科剪在卵泡血管少处剪一小口,稍微用力挤出卵黄,颗粒细胞层随之而出。将颗粒细胞层置于装有PBS的平皿中,洗净卵黄成分,然后转移到小烧杯中,加入IV型胶原酶,用眼科剪将颗粒细胞层剪碎,置于37℃消化5 min。用滤网过滤,滤液于室温、1 000 rpm离心8 min。弃上清,加入适量的M199细胞培养液悬浮沉淀的细胞,再次室温、1 000 rpm离心8 min,留取沉淀,加入1 mL含有10%胎牛血清的M199细胞培养液悬浮细胞,用细胞计数仪进行计数,按照1×10个/mL细胞密度将细胞接种于细胞培养皿中,置于37℃、5% CO条件下培养。待细胞汇合度达到70%~80%时使用LipoFiter转染试剂进行转染实验,具体步骤参照试剂盒说明书进行。转染实验设置对照组、pcDNA3.1空载体组和pcDNA3.1-组3个组,每组3个重复。
1.6 荧光定量PCR检测 转染后48 h收集各组细胞,用Trizol试剂盒提取细胞总RNA,检测RNA质量后,用PrimeScriptRT reagent Kit with gDNA Eraser进行反转录实验获得cDNA,用SYBRPremix Ex TaqII试剂盒进行荧光定量PCR检测及细胞凋亡和自噬相关基因的mRNA表达水平。引物由生工生物工程(上海)股份有限公司设计合成,具体引物信息见表1。反应体系20 μL:2 μL cDNA模板(50 ng/μL),10 μL SYBR Ex Taq II(2×),上下游引物(10 μM)各0.8 μL,RNasefree ddHO 6.4 μL。反应程序为:95℃预变性30 s;95℃变性10 s,60℃退火延伸30 s,40个循环。为内参基因,用2法计算基因相对表达量。每组3个生物学重复,每个样本进行3次重复分析。

表1 荧光定量PCR引物信息
1.7 Western Blot检测 用RIPA蛋白提取试剂盒提取细胞总蛋白,用BCA蛋白定量试剂盒进行蛋白浓度测定。配制12%聚丙烯胺凝胶,每孔上样20 μg,电泳条件为110 V、1.5 h,采用半干转法转膜,转膜条件为0.15 A、1.5 h。室温条件下10%脱脂奶粉封闭1 h,TBST漂洗2次,4℃Myc抗体过夜孵育,TBST漂洗3次,室温下二抗孵育1 h,TBST漂洗3次,用ECL发光液进行显影。
1.8 统计分析 用SPSS 19软件对数据进行One-Way ANOVA分析,实验数据以“平均值±标准误”表示。<0.05为差异显著,<0.01为差异极显著。
2 结果与分析
2.1 鹅基因CDS序列的克隆 提取鹅卵巢组织总RNA后,反转录生成cDNA,以cDNA为模板,通过PCR扩增基因的CDS序列。将胶回收纯化的PCR产物克隆到pMD18-T载体,进行菌液PCR验证,经琼脂糖凝胶电泳检测,如图1所示,在1 400 bp处出现目的条带,片段大小与预期结果相符(基因的CDS长度为1 404 bp),且无其他杂带。测序结果经BLAST比对与NCBI数据库中模板序列完全一致,表明成功获得克隆质粒pMD18-T-。
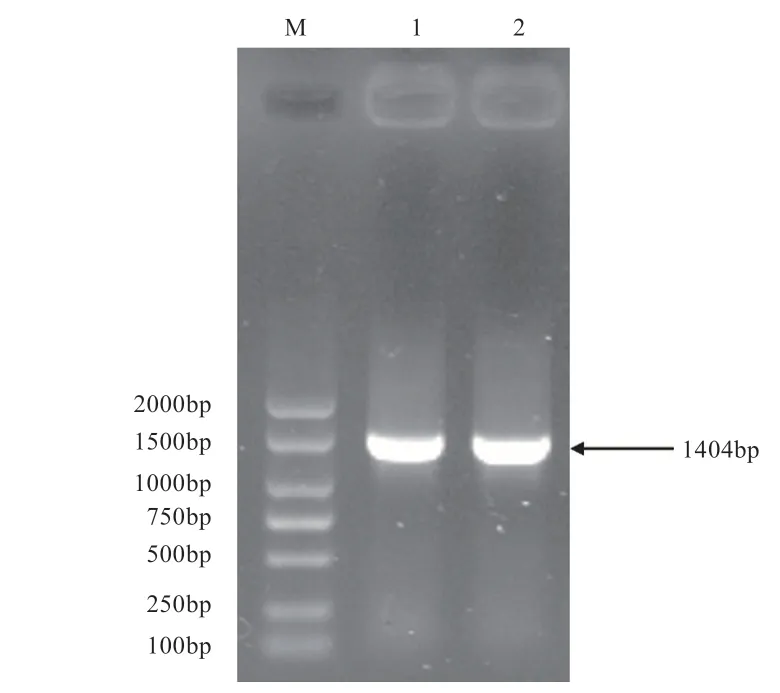
图1 FOXO3克隆载体菌液PCR结果
2.2 鹅基因真核表达载体pcDNA3.1-的构建及鉴定 以pcDNA3.1为骨架载体,III和I双酶切pMD18-T-和pcDNA3.1,连接并转化大肠杆菌DH5感受态细胞,经筛选提取阳性克隆质粒,进行III和I双酶切鉴定,酶切后释放出分别与空载体和目的片段相应大小的条带,结果与预期相符(图2)。将双酶切鉴定为阳性的重组质粒进行测序,测序结果表明pcDNA3.1-重组质粒所插入的片段与的CDS序列相同,表明鹅基因的真核表达载体构建成功。

图2 pcDNA3.1-FOXO3重组质粒双酶切鉴定结果
2.3 鹅基因在卵泡颗粒细胞中的过表达 将过表达质粒pcDNA3.1-转染到鹅卵泡颗粒细胞,提取细胞总RNA,利用荧光定量PCR检测重组质粒表达情况。如图3所示,pcDNA3.1-组基因的mRNA表达水平(1.40±0.14)高于 pcDNA3.1空载体组(1±0.084)和对照组(1±0.1)(<0.05),表明基因在鹅卵泡颗粒细胞中成功过表达。利用标签抗体进行Western Blot检测,如图4所示,真核表达质粒pcDNA3.1-在卵泡颗粒细胞中成功表达。

图3 转染后各组细胞FOXO3 mRNA表达水平

图4 转染后各组细胞FOXO3蛋白表达水平
2.4 鹅基因过表达对细胞凋亡和自噬相关基因mRNA表达水平的影响 如图5所示,基因过表达后,卵泡颗粒细胞中细胞凋亡相关基因的mRNA表达水平均升高(<0.05)。而自噬相关基因LC3和Beclin1的mRNA表达水平均降低(<0.05)。

图5 过表达FOXO3基因后细胞凋亡和自噬相关基因的mRNA表达水平
3 讨 论
半胱天冬酶(Caspase)蛋白酶家族是细胞凋亡的主要下游效应器,在Caspase家族中,Caspase3是凋亡的关键执行分子和主要效应分子。Caspase3的活化是不同细胞凋亡的共同途径,机体内主要的2种细胞凋亡途径——线粒体途径和死亡受体途径都可以通过作用于Caspase3引起细胞凋亡。本研究将构建的真核表达载体转染至鹅卵泡颗粒细胞发现,与对照组相比,Caspase3的mRNA表达水平显著升高,这与猪、鸡卵泡颗粒细胞中凋亡诱导因子的结论一致。
和同属基因家族,该家族基因主要通过调节线粒体膜的电位和通透性来调控细胞凋亡。是促进细胞凋亡的重要基因之一,过量表达可激活Caspase,诱导细胞凋亡的发生。基因是主要的抗凋亡基因,过量表达可以提高细胞对不利环境的抵抗力,抑制细胞发生凋亡。是的天然配体,属于肿瘤坏死因子家族,系统是最典型的死亡受体凋亡途径。与结合后激活细胞质内的Caspase8,活化的Caspase8进一步激活Caspase3,从而引发细胞凋亡。本研究对过表达后Caspase3的上游因子和进行了mRNA表达水平的检测,结果显示较对照组相比,和表达量均明显升高,这说明可能调控卵泡颗粒细胞的凋亡过程,而这种调控作用可能是通过参与到介导的线粒体凋亡途径和介导的死亡受体途径中实现的。
LC3是一种与自噬过程有关的重要蛋白。LC3靶向定位于自噬体膜,参与自噬体的形成,被认为是自噬体的标志分子,其表达水平的高低可以直接反映出机体自噬发生的严重程度。Beclin1属于Bcl-2蛋白家族,是真核生物细胞自噬机制的核心调控元件,参与自噬体的形成与成熟,其表达与细胞内自噬体发生密切相关。研究发现,当某些外界因素激活使其活化时能够增加自噬小体的形成和自噬相关基因如的表达,进而直接参与到自噬反应的调控中。除了参与卵泡颗粒细胞的凋亡和增殖外,还能调节颗粒细胞的自噬,利用神经酰胺诱导形成卵巢癌细胞模型,发现表达量增加,LC3蛋白表达量明显上升,自噬发生。也有研究表明,被PI3K-AKT信号通路磷酸化后失活,促进了谷氨酰胺合成酶的合成,以谷氨酰胺合成酶依赖性方式阻止雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)易位至溶酶体膜,进而导致mTOR活性抑制,促进了自噬的发生。因此,对自噬的影响如何还要根据其参与的调节途径具体分析。在本研究中,将真核表达载体转染至鹅卵泡颗粒细胞后,和的mRNA表达水平均显著下降。过表达实验结果还发现,过表达后表达量上升,而Bcl-2/Beclin1复合体是细胞自噬的一条重要激活通路,正常情况下Bcl-2与Beclin1结合能力较强,可以抑制Beclin1与其他自噬蛋白形成复合体,降低其对自噬的推进作用,并且这条信号通路是独立于AKT/的新型自噬通路,而本研究中的表达量上调很有可能激活了这条自噬调控通路,Bcl-2/Beclin1与介导的信号通路共同调节了卵泡颗粒细胞的自噬。
4 结 论
本研究成功构建了鹅真核表达载体。鹅卵泡颗粒细胞过表达实验结果显示,基因可影响鹅卵泡颗粒细胞中凋亡和自噬相关基因和的表达。本研究结果有望为进一步探讨基因对鹅乃至禽类卵泡发育及闭锁的作用奠定基础。
