不同胃癌筛查评分系统在早期胃癌及其癌前病变的筛查作用
2022-02-19郑楠
郑 楠
(敦煌市医院,甘肃 敦煌 736200)
胃癌(Gastric Cancer,GC)是严重危害人类生命健康的最常见恶性肿瘤之一,其发病率和死亡率均高居恶性肿瘤前列[1]。早期胃癌通常无典型症状体征,缺乏特异性症状,患者可出现反酸、嗳气、上腹部不适、食欲下降等非特异性症状,易与胃溃疡、胃炎等常见慢性疾病混淆,多数患者首诊时已进展至中晚期,此时通常已丧失最佳手术治疗时机。寻找一种可准确筛查早期胃癌的检查手段,进而提高早期胃癌的诊断率并给予及时干预是降低胃癌患者病死率的关键[2-3]。目前,胃镜及组织病理学检查是胃癌诊断的金标准,但胃镜是一种侵入性检查手段,会增加患者痛苦,很难作为常规检查方法用于该病普查。近年来的多项研究证实胃癌发病与性别、年龄、血清胃蛋白酶原(Pepsinogen,PG)、胃泌素-17(gastrin-17,G-17)和幽门螺杆菌(Helicobacter pylori,Hp)感染等因素密切相关,在此基础上建立的新型胃癌筛查评分系统(New Gastric Cancer Screening Score,NGCSS)[4]在早期胃癌及PLGC筛查中的作用引起广泛关注。文章以2020年1—12月选取敦煌市某社区590例居民作为筛查对象,对比分析了日本胃癌筛查评分(Japanese Gastric Cancer Screening Score,JGCSS)、NGCSS两种胃癌筛查评分系统在早期胃癌及胃癌前病变(Precancerous Lesions of Gastric Cancer,PLGC)筛查中的应用价值,旨在为选择早期胃癌及PLGC的筛查手段提供参考。
1 资料与方法
1.1 一般资料
于2020年1—12月选取敦煌市某社区590例居民作为筛查对象,因出现腹痛、腹胀、反酸、嗳气、恶心、呕吐、呕血、黑便等各种消化道症状而接受筛查。纳入标准:①年龄40~80岁;②存在Hp感染者;③处于胃癌高风险地区;④既往患胃溃疡、肥厚性胃炎、胃息肉、慢性萎缩性胃炎、恶性贫血等胃相关癌前病变者;⑤一级亲属中有胃癌患者;⑥日常生活中有摄入高盐、喜食腌制食物、吸烟或酗酒等习惯者;⑦签署知情同意书并配合研究。排除标准:①近1年内曾接受胃镜检查或有胃大部切除史者;②已确诊胃癌、食管癌、结直肠癌或其他恶性肿瘤者;③结合血清肿瘤标志物、影像学检查高度疑似肿瘤患者;④合并心肝肾等重要器官严重功能障碍者;⑤存在出血倾向而无法接受活检者;⑥伴精神疾病者。采用JGCSS与NGCSS系统评估,均依据评分情况分为低危组、中危组和高危组。各组性别、年龄、病程和发病部位等资料对比差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 问卷调查
所有受试者均在专业人员指导下填写问卷调查表,统计其性别、年龄、姓名、一级亲属罹患GC或其他恶性肿瘤、既往胃病史以及饮食生活习惯等。
1.2.2 血清学检查
所有受试者空腹下抽取静脉血5 mL,离心处理后分离血清,采用免疫定量分析仪测定各组PGⅠ、Ⅱ水平和G-17水平,计算PGⅠ/PGⅡ比值(PGⅠ/Ⅱratio,PGR),检测Hp感染情况。
1.2.3 风险分层
采用JGCSS[5]与NGCSS对受试者进行胃癌风险分层,其中JGCSS包含年龄、胃癌家族史、吸烟、饮食习惯(食用腌制食品)、ABC风险分层等变量,总分24分,依据实际评分分为低危组(评分0~14分)、中危组(评分15~19分)、高危组(评分20~24分)。NGCSS包含性别、年龄、PGR、G-17、Hp5个变量,依据实际评分分为低危组(评分0~11分)、中危组(评分12~16分)、高危组(评分17~23分)。
JGCSS评分具体标准如下:(1)年龄。年龄范围40~44岁,女性计0分,男性计1分;年龄范围45~49岁,女性计1分,男性计3分;年龄范围50~54岁,女性计2分,男性计4分;年龄范围55~59岁,女性计3分,男性计6分;年龄范围60~64岁,女性计4分,男性计8分;年龄≥65岁,女性计5分,男性计10分;(2)胃癌家族史。无胃癌家族史者计0分,有胃癌家族史者计1分;(3)吸烟。无吸烟习惯或既往有目前无吸烟习惯,计0分;目前吸烟计1分;(4)饮食习惯。无食用腌制食品习惯者计0分,有食用腌制食品习惯者计1分;(5)ABC风险分层。分为A、B、C、D,分别评分0、8、11、11分。
NGCSS评分具体标准如下:(1)年龄。年龄范围40~49岁,计0分;年龄范围50~59岁,计5分;年龄范围60~69岁,计6分;年龄≥69岁,计10分;(2)性别。女性计0分,男性计4分;(3)Hp感染。无Hp感染者,计0分;有Hp感染者,计1分;(4)PGR。≥3.89者计0分,<3.89者计1分;(5)G-17水平(pmol/L)。G-17<1.50者,计0分;G-17介于1.50~5.70者,计0分;G-17>5.70者,计5分。
1.2.4 胃镜检查
依据风险分层结果,由内镜医师对中高危人群行胃镜精查,接受组织病理学检查。
1.3 统计学方法
采用SPSS 24.0统计学软件分析数据,计数资料以%率表示,两组间比较采用χ2检验,比较两种筛查方法对早期胃癌及PLGC的检出情况,采用Kappa检验评价两种筛查方法的一致性。绘制JGCSS、NGCSS诊断GC及PLGC的受试者工作曲线(Receiver Operating Characteristic,ROC)及曲线下面积(Area Under Curve,AUC),对比JGCSS、NGCSS对早期胃癌及癌前病变的诊断效能,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况
590例居民中<60岁者324例,占54.92%,≥60岁者266例,占45.08%。共检出GC4例,占0.68%;PLGC20例,占3.39%;慢性萎缩性胃炎204例,占34.58%;轻度胃炎296例,占50.17%;消化性溃疡28例,占4.75%;胃息肉38例,占6.44%。≥60岁组GC及PLGC检出20例,<60岁组GC及PLGC检出检出4例,≥60岁组GC及PLGC检出率高于<60岁组(χ2=14.783,P<0.05)。
2.2 两种方法对GC及PLGC的检出情况
JGCSS分组后中危组PLGC检出率高于低危组(P<0.05),高危组GC检出率高于低、中危组(P<0.05)。NGCSS分组后高危组GC及PLGC检出率高于低、中危组(P<0.05),中危组PLGC检出率高于低危组(P<0.05),见表1、表2。二者具有较高一致性(Kappa=0.562,P=0.013)。
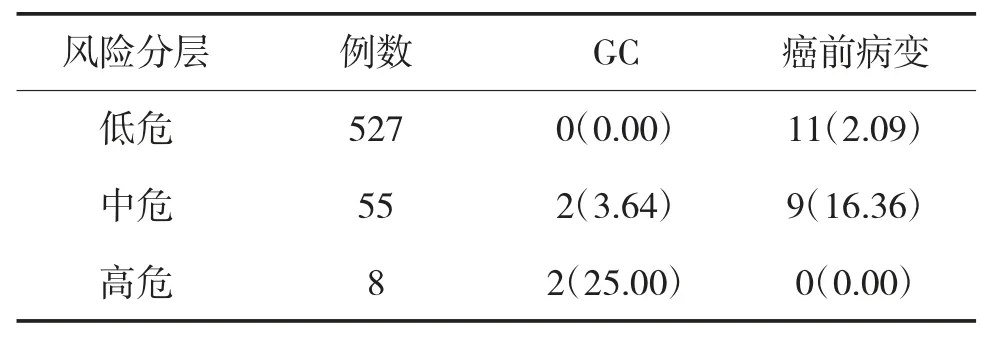
表1 JGCSS对GC及PLGC的检出情况 例(%)

表2 NGCSS对GC及PLGC的检出情况 例(%)
2.3 JGCSS、NGCSS对GC及PLGC的诊断效能
NGCSS诊断GC及PLGC的AUC为0.863(95%CI:0.769~0.956,P=0.000),灵敏度为0.866,特异度为0.853,约登指数为0.650。JGCSS诊断GC及PLGC的AUC为0.800(95%CI:0.691~0.909,P=0.001),灵敏度为0.770、特异度为0.734,约登指数为0.623;见表3、图1。
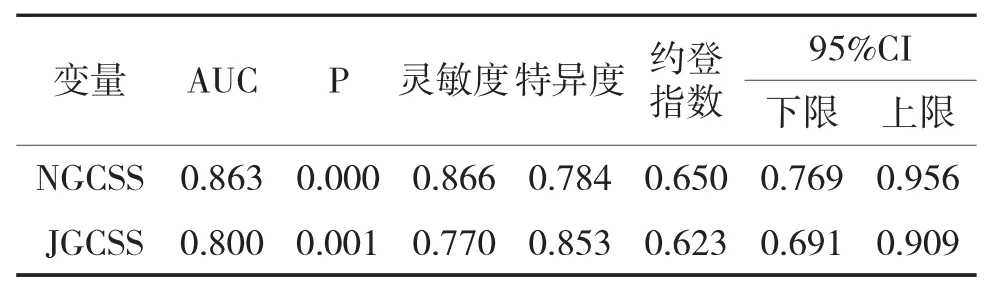
表3 JGCSS、NGCSS对GC及PLGC的诊断效能对比
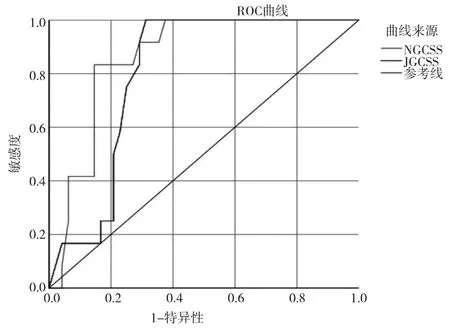
图1 JGCSS、NGCSS对GC及PLGC诊断的ROC曲线
3 讨论
早期胃癌患者通常无典型特异性症状,易与其他疾病相混淆,鉴别诊断难度较大。仅依据早期胃癌患者的临床表现很难实现早期确诊,针对早期胃癌及PLGC高危人群开展内镜筛查主要诊断手段。国内外相关研究均证实,早期开展GC及癌前病变筛查对于GC防治有重要意义[6]。早在20世纪60年代,日本采用胃镜结合胃气钡双重对比造影筛查40岁以上人群罹患早期胃癌的情况,结果显示此类人群的检出率达50%~70%。但人们逐渐发现,钡剂造影对于早期胃癌的诊断准确性偏低,漏诊率较高,现已被内镜检查取代。韩国既往主要采用胃镜检查筛查胃癌高风险人群并给予针对性干预,大幅降低了胃癌死亡率。但胃镜及病理活检具有一定侵入性,患者依从性不高,且费用相对较高,无法用于开展胃癌普查[7]。血清学筛查无侵入性、费用低且患者较耐受,但检测介质易受多种因素影响,诊断准确性较内镜检查低[8]。2016年日本公共卫生中心在以往血清学筛查基础上建立胃癌早期筛查系统,开展危险分层,并将其作为初筛工具[9]。我国在2017年依据《中国早期胃癌筛查流程专家共识意见(草案)》[10]建立了新型早期胃癌筛查评分系统,该系统将年龄与性别分开评估,并结合有无Hp感染、检测血清PG与G-17水平,通过赋以不同分值建立评分系统,有助于精准筛选胃癌高危人群,但上述两种筛查方法在早期胃癌及癌前病变筛查中的应用价值仍待明确。
JGCSS在我国胃癌高危人群筛查中的适用性仍待进一步明确,而NGCSS则存在部分指标权重设置问题(如Hp感染),故本研究将其应用于我社区人群早期胃癌及癌前病变的筛查之中并对比其应用价值,结果显示二者具有中度一致性(Kappa=0.562,P=0.013)。年龄是多种恶性肿瘤最为常见的危险因素,随着年龄增长,相关致癌因素亦不断累积,加之机体功能逐渐下降,免疫功能不断减弱,同时基因突变风险也明显增大,患癌风险亦显著上升。本研究发现,≥60岁组GC及其癌前病变检出率明显高于<60岁组,提示60岁以上人群可能为GC及PLGC的高风险人群,应重视对其进行筛查及干预,以降低胃癌发病率及死亡率。本研究发现JGCSS、NGCSS两种方法均显示高危组GC检出率高于低、中危组,中危组PLGC检出率则高于低危组,且二者具有较高一致性。其中NGCSS诊断GC及PLGC的灵敏度优于JGCSS,漏诊率相对更低,这可能与该评分系统基于中国人群胃癌发病风险并在此基础上制定的筛查工具、适用性更佳等有关。同时结合血清学指标(PG、G-17等指标)检测可能更符合中国胃癌筛查的实际情况。其中PG为胃蛋白酶前体,能在一定程度上反应胃黏膜特异性功能,在预测胃癌癌前病变中有重要应用价值,是公认的萎缩性胃炎预测指标,在胃癌发生发展中发挥重要作用[11]。PGⅠ多由胃底腺细胞分泌,主要进入胃腔,其他则可经胃黏膜血管入血,检测该指标水平可反映胃部及胃黏膜状态。胃黏膜萎缩时PGⅠ明显下降。PGⅡ经胃窦与十二指肠分泌,胃黏膜萎缩其水平并无明显变化,因此检测PGⅠ可预测胃黏膜相关病变。G-17是一种含量较高的胃泌素,尤其在胃癌组织中多见,因此检测其水平可用于筛查胃癌[12]。本研究发现,JGCSS诊断GC及PLGC的特异度略优于NGCSS,这可能与相关指标(如Hp)权重设置或地区差异等因素有关。
综上所述,JGCSS、NGCSS在早期胃癌及PLGC筛查中具有较高一致性,中、高危组GC及PLGC检出率较高,NGCSS在早期胃癌及PLGC筛查中可能具有更高的应用价值。本研究认为对于低危人群可通过定期随访以节约医疗资源,对于中高危人群则可通过内镜及病理学检查,以提高诊断率,减少漏诊。
本研究仍然存在一定局限,主要表现如下:本研究所采用的2种筛查方法均未将乙醇摄入、肥胖等胃癌相关危险因素纳入评估,其诊断准确性仍待进一步证实。另外,本研究纳入样本量仍然不足,未来仍需进一步扩大样本,通过搜集更多临床数据以证实研究结论,同时进一步改善早期胃癌筛查方法及模型,探索出更具优越性和有较强适用性的胃癌筛查手段,以提高对早期胃癌及癌前病变的检出率,为早期干预和改善预后创造良好条件。此外,还要在社区人群中加强宣教,让其认识到早期胃癌筛查的必要性和重要性,并致力于简化筛查流程,提升筛查效率,提高对胃癌高风险人群的胃镜精查率,逐步探索适用于中低风险地区的早期胃癌筛查策略,做到精准识别早期胃癌高危人群,提升筛查能力。
