先天性全身脂肪营养不良1 型患者的基因型和临床表型分析及文献复习
2022-02-19宋宗先董治亚陆子文李彦晓
宋宗先,董治亚,陆子文,李彦晓,陈 烨
(上海交通大学医学院附属瑞金医院儿内科,上海 200025)
黑棘皮病(acanthosis nigricans,AN)是一种以色素沉着,天鹅绒样皮肤增厚和乳头瘤状斑块为特征的皮肤表现。儿童及青少年AN 多与肥胖所致的胰岛素抵抗(insulin resisetance,IR)和高胰岛素血症相关,而在非肥胖儿童中极为罕见。
脂肪营养不良综合征是一组罕见的异质性疾病,其特征是身体脂肪选择性丢失,可根据获得方式(先天遗传性或后天获得性)和脂肪缺乏分布(全身性或部分性)进行分类,共有4 种主要分型,其中先天性全身脂肪营养不良(congenital generalized lipodystrophy,CGL)是一种常染色体隐性遗传性疾病,除脂肪缺乏外可合并包括IR 等多种代谢障碍,根据致病基因不同又分为四型。其中CGL1 和CGL2最为常见,据报道可占95%,CGL1 为AGPAT2 基因突变、CGL2 为BSCL2 基因突变所致。CGL1 多见于非洲裔患者,而CGL2 多见于亚洲裔、欧洲裔患者[1]。
由AGPAT2 基因突变所导致的CGL1 在亚州裔发病率极低,目前国内仅报道5例,本文报道了1 例因严重AN 就诊,确诊为CGL1 的患儿,并回顾复习我国文献中报道的相关病例,分析这一疾病在我国人群中的临床特征,以期临床医师能够及早识别该疾病,避免漏诊和误诊。
资料与方法
一、资料
本研究对象为2021 年7 月因AN 而就诊于上海交通大学医学院附属瑞金医院的1 例女性患儿,收集其临床资料及家系调查数据[伦理审批件号(2019)临伦审第(15)号]。患儿监护人签署了知情同意书。
二、方法
1.辅助生化检测:患者进行了血尿常规、肝肾功能、电解质、心肌酶、甲状腺功能、血脂、性激素、肿瘤指标、瘦素、脂联素等检测,同时行口服葡萄糖耐量试验及同步血浆胰岛素、C 肽释放试验,促肾上腺皮质激素激发试验。
2.影像学检查:予患者行骨龄检查,心超、肝胆胰脾肾及肾上腺超声、子宫卵巢超声检查,以及垂体MRI 检查。
3.基因分析:
(1)血标本采集:抽取患儿及父母外周静脉抗凝血3 mL,采用血液提取试剂盒(北京贝瑞和康医学检验实验室有限公司)提取DNA,并置于-20 ℃保存备用。
(2)目标序列捕获高通量测序及变异致病性预测分析:从受检者样本中提取基因组DNA,构建基因组文库。通过探针杂交捕获目标基因(约20 000 个)外显子及毗邻剪接区域(约20 bp),以及线粒体基因组全长,并进行富集。对富集的基因进行质量控制,利用高通量测序仪进行测序。序列变异数据解读规则参考美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)遗传变异分类标准与指南,以及ClinGen 序列变异解读(SVI)专家组陆续发布的一系列通用建议和细则,针对特定基因和疾病的解读指南,进行进一步的细化解读。
(3)Sanger 测序验证:根据目标序列捕获高通量测序的结果设计引物,对患儿及其父母分别进行目标序列的PCR 扩增及Sanger 测序。
4.文献检索:以“先天性全身脂肪营养不良、AGPAT2”为关键词,在万方、知网、PubMed 数据库检索有基因报告的中国CGL1 患者。通过文献复习进一步分析CGL1 的临床表型和基因型。
结果
一、临床特征
患儿为女性,年龄为10 岁11 个月,自出生后皮肤较同龄人黑,颈背、腋窝、胸前、腹股沟等皮肤褶皱处尤甚,且粗糙,全身体毛偏多。患儿的母亲为G1P1,患儿为其母足月顺产,出生时体重为3.4 kg,身长50 cm,无喂养困难,生长发育无异常,学习成绩好。患儿父亲身高171 cm,体重80 kg;母亲身高166 cm,体重70 kg,无糖尿病及其他疾病家族史,非近亲婚配。
体格检查示,患儿身高为159 cm(>正常同龄人P97),体重50.05 kg 为正常同龄人(P90~P97),体质量指数(body mass index,BMI)19.80 kg/m2(为正常同龄人P85~P90),体态匀称,无特殊面容,四肢多毛,颈部、腋窝、胸前及腹股沟黑棘皮明显,腹肌轮廓明显,腹部脂肪厚度0.7 cm。双乳B4,腋毛(+),PH3,小阴唇肥厚色深(见图1)。实验室检查示,患儿的染色体为46XX;血尿常规、肝肾功、心肌酶、电解质、甲状腺功能、肿瘤指标皆无异常;血脂检测示,甘油三酯1.45 mmo/L,胆固醇3.02 mmol/L,高密度脂蛋白0.86 mmol/L(↓),低密度脂蛋白1.72 mmol/L,载脂蛋白A 1.03g/L(↓),载脂蛋白B 0.50 g/L(↓),脂蛋白(a) 0.30 g/L,游离脂肪酸0.27 mmol/L;促肾上腺皮质激素激发试验、尿游离皮质醇无异常;甲状旁腺素相关肽正常;性激素及促性腺激素检测结果提示为青春发育期睾酮0.46 ng/mL,双氢睾酮39.99 pg/mL;代谢相关检测示,瘦素2.17 ng/mL(1.50~8.90),脂联素0.28 μg/mL(5.00~37.00),糖化血红蛋白5.5%,口服葡萄糖耐量试验提示严重的胰岛素抵抗和糖耐量异常(见表1)。

表1 患儿口服葡萄糖耐量试验及同步血浆胰岛素、C 肽释放试验
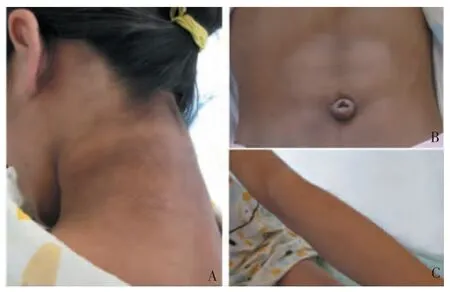
图1 患儿体征
影像学检查示,患儿骨龄提前(BA=15 岁)。肝胆脾胰肾及肾上腺超声、心超、垂体MRI 平扫均未见明显异常。妇科超声检查提示多囊卵巢,宫颈长27 mm,内膜双侧厚6 mm,回声均匀,子宫体长34 mm、厚22 mm、宽35 mm;右卵巢(49×21×22)mm3,体积12.12 mL,内见无回声区单切面12~14个,直径2~6 mm;左卵巢(32×12×12)mm3,体积2.35 mL,内见无回声单切面约10个,直径2~4 mm,提示右侧卵巢多囊样改变。
二、基因检测结果
患儿9 号染色体上的AGPAT2 基因存在复合杂合突变(见图2),包括来源于父亲的第5 外显子上c.646A>T:p.K216*(无义突变)和来源于母亲的第3 外显子上c.406G>A:p.G136R(错义突变)。

图2 患儿及其父母AGPAT2 基因Sanger 测序结果
c.646A>T 为已知变异,文献[2-4]报道在该位点存在该突变的纯合突变,导致提前出现终止密码子。该变异发生于基因的倒数第二个外显子的最后50 个碱基,超过10%的蛋白区域受影响,影响了酶的活性,在人群基因组突变频率数据库(gnomAD)中的频率为0.00308042,根据ACMG 指南该变异定义为可能致病(PVS1_Strong+PM2+PM3)。PVS1_Strong 指无义突变为失功能性突变,属强致病性证据;PM2 表示为隐性遗传病中频率极低的变异位点,属中等致病性证据;且在反式位置上检测到,属中等致病性证据PM3。
c.406G>A 变异已有报道[5],该突变发生于溶血磷脂酸酰基转移酶的功能结构域,在人群基因组突变频率数据库(gnomAD)中的频率为1.47×10-5,根据ACMG 指南该变异定义为可能致病(PM3_Strong+PM1+PM2+PP3)。该变异与c.646A>T 变异位点构成复杂杂合,且为反式位置上检测到,属强致病性证据PM3_Strong;该变异发生于酶功能结构域,属中等致病性证据PM1;为隐性遗传病中频率极低的变异位点,属中等致病性证据PM2;经多种统计方法预测,提示该变异对基因或基因产物造成有害影响,支持致病性证据PP3。
本例2 个基因变异类型皆在中国知网数据库中未见报道。结合患儿的临床表型和基因型,2 例均为CGL1 诊断明确。
三、文献复习结果
以 “先天性全身性脂肪营养不良、AGPAT2 基因变异”为关键词,在万方、知网、PubMed 数据库查阅中国CGL1 患者,共检索到4 篇中文及1 篇英文文献,报导了5 例来自我国的因AGPAT2 基因变异导致的CGL1 病例[4,6-9],多数患者存在脂肪减少等代谢异常,其临床资料见表2。

表2 AGPAT2 基因突变的临床特点及基因表型
讨论
CGL 由Berardinelli 和Seip 在20 世纪50 年代首次报道,故又称Berardinelli-Seip 综合征,该病是一种罕见的常染色体隐性遗传性疾病,发病率约为1/1 000 万。目前,全球报道的CGL 病例有近500例,其发病率的种族间差异较大[10-13]。CGL1 在亚裔中少见,在为国人群中目前仅见6 例CGL1 的报道(包括本例)。
一、临床表现及发病机制
CGL1 患者临床表现为多种代谢障碍,如IR、AN、糖尿病、高甘油三脂血症、肝脂肪变性、多囊卵巢综合征和高血压等[10]。本例患儿最主要的临床特征是AN。AN 是肥胖和IR/高胰岛素血症最常见的皮肤表现之一,其产生机制是过量的胰岛素刺激胰岛素样生长因子受体,促进表皮角化细胞和成纤维细胞增殖。AN 的发展与肥胖程度呈正相关,在非肥胖儿童中极少见,但在CGL1 患者中的发病率可达25%~68.2%[1,14],在儿童早期或青春期后发展,可影响全身多个部位。本例患儿生数月即发现AN 和多毛症状,随着年龄增长AN 逐渐加重,检查发现严重的IR。CGL1 患者青春期后可导致继发性糖尿病,最常见的发病年龄为15~20岁,该患儿尚处于青春期,但已经出现了糖耐量异常,要高度警惕随年龄增长出现糖尿病的可能性。
CGL1 的发病机制是由于AGPAT2 基因突变影响PI3K/AKT 通路,导致葡萄糖氧化障碍,从而引起严重的IR、AN 及糖尿病[15]。CGL1 患者的瘦素、脂联素水平可能会降低,脂联素具有胰岛素增敏、抗炎和抗凋亡作用,通过激动AMPK 和PPAR 通路,抑制糖异生减少葡萄糖的生成;而通过促进肝脏和肌肉组织脂肪酸的氧化,可降低血脂水平并减轻IR[16]。Antuna-Puente 等[17]评估了35 例CGL(16 例CGL1和19 例CGL2)患者的血瘦素和脂联素水平,结果发现,相对于CGL2 患者,CGL1 患者的血瘦素水平较高,脂联素水平较低,甚至测不到,且受试者操作特征曲线分析显示,脂联素水平超过1.6 mg/L 的CGL 患者不出现AGPAT2 突变,这使得脂联素检测有望成为鉴别CGL1、CGL2 的可靠指标。本例CGL1 患儿脂联素水平为0.28 g/mL,远低于正常值,与之前的研究完全一致。脂联素的降低使机体无法正常调控糖脂代谢,进一步弱化了胰岛素对血糖调控的能力。因此,该患儿将来发展为糖尿病的概率极高,需密切监测血糖,并尽早进行干预治疗。
二、基因突变
AGPAT2 突变影响了甘油磷脂和甘油三酯的合成,导致脂肪细胞内甘油三酯的消耗。此外,AGPAT2 突变还可影响与脂肪分化高度相关的PPAR 通路的信号转导,导致脂肪分化成熟障碍,引起皮下脂肪减少[15]。因此,CGL1 患者具有特征性的体脂分布,在大部分皮下、腹腔、胸腔区域和骨髓中缺乏代谢活性脂肪组织[10]。本例患儿的BMI 为19.80 kg/m2(P85~P90)属偏高。目前国内外文献记录的CGL1 病例,除部分婴儿病例存在严重的营养不良低体重外,其余儿童及成人BMI 均无显著降低[9],其机制可能与该病并未导致严重的全身营养不良有关,疾病造成脂肪减少,而身体的肌肉、骨骼等相关组织并无显著影响。
在CGL1 患者中多毛、阴蒂增大和月经不调很常见,一些患者存在原发性或继发性闭经和多囊卵巢,IR 引起卵巢雄激素分泌过多可能是主要原因[18]。本例患儿的骨龄已达15岁,显著大于实际年龄,表现多毛、多囊卵巢、性激素水平偏高,其生殖功能是否会受影响需密切观察随访。
AGPAT2 突变目前在中国仅报道了5 例(本例为第6 例),均为近3 年报道。本文汇总比较了我国CGL1 患者临床表型的异同点(见表2)。所有患者均有脂肪减少,肌肉明显的表现;除本例患儿外,所有患者均有肝肿大,多有糖尿病及高甘油三酯血症,而本例患儿皆无以上症状,可能与其基因变异类型有关。本例患儿AGPAT2 基因的2 个突变位点并不位于高度保守的基序NHX4D 和EGTR上,且c.646A>T 这一无义突变虽然导致终止密码子的提前出现,但因其位置较靠后,且非纯合突变,推测可能保留了部分酶活性,从而造成一些临床表现型相对较和缓。本例患儿存在腹部脂肪减少,但并非似其他文献报道的皮下脂肪菲薄,可能也与突变类型相关。另外,本例患儿与多数报道病例一样存在腹肌轮廓突出,也间接提示局部脂肪的减少。6 例患者中有3 例出现较严重的AN 和多毛(包括本例),这些患者皆为女性,年龄均大于10岁,说明在女性及青春期后AN 症状更为明显,这与国外的报道一致。本例患者除AN外,其他临床表现比国内之前报道的病例都轻,若无详细的检查分析容易漏诊,了解基因型和表型之间的关联可以帮助临床医师更好地诊断相关疾病。
三、治疗
CGL 目前缺乏根治方法,治疗上主要是对症治疗,需要展开包括儿内科、儿外科、心理科、营养科等多学科的团队合作管理及长期随访观察[10]。饮食上推荐患者食用高碳水化合物、低脂、低蛋白饮食,三大营养物质的摄入比例是碳水化合物∶脂肪酸∶蛋白质为(50%~60%)∶(20%~30%)∶20%,这种饮食可以减少乳糜微粒血症,保障患儿生长发育的需要[19]。本例患儿主要表现为严重的高胰岛素血症(空腹达66 μIU/mL,120 min 时>1 000 μIU/mL,正常值为2.6~24.9 μIU/mL)、糖耐量异常,故予二甲双胍口服治疗,目前血胰岛素已降至27.91 μIU/mL,空腹血糖正常,后期仍需密切随访血糖及胰岛素情况,如出现糖尿病应遵照糖尿病处理方案,包括口服降血糖药物及胰岛素替代治疗。由于CGL 患者的瘦素水平均较低,美曲普汀(metreleptin)为人工合成的瘦素类似物。2014 年2月,美国食品和药物管理局首次批准将其用于CGL 患者的临床治疗,但国内尚未引进。
总之,对临床表现为AN、IR 及高甘油三酯血症等多种代谢障碍,并伴有皮下脂肪减少的患儿,要考虑有CGL 的可能性,建议完善血瘦素、脂联素检查,并行基因检测进一步精准诊断。本病目前尚无特效治疗方案,关键为早期诊断、及早进行合理的营养支持、控制血糖血脂,避免代谢并发症的发生及加重。
