循环肿瘤细胞富集技术研究进展
2022-02-19沈素雅黄建钊李小怀
沈素雅,黄建钊,李小怀
(1.贵州省人民医院,贵州 贵阳 550000;2.贵州医科大学临床医学院,贵州 贵阳 550000)
循环肿瘤细胞(circulating tumor cell,CTC)是指因自发或诊疗操作从实体肿瘤脱落进入血流,在循环系统中存活,从而转移的肿瘤细胞,可在血液中被检测到[1]。据统计,肿瘤患者的死亡90%是肿瘤转移所致,早期诊断和治疗可以提高肿瘤的治疗效果[2]。因此,开展CTC的系统研究,对于肿瘤的诊断、个体化治疗、药物开发、预后评估等具有重要的意义。近年来,随着分子生物学技术的不断发展,CTC作为肿瘤生物标志物进行预后评估的研究逐渐成为热点。由于CTC在血液中含量极少,富集和检测技术成为制约其临床应用的瓶颈。本文对CTC富集分离技术的最新研究进展进行综述,为日后其在临床实践中的应用提供参考。
1 CTC的研究价值及分离技术难点
CTC在肿瘤诊断和预后中的应用价值已被证实[3],如可以确定疾病的阶段、监测患者对治疗的反应。相对于传统影像学检测和穿刺活检等方法,以血液检测形式进行的CTC检测,更加安全。通过检测有无CTC,可辅助判断肿瘤发生与否。另外,CTC含量可随病情和治疗状况的变化而变化,因此还可以用于肿瘤预后的评估。此外,将富集的CTC进行离体培养[4],可能有助于动物模型中肿瘤转移的功能研究,分析肿瘤对各种治疗反应的药理学作用,开发针对肿瘤转移的干预治疗药物。
目前,从患者样本中富集CTC仍是一项技术难题,因为CTC检测技术需要将肿瘤细胞从全血中分离出来,但用于识别CTC的生物标志物并不具有足够的特异性,即使是在同一患者体内,也没有单一的生物标志物可以识别所有的CTC。由于每毫升血液中大约只有数个CTC,而正常的血细胞有数十亿个[5],另外还存在各种蛋白质、核酸、糖类等物质,使富集效果的灵敏度受到较大影响。此外,血液样本的处理包括对靶细胞进行预标记、固定细胞、裂解红细胞、预过滤和样本稀释等过程。虽然这些处理的目的通常是通过放大靶细胞和非靶细胞之间的对比来辅助富集过程,但可能会干扰下游基因的检测、发生细胞损失,从而影响该技术在临床应用中的实际效能。
2 CTC的主要富集方法
2.1 基于生物物理学特性的富集方法
细胞的生物物理特性取决于细胞内在特征(大小、密度、变形性和电学性质等)的差异,该特性是区分CTC与血液其他成分的标记,可用来实现CTC的分离和富集,主要包括以下几类方法。
2.1.1 基于微流控的富集法 微流控技术主要利用CTC和背景细胞之间的物理或生物差异来实现CTC的富集,由于其具有设计简单、操作简便、处理能力强等优点,在CTC的富集中被广泛应用。膜滤过富集法通过滤膜过滤分离出CTC,较少受CTC表型改变的影响,如市售的ISET(法国Rarecell公司)[6]和ScreenCell(法国ScreenCell公司)[7]设备能够较好地保持细胞原有形态,但易混杂其他血细胞,导致富集纯度偏低,更适用于CTC富集的预处理。密度梯度离心法利用分离介质及高速离心使存在密度差异的细胞群落分层,也属于“无标记”法。如OncoQuick法(德国Greiner Bio-one公司)通过内置多孔屏障,防止分离后的CTC被全血细胞污染,提高了富集效率,但成本高,用血量大,且易受离心时间、环境因素的影响[8]。近期国外有研究者开发出一种新型微滤装置,可实现样本处理、免疫染色、荧光分析等步骤的自动化,捕获率为93%,且分离出的细胞能继续进行分子生物学分析,有望成为临床实践中有广阔应用前景的方法[9],但尚需大规模临床研究进行验证。
2.1.2 基于流体力学的富集技术 流体力学方法主要基于不同细胞所受液体动力的影响不同进行富集。(1)确定性侧向位移(deterministic lateral displacement,DLD)技术。利用微流控通道的层流特性对细胞进行尺寸识别,细胞撞击在周期性移动的微米柱上后,会沿不同方向游动[10],且不易发生堵塞[图1(a)]。已有研究使用微流控芯片证明了DLD技术可在多种条件下有效分离微粒,且对细胞的存活率影响较小[11-12]。(2)惯性聚焦技术。利用惯性升力和Dean涡流原理将CTC与血细胞分离。LEE等[13]设计的缩-扩微流控通道(contraction-expansion array,CEA)能够直接从全血中分离出回收率达99.1%的CTC(纯度为88.8%),但其准确率会受流速的影响[图1(b)]。WARKIANI等[14]根据此原理设计了一种螺旋微流控装置,对癌细胞的捕获率≥85%,对白细胞的去除率达99.99%。(3)涡流捕获技术。利用细胞在微通道中受到的涡流力来捕获CTC。RENIER等[15]利用Vortex芯片从晚期前列腺癌患者血液中分离CTC。Vortex芯片操作时间短、通量高、纯度高,且无需标记,适用于临床各类样本和肿瘤类型,但需精确控制样本流量和装置的几何形状。
2.1.3 基于超声波的富集技术 依靠超声波对微流体产生的震荡压力分离CTC,可保持细胞的完整性和存活率。细胞所受到的力与其大小、密度、可压缩性成正比,可使其以不同的速度和方向流向相应的通道。ANTFOLK等[16]设计的微流控芯片使CTC在较高频的声波作用下被选择性地移向压力通道的中心,而较小的白细胞则向壁侧运动[图1(c)],对前列腺癌细胞系DU145的回收率为(94.8±2.8)%,污染率为(2.2±0.6)%。LI等[17]利用超声波操纵微粒,在细胞和生物体研究的基础上,设计了一个与微流控通道具有一定角度的附加表面声波装置,通过优化装置参数,实现了乳腺癌患者CTC的高效富集[图1(d)]。基于声波的富集技术较温和,且具有生物兼容的特性,但其通量有待提高,迫切需要开发高性价比的富集技术。
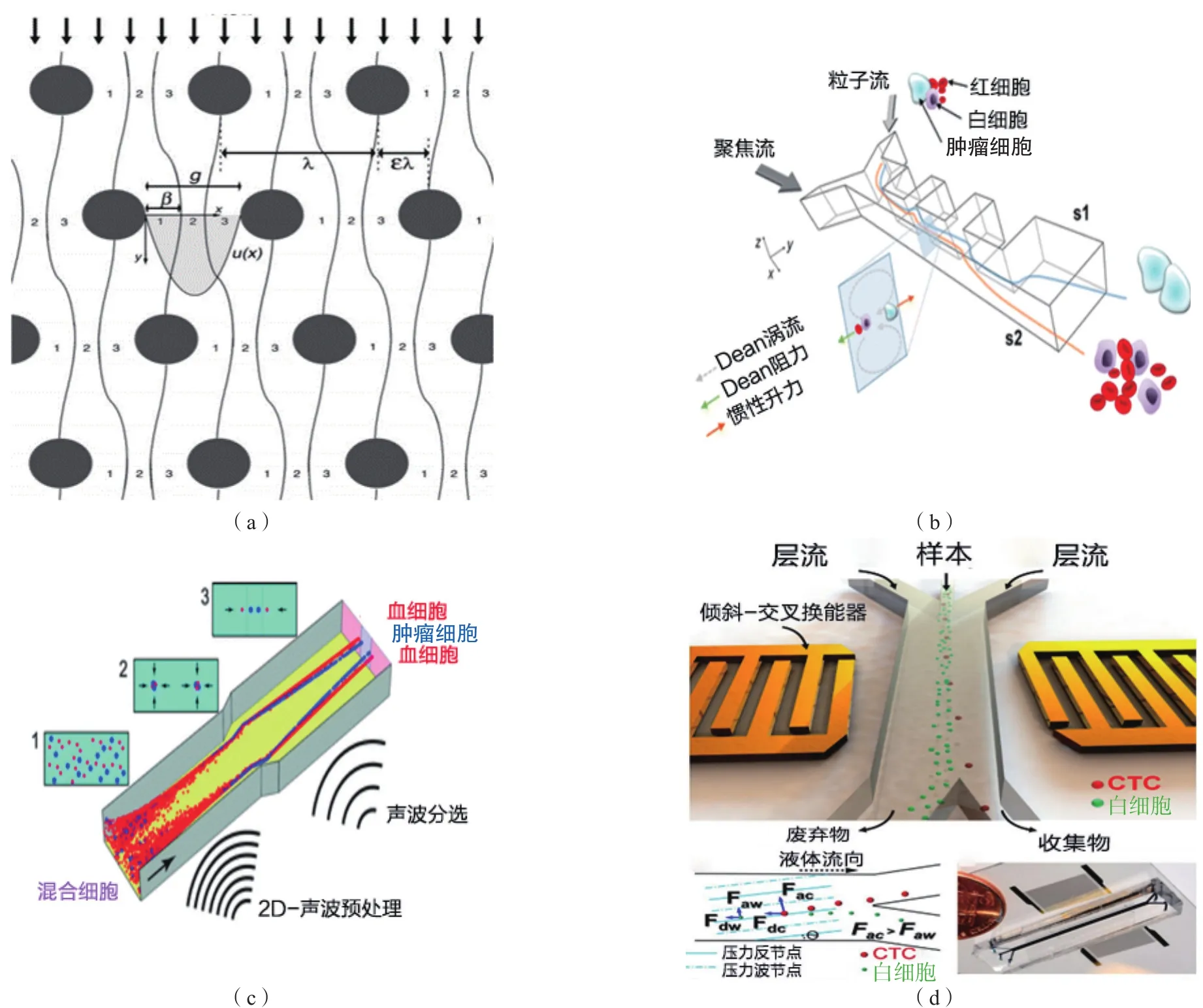
图1 不同CTC富集技术示意图
2.1.4 基于电泳的富集技术 在基于双向电泳(dimensional electrophoresis,DEP)的富集技术中,不同介电常数的细胞在电场中所受到的电场力的大小和方向会有所差异,通过设置电激频率,可将细胞群朝相应的方向驱动。CHENG等[18]采用DEP富集装置,使用3D的V形弯形通道,在电场力作用下对CTC进行电泳分离,该装置对肺癌细胞株AS2-GFP的回收率达到85%(纯度为90%)。利用CTC固有的电学特性,“无标记”且肿瘤细胞存活率高、分选纯度高,使DEP富集技术较具吸引力,但仅凭微弱的电泳力很难快速感应到CTC,若用于临床应用中,还需对其富集效率和纯度进一步完善。
2.2 基于生物化学特性的富集方法
CTC的生物化学特性主要体现在CTC的细胞膜上存在的配体与肿瘤特异性抗原之间的高度特异性作用。大多数富集方法是将亲和配体(抗体或适配体)固载于微通道或磁珠上,通过增加细胞与配体的接触,实现高效率、高纯度的富集效果。
2.2.1 基于抗体的富集方法 以抗体为基础的方法是利用CTC与血细胞之间特异性细胞膜抗原表达的差异分离CTC,主要有免疫磁珠和固载抗体微通道2种方法。免疫磁珠法的基本原理是带有磁珠的抗体与CTC表面抗原结合,在磁场的作用下使CTC与血细胞分离。SALIBA等[19]开发了一种具有抗体功能和超顺磁珠的微流控设备,捕获效率超过94%,但由于易受流体动力阻力的影响,其通量较低。张磊等[20]利用免疫磁珠法和免疫荧光技术建立了一种高效的CTC阴性富集方法和免疫荧光鉴定方法,CTC回收率为62.5%~95.0%,但仍需进行大量的临床样本研究加以验证。目前,上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是最常用的生物标志物,采用EpCAM结合免疫磁珠可捕获肺癌[21]、结直肠癌[22]、乳腺癌[23]等肿瘤患者的CTC。但由于CTC存在上皮-间质转化现象,可能会造成假阴性结果,且细胞在磁场中极易发生聚集,分离与磁珠结合的细胞可能会影响后续检测。因此,寻找肿瘤细胞的特异性靶标,并使用多种生物标志物进行CTC分离和计数是未来富集技术的重要研究方向。除免疫磁珠外,还可将抗体固载于微流控芯片中捕获CTC,其优点在于富集流程高度自动化,且能使富集的CTC保持较高的活性。微通道虽可增加细胞与配体的接触,但易阻塞,不利于高通量检测。STOTT等[24]在微通道混合的研究基础上开发了HB-Chip,通过产生微涡流使CTC与抗体接触增加,对前列腺癌细胞的捕获效率为普通芯片的2.7倍,且比CTC-Chip的捕获率高26.3%。CHENG等[25]开发了一种3D支架芯片,进一步提高了全血CTC的捕获率。基于抗体的富集方法在识别靶细胞方面具有较高的特异性,被广泛用于CTC富集技术中,但其重复性差、保存期短、成本高、释放过程复杂等,未来需要克服这些技术难题。
2.2.2 基于适配体的富集方法 适配体可以识别并特异性地与靶细胞结合,具有亲和力高、可重复、保质期长、成本低、易与多种功能基团结合等优点。ZHAO等[26]在微流控通道的硅纳米线基底表面固定多种适配体,发现不同适配体间的协同作用增强了捕获的亲和力,提高了CTC用于肿瘤临床监测的准确性。LABIB等[27]开发了一种新型2D微流控技术,CTC先被适配体偶联的磁性纳米颗粒标记,再根据各表面标志物的表达水平不同对CTC进行分类,提高了CTC富集的敏感性。
2.3 多种方法相结合的CTC富集方法
CTC分离富集策略多样,但各有优缺点,见表1。因此,通过优化装置将多种方法组合在同一设备中,或能避开各自的不足,并为CTC富集提供更高的灵敏度和特异性。KARABACAK等[28]开发的CTC-iChip将DLD技术、惯性聚焦技术和基于亲和力的负性筛选方法通过磁泳技术结合在同一台设备中,实现了更高的回收率,纯度也大大提高。WANG等[29]将DLD技术与磁激活细胞分选技术集成在一起,建立了不依赖肿瘤抗原的高效分离方法。PARK等[30]采用免疫亲和、密度梯度离心和微流控芯片联合来富集全血中的乳腺癌细胞株MCF-7和肺癌细胞株DMS-79,提高了CTC富集的回收率,降低了白细胞污染,且DMS-79细胞(89%)和MCF-7细胞(99%)的回收率都很高。JACK等[31]开发了一种超特异性微流控技术,通过惯性力对血液样本进行预处理,然后用EpCAM功能化磁珠标记CTC,再用磁泳法分离CTC。虽然多种技术的结合可以极大地增强CTC检测的敏感性和特异性,提高富集效率,但需要对微流控设备进行复杂的设计,不同方法之间的集成度较低,操作更复杂,制造成本更高,这些缺点限制了富集技术的商品化发展。因此,有必要开发操作简单、集成度高、性能好的微流控装置,用于CTC的富集分离。CTC富集分离技术目前的应用情况见表2。

表1 不同CTC富集技术的优缺点

表2 CTC富集技术的应用现状
3 总结与展望
CTC富集分离与检测技术正逐渐被应用于临床,通过评估肿瘤异质性、动态监测CTC的变化,有助于早期诊断疾病,实现精准医疗。从肿瘤患者的血液样本中直接富集CTC,可以提供一种替代创伤性手术活检的方法,并通过系列的“液体”活检,实现肿瘤的个体化治疗。但各项CTC富集分离技术优缺点不一,将研究成果真正转化并应用于临床,还需要对其进行改良。将物理特性、化学特性与微流控技术结合,设计多种方法结合的分离和富集方法,是CTC捕获的重要研究方向。这需要深入理解CTC的特性,对肿瘤细胞进行准确捕获,以开发更加高效的富集检测技术。随着CTC富集检测技术水平的提高,CTC结合影像学或病理学方法,可更加全面、精确地反映患者病情,进而选择适合的治疗方式。
目前,从临床样本中有效富集CTC仍然是一个难题,为了更好地满足临床要求,以下几个问题值得注意:(1)CTC的富集方法很多,但富集数量仍十分有限,更高的富集效率可能需要新技术或多种技术相结合,需深入探索;(2)探究肿瘤细胞生物学特性,寻找特异性CTC的靶标,对肿瘤细胞进行准确的富集分离,是目前CTC检测真正进入临床的主要瓶颈,尚需更多临床研究结果验证靶标的有效性;(3)由于CTC的播散规律尚不清楚,且肿瘤细胞常常随机脱落入血,CTC的检测时间尚需进一步确认;(4)外周血中CTC极少,CTC随机脱落入血存在一定的数量波动,易对病情判断和预后评估造成误差,需要进行多中心、大样本、长周期的基础研究,获取CTC相关的生物学特征和信息;(5)不同的富集方法使用不同的富集设备和条件,其灵敏度和特异性均有差异,而这些差异可能会影响结果的可比性;(6)CTC对肿瘤的早期诊断和分期判断具有重要意义,CTC计数和表型的转变可在一定程度上指导临床决策,但尚需开展更多针对CTC表型与肿瘤发展和治疗关系的研究。
综上所述,CTC富集技术的敏感性、特异性、精确性和可重复性目前仍难以客观判断。尽管困难重重,但随着该技术的飞速发展,CTC富集的便捷性和实效性将会进一步提升,CTC富集技术必将拥有广阔的应用前景。
