参附注射液治疗心肌缺血再灌注损伤网络药理学分析
2022-02-19孔智谦莫梦莹陈达满黄海燕
孔智谦 莫梦莹 陈达满 黄海燕





〔摘要〕 目的 基于網络药理学研究预测参附注射液治疗心肌缺血再灌注损伤的主要活性成分、作用靶标和相关信号通路,并应用体外实验验证,揭示参附注射液治疗心肌缺血再灌注损伤潜在作用机制。方法 应用中药系统药理学数据库与分析平台收集参附注射液的有效活性成分和靶点信息;在GeneCards疾病数据和DisGeNET疾病数据库中收集缺血再灌注损伤疾病靶点;取药物靶点与疾病靶点进行交集映射;运用STRING数据库构建蛋白质-蛋白质相互作用网络,获取核心靶标信息;运用R软件进行GO分析和KEGG通路富集分析;最后运用体外实验验证参附注射液核心成分对对CASP3、CASP8、AP-1、IL-1β、IFNG作用靶点的调控作用。结果 预测发现参附注射液有效活性成分有9个,靶点有56个,有38个潜在作用靶点作用于缺血再灌注损伤的治疗,包括CASP3、CASP8、IL-1β等;涉及IL-17、TNF、p53等信号通路;体外细胞实验结果验证参附注射液的有效活性成分可活化IL-17和TNF信号通路,下调相关靶标CASP3、CASP8、AP-1、IL-1β、IFNG的表达,抑制炎症反应和细胞凋亡。结论 参附注射液有多成分、多靶点的优势,其治疗缺血再灌注损伤的作用机制可能为活化IL-17和TNF信号通路,为新药开发和后续研究提供参考。
〔关键词〕 心肌缺血再灌注损伤;参附注射液;网络药理学;β-谷甾醇;人参皂苷
〔中图分类号〕R256.22 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.026
〔Abstract〕 Objective To predict the main active ingredients, action targets and related signaling pathways of Shenfu Injection in the treatment of myocardial ischemia reperfusion injury based on the network pharmacological research, and to explore the potential action mechanism of the Shenfu Injection for myocardial ischemia reperfusion injury through in vitro experimental verification. Methods The TCM system and pharmacological database and analysis platform was used to collect the effective active ingredients and targets information of the Shenfu Injection; ischemic reperfusion injury disease targets were collected in GeneCardsdisease database and DisGeNET disease database; intersection mapping of drug targets and disease targets was carried out; the protein-protein interaction network was constructed using the STRING database to obtain core targets information; R software was used for GO analysis and KEGG pathway enrichment analysis; finally, in vitro experiments were used to verify the control effect of the core component of Shenfu Injection on the activation of CASP3, CASP8, AP-1, IL-1β, IFNG. Results It is predicted that there were 9 effective active ingredients of the Shenfu Injection, 56 targets and 38 potential targets acting on the treatment of ischemia reperfusion injury, including CASP3, CASP8, IL-1β, involving IL-17, TNF, p53 signaling pathways, etc. In vitro cell experimental results confirmed that the Shenfu Injection can activate IL-17 and TNF signaling pathways, reduce the expression of relevant targets CASP3, CASP8, AP-1, IL-1β, IFNG and inhibit inflammatory response and apoptosis. Conclusion Shenfu Injection has the advantages of multi-component and multi-target, and its mechanism of action in the treatment of ischemia reperfusion injury may be the activation of IL-17 and TNF signaling pathways, which can provide reference for the development of new drugs and subsequent studies.
〔Keywords〕 myocardial ischemia reperfusion injury; Shenfu Injection; network pharmacology; interleukin-17; tumor necrosis factor; β-sitosterol; ginseng saponin
心肌缺血再灌注损伤是指心肌缺血后恢复心肌血液灌注,不但没减轻心肌损伤反而造成心肌严重不可逆性损伤的现象[1]。缺血性心脏病是严重威胁人们生命健康的疾病,近年来随着我国社会的发展和人民生活方式的改变,缺血性心脏病发病率不断提高,并有年轻化的趋势,研究显示缺血性心脏病是我国第二大死亡原因[2]。及时恢复缺血心肌的血液灌注是治疗的主要策略,临床常用冠状动脉旁路移植术、经皮冠状动脉介入治疗、溶栓治疗等及时恢复心肌血液供应,挽救坏死的心肌,临床上取得了很好的疗效,但仍无法完全防止再灌注造成的伤害。因此,寻找有效治疗手段减轻心肌缺血再灌注损伤,保护心肌细胞,改善缺血性心脏病预后已成为现在国内外研究焦点。
中药有多成分、多靶点、多通路的特点,在防治缺血再灌注损伤上有独特优势[3]。参附注射液是中医学经典名方“参附汤”通过剂型改良提取而成的中药注射液,在临床上广泛应用于心脑血管疾病的治疗[4]。已有研究表明参附注射液能有效缓解和改善缺血再灌注损伤,有抗凋亡,保护心肌细胞的作用[5-6],但目前参附注射液对心肌保护作用机制尚未明确。本研究旨在通过网络药理学预测参附注射液治疗缺血再灌注损伤的主要活性成分、作用靶标和相关信号通路,并应用体外实验验证,揭示参附注射液治疗缺血再灌注损伤的潜在作用机制。
1 资料与方法
1.1 参附注射液的有效活性成分和靶点信息获取
以“红参”和“附子”为“Herb name”在中药系统药理学数据库与分析平台(traditional Chinese medicine
systems pharmacology database and analysis platform,TCMSP,https://tcmspw.com/tcmsp.php)中检索,设置口服生物利用度(oral bioavailability, OB)≥30%,药物类药性(drug likeness, DL)≥0.18,遴选有效活性成分。依据所选有效活性成分在TCMSP中筛选所得有效活性成分的靶点信息。在STRING数据库(https://www.string-db.org)和UniProt数据库(https://www.uniprot.org)中检索相应靶点信息的标准基因名。
1.2 缺血再灌注损伤疾病靶标信息获取
以“ischemia reperfusion injury”(缺血再灌注损伤)为疾病检索词在GeneCards疾病数据库(https://www.genecards.org)和DisGeNET疾病数据库(https://www.disgenet.org)中檢索相关靶标信息,并进行汇总去重。
1.3 构建“参附注射液-活性成分-潜在靶点网络”
取参附注射液与缺血再灌注损伤的交集靶标基因输入到Cytoscape 3.7.2软件进行可视化处理,构建“参附注射液-活性成分-潜在靶点网络”。
1.4 构建蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络
将参附注射液与缺血再灌注损伤的交集靶标基因输入到STRING数据库,选择物种“Homo”,最低相互作用阈值选择0.400,并选择隐藏游离的靶点,获取蛋白互作网络信息。
1.5 GO分析和KEGG富集分析
筛选参附注射液治疗缺血再灌注损伤的关键基因导入到R软件的cluster profiler包进行GO富集分析和KEGG通路富集分析,使用ggplot2包进行可视化分析,输出GO富集分析包括分子功能、生物学过程、细胞组分和KEGG通路分析的气泡图。
1.6 体外实验验证
1.6.1 缺血再灌注损伤建模 购买30只2日龄C57BL/6小鼠乳鼠,体质量(2.05±0.37) g,饲养于广州中医药大学动物实验中心,实验动物生产许可证号:SCXK(粤)2018-0034,经广州中医药大学动物实验伦理审查委员会审批通过(许可证号:20200615),随机分为对照组(n=8)、模型组(n=8)、β-谷甾醇组(n=7)和人参皂苷组(n=7)。提取小鼠原代心肌细胞,将心肌细胞放入无血清无糖的DMEM培养基,放入37 ℃含5% CO2、95% N2的低氧培养箱中无氧培养4 h,后置换为含糖、含胎牛血清的DMEM培养基,放置在37 ℃含95%空气、5% CO2的培养箱中培养2 h,构建并完成心肌缺氧/复氧模型[7-9]。依据网络药理学研究结果,选取20 μmol/L β-谷甾醇[10]、50 μmol/L人参皂苷[11]分组给药干预48 h。
1.6.2 实时定量PCR检测 采用TRIzol试剂(北京智杰方远科技有限公司,批号:15596018)提取细胞总RNA[12],超微量分光光度计测定RNA的纯度和浓度。取适量RNA按照Takara逆转录试剂盒(北京智杰方远科技有限公司,批号:RR047A)说明书反转录为cDNA。按照Takara试剂说明书(北京智杰方远科技有限公司,批号:RR420A)操作检测CASP3、CASP8、AP-1、IL-1β、IFNG mRNA,选择GAPDH为内参基因。在实时荧光定量PCR仪(北京龙跃生物科技发展有限公司,型号:LightCycler 96)上运行RT-qPCR反应。RNA逆转录为cDNA的反应条件为42 ℃ 2 min和37 ℃ 15 min,85 ℃ 5 s。PCR的反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。CT值的计算公式为:2-ΔΔCt。以cDNA为模板,引物序列见表1。
1.6.3 统计学方法 所有统计分析都使用GraphPad Prism 5.01和SPSS 20.0进行,计数资料符合正态分布,以“x±s”表示,多组间数据比较选择单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 参附注射液活性成分筛选结果
在TCMSP中筛选出参附注射液有效活性成分9种。红参有3种,包括β-谷甾醇(β-sitosterol)、人参皂苷rh2(ginsenoside rh2)、邻苯二甲酸二正辛酯(di-n-octyl phthalate);附子有6种,包括德尔妥因(deltoin)、飞燕草苷(delphin)、水黄皮素(karanjin)、去氧穿心莲内酯(deoxyandrographolide)、谷甾醇(sitosterol)、11,14-二十碳二烯酸(11,14-eicosadienoic acid)。各有效活性成分信息依据靶标频次降序排列见表2。
2.2 参附注射液治疗缺血再灌注损伤的靶点预测
将检索到的参附注射液有效活性成分在TCMSP中筛选出相应靶点信息,汇总去重后得到56个药物作用靶点。在GeneCards疾病数据库和DisGeNET疾病数据库中检索疾病靶点信息,汇总去重后得到1676个疾病靶点。将参附注射液靶点信息与疾病靶点信息进行交集映射,得到交集靶标38个。见表3。构建“参附注射液-缺血再灌注损伤交集靶标”韦恩图。见图1。导入Cytoscape 3.7.2软件,构建“参附注射液-活性成分-靶点信息”网络图。见图2。
2.3 构建参附注射液PPI网络
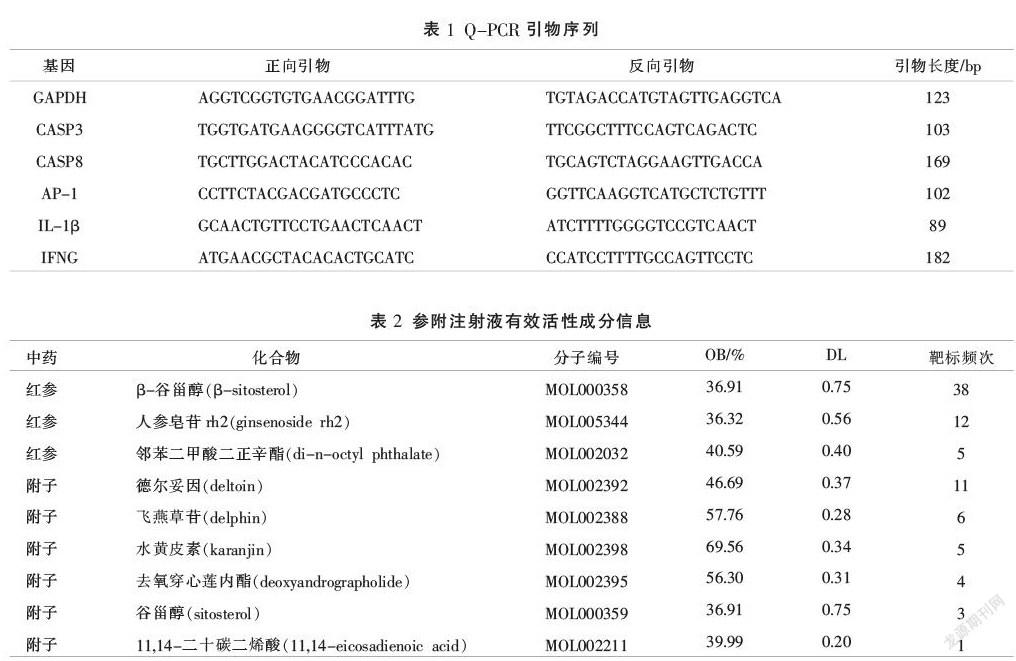
将所得交集靶点导入STRING数据库制作PPI网络,设置最低相互作用阈值选择0.400,并选择隐藏游离的靶点,为进一步分析交集靶点间的相互作用联系,将靶点信息导入到Cytoscape 3.7.2软件,利用cytoHubba插件中的最大集团中心性(maximal clique centrality, MCC)算法计算分析靶点得分,依据MCC得分筛选参附注射液治疗缺血再灌注损伤靶点,得到参附注射液蛋白互作网络PPI。见图3。筛选所得MCC得分排序见表4。
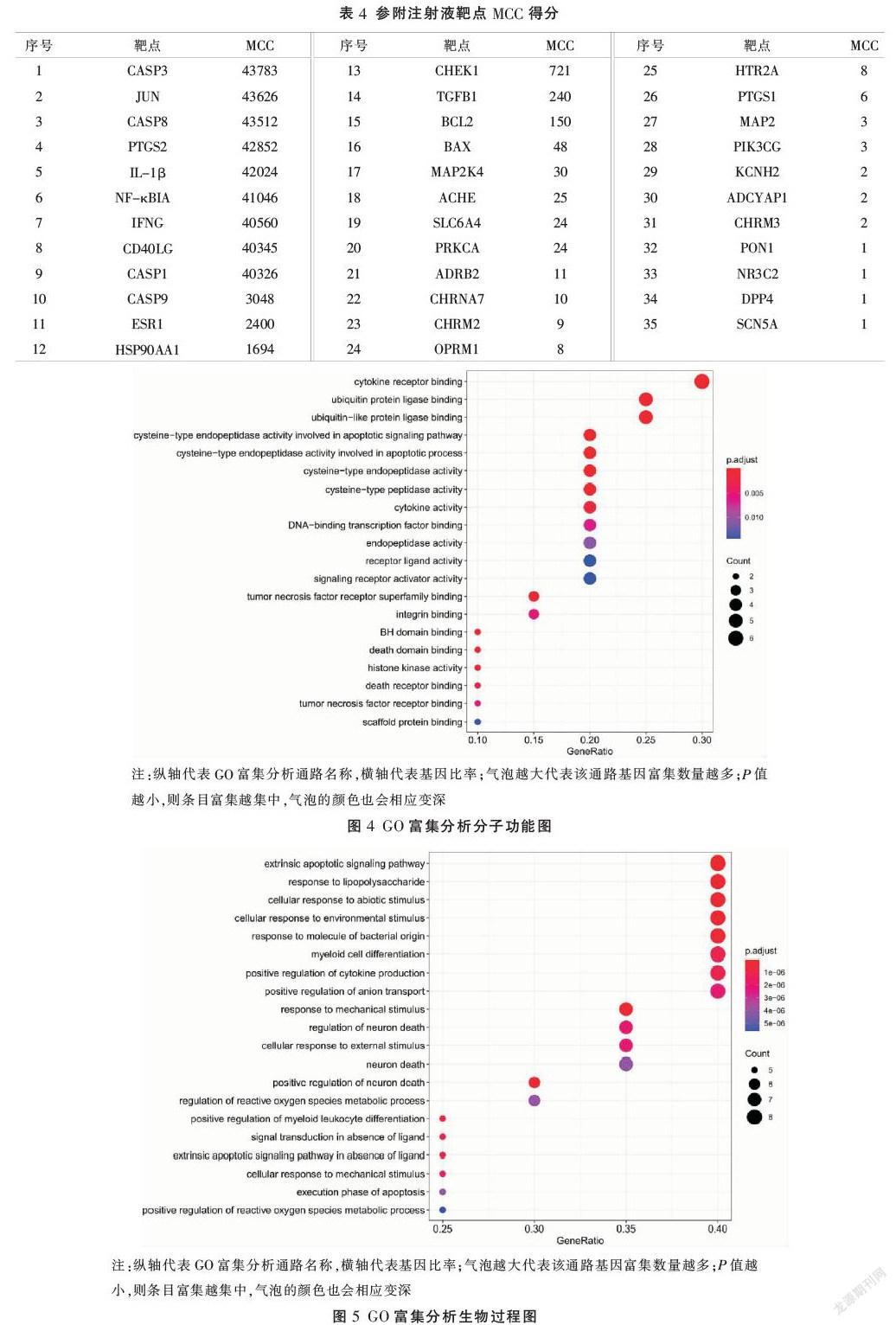
2.4 GO富集分析和KEGG通路富集分析
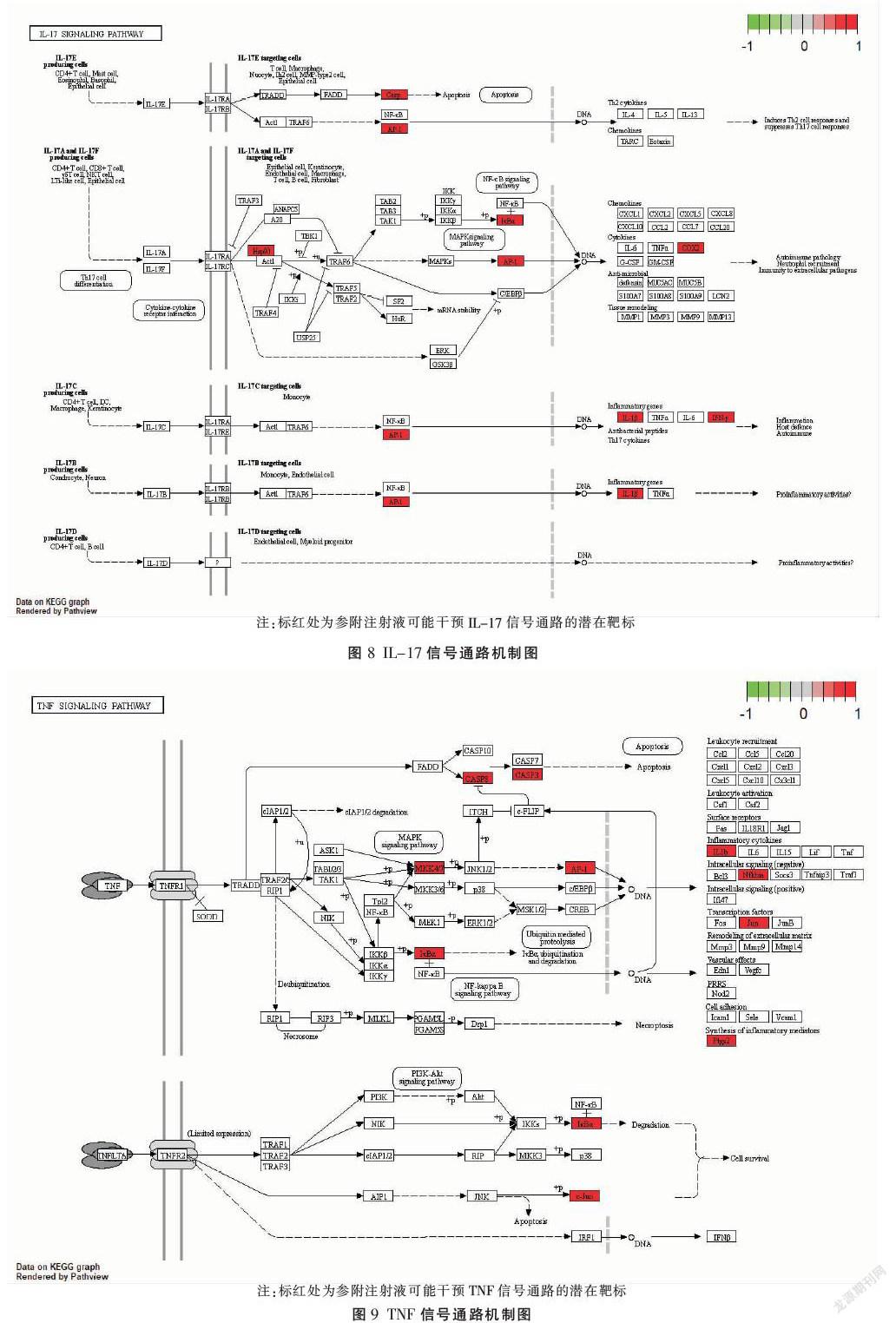
核心基因GO富集分析共获得富集条目961条,计算各富集分析结果相对应P值,每部分P值筛选为P<0.05,排名前20的条目见图4-6。KEGG通路富集共获得105条富集结果,与IL-17、TNF、p53等信号通路有关,筛选排名前20的通路见图7。运用R软件对IL-17、TNF信号通路进行靶标通路分析。见图8-9。
2.5 Q-PCR检测TNF和IL-17信号通路相关基因表达
与对照组相比,模型组心肌细胞CASP3、CASP8、AP-1、IL-1β、IFNG的mRNA表达均升高(P<0.05)。与模型组相比,β-谷甾醇组心肌细胞CASP3、CASP8、AP-1的mRNA的表达均显著降低(P<0.05);人参皂苷组心肌细胞CASP3、IL-1β、IFNG的mRNA的表达均显著降低(P<0.05)。见图10。
3 讨论
中医学并无缺血再灌注损伤的病名,依据缺血性心脏病、心肌缺血再灌注损伤的临床表现,将其归为中医学“胸痹”“心悸”范畴,基本病机为本虚标实,以阳气亏虚为本,痰瘀内阻为标,治疗上主张急则治其标,以活血化瘀、温阳化气、健脾养心为治疗法则[13-14]。参附注射液是源自《校注妇人良方》之参附汤,由人参一两、附子五钱组成,附子为辛温大热之品,有回阳救逆、补火助阳、散寒止痛之效,是“回阳救逆第一品药”;人参,性甘、微苦微温,有大补元气,复脉固脱,补脾益肺,生津养血,安神益智的功效[15]。现代研究表明参附注射液可以强心利尿,降血压,减轻外周血管压力,降低心脏负荷,缓解心肌耗氧和调节心肌脂肪酸代谢的作用,可以激活超氧化物歧化酶活性,灭活氧自由基,发挥预防和治疗缺血再灌注损伤的作用[16]。临床应用上,已有临床研究证明参附注射液在防治休克、心肌梗死、心力衰竭等心脑血管疾病上取得良好疗效[17-19]。
本研究应用网络药理学技术探究参附注射液防治缺血再灌注损伤研究,初步预测了参附注射液治疗缺血再灌注损伤的作用靶点,筛选了参附注射液所含化合物和靶点信息,构建了化合物-相关靶点网络,预测了参附注射液治疗缺血再灌注损伤的生物途径和作用信号通路,从多角度探究了参附注射液治疗缺血再灌注损伤机制。本研究预测出参附注射液有效活性成分共有9个,红参3个(β-谷甾醇、人参皂苷、邻苯二甲酸二正辛酯),附子6个(德尔妥因、飞燕草苷、水黄皮素、去氧穿心莲内酯、谷甾醇、11,14-二十碳二烯酸)。四环三萜类化合物β-谷甾醇是植物甾醇的主要成分之一,有抗氧化、抗炎症反应、降低胆固醇、调节免疫反应的作用[20]。研究表明β-谷甾醇可能作用于ERK1/2信号通路,可以上调Bcl-2/Bax、下调IL-1β、IL-6的表达,缓解缺血再灌注大鼠氧化应激反应和炎症反应,抑制缺血再灌注大鼠心肌细胞凋亡[21]。人参皂苷是类固醇類化合物,主要存在于人参属中药中,临床研究证实人参所含的人参皂苷能发挥类似强心苷的作用,有扩血管和扩张冠状动脉的作用[22];Cheng等[23]通过体外实验证明人参皂苷可抑制NF-κB的转录,降低相关炎症因子的表达,对脑缺血再灌注损伤起保护作用;Wang[24]研究表明人参皂苷可调节缺血部位再灌注后血流量,通过增加谷氨酸转运蛋白-1的表达,减少缺血部位谷氨酸摄取,抑制天冬氨酸受体的表达,从而抑制细胞内钙超载,缓解缺血再灌注损伤。现代药理研究发现去氧穿心莲内酯有抑制血小板聚集、降低炎症因子表达的作用,杨毅猛等[25]从细胞凋亡途径研究发现穿心莲内酯可调节高脂血症大鼠的细胞间黏附分子-1、TNF-α;吕俊林等[26]发现穿心莲内酯有效抑制心肌高迁移率族蛋白1、NF-κB蛋白和mRNA的表达,减轻缺血再灌注大鼠心肌的炎症反应,起保护作用。
本研究共筛选出参附注射液作用靶点56个,与缺血再灌注损伤交集靶点有38个,通过对交集靶点构建蛋白互作网络,分析得出相关性较高的靶标基因有CASP3、JUN、CASP8、PTGS2、IL-1β、NF-κBIA、IFNG、CD40LG、CASP1等。炎症反应是缺血再灌注损伤的必然病理过程,现有研究表明,大鼠心肌缺血再灌注损伤会促使IL-1β的高表达,刺激内皮细胞和白细胞释放趋化因子,使局部白细胞聚集造成局部微循环障碍,损害局部心肌细胞[27-28];此外,缺血再灌注损伤使大鼠脑部海马区IL-1β表达会增加,实验中人为向大鼠脑部纹状体注射外源性IL-1β会加重大鼠缺血再灌注损伤,缺血再灌注损伤部位的IL-1β表达与炎症损伤有正相关趋势,因此抑制IL-1β的表达在治疗缺血再灌注损伤中起重要作用[29]。PTGS有两个亚型PTGS1和PTGS2,PTGS类靶点与人体炎症反应和凝血反应有重要联系[30]。Chen等[31]研究表明PTGS2在调控细胞增殖和抑制凋亡上发挥重要作用;Candelario-Jalil等[32]研究使用PTGS2抑制剂抑制PTGS2的高表达,能有效减轻缺血再灌注模型的炎症表达。研究表明可溶性CD40配体与心血管疾病有极大关联性,能预测心血管不良事件发生[33],炎症介质CD40可与膜提呈的CD40配体结合产生活性氧和活性氮,加重炎症反应[34];基质金属蛋白酶-9可以分解脑血管周围基底膜,破坏血脑屏障,触发脑缺血再灌注后损伤,而肿瘤坏死因子超基因族CD40配体是一种跨膜交换蛋白,是调控炎症反应的重要介质,研究证明使用药物抑制CD40或CD40配体能阻止基质金属蛋白酶-9的激活,减少脑组织损伤[35]。生物富集分析显示,参附注射液治疗缺血再灌注损伤主要通过外源性凋亡信号通路、神经元死亡的积极调节、半胱氨酸型内肽酶活性参与凋亡信号通路、细胞因子受体结合等发挥作用。细胞凋亡和炎症反应在缺血再灌注损伤中起重要作用。KEGG通路富集预测与脂质和动脉粥样硬化、IL-17、TNF、p53、nod样受体、VEGF、NF-κB、PI3K-Akt等信号通路有关。
结合KEGG通路富集分析和潜在作用靶点预测显示,潜在作用靶点CASP3、CASP8、AP-1、IL-1β、IFNG主要富集在IL-17和TNF信号通路上。在TNF信号通路上,CASP3、CASP8、CASP1都是半胱天冬酶家族成员,是机体主要凋亡因子,而CASP3在半胱天冬酶家族发挥凋亡作用中起关键作用[36],在缺血再灌注损伤病理过程中启动细胞凋亡程序,加重机体损伤,抑制半胱天冬酶家族的表达可以抑制细胞凋亡,减轻再灌注损伤[37]。在IL-17信号通路上,细胞转录因子AP-1可以接受细胞膜传导的信号通过磷酸化作用活化,活化后的AP-1进入细胞核与相应DNA序列结合,调控下游IL-1β、IFNG、IL-6、IL-8等促炎细胞因子释放,参与炎症反应调控[38]。体外实验检测参附注射液核心成分β-谷甾醇和人参皂苷对CASP3、CASP8、AP-1、IL-1β、IFNG的靶点有调控作用,能抑制心肌细胞在缺血再灌注的情况下发生的炎症反应和细胞凋亡,也验证了上面网络药理学的分析。
综上所述,本研究通过网络药理学预测了参附注射液治疗心肌缺血再灌注损伤的作用机制,揭示了中药注射液参附注射液有多成分、多靶点的优势,并通过体外实验验证了参附注射液的有效活性成分可能通过下调CASP3、CASP8、AP-1、IL-1β、IFNG的表达,抑制IL-17和TNF信号通路上相关下游靶点活化,起到抑制炎症反应和细胞凋亡的作用,从而起到防治心肌缺血再灌注损伤的作用。然而,基于中药有多成分、多靶点的优势,其更多相关作用机制仍待进一步研究。
参考文献
[1] SCHANZE N, BODE C, DUERSCHMIED D. Platelet contributions to myocardial ischemia/reperfusion injury[J]. Frontiers in Immunology, 2019, 10: 1260.
[2] ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J].
Lancet, 2019, 394(10204): 1145-1158.
[3] 李 冀,王洋洋,胡晓阳,等.中医药干预心肌缺血再灌注损伤研究进展[J].辽宁中医药大学学报,2021,23(2):4-7.
[4] 李 艳,陈 雨,杨 柳,等.参附注射液治疗心脑血管疾病相关物质基础及作用机制研究进展[J].中药新药与临床药理,2019,30(4):499-503.
[5] 贾合磊,卢长青,王 娟,等.参附注射液通过调控自噬减轻大鼠心肌缺血再灌注損伤的作用研究[J].中国免疫学杂志,2019,35(18):2213-2220.
[6] 邓凤珠,冯 冲,李春富,等.参附注射液对大鼠心肌缺血再灌注期间的心电图演变过程的影响及作用机制研究[J].中国比较医学杂志,2020,30(7):51-56.
[7] GREENBERG C C, CONNELLY P S, DANIELS M P, et al. Krp1 (Sarcosin) promotes lateral fusion of myofibril assembly intermediates in cultured mouse cardiomyocytes[J]. Experimental Cell Research, 2008, 314(5): 1177-1191.
[8] 孟琳琳,黄 莺,马依彤,等.小鼠乳鼠原代心肌细胞的改良培养[J].中国组织工程研究,2015,19(37):5993-5997.
[9] 程阔菊,黄 河,杜智勇,等.原代乳小鼠心肌细胞的分离培养及鉴定[J].重庆医学,2013,42(22):2638-2640.
[10] PARK C, MOON D O, RHU C H, et al. Beta-sitosterol induces anti-proliferation and apoptosis in human leukemic U937 cells through activation of caspase-3 and induction of Bax/Bcl-2 ratio[J]. Biological and Pharmaceutical Bulletin, 2007, 30(7): 1317-1323.
[11] 马增春,肖 勇,赵佳伟,等.人参皂苷Re对H9c2心肌细胞CYP450酶的影响[J].中国药理学通报,2016,32(4):494-498.
[12] 戴先成,柴智锋,徐永城,等.Trizol法大鼠心肌总RNA提取方法探讨[J].刑事技术,2014(3):15-16.
[13] 曹 蛟,张杼惠,刘建和.从中医“阳气亏虚,痰瘀内阻”理论探讨中医药防治心肌缺血再灌注损伤的机制[J].世界科学技术-中医药现代化,2021,23(2):510-515.
[14] 张伯礼,吴勉华.中医内科学[M].4版.中国中医药出版社,2019:87-99.
[15] 钟赣生.中药学[M].中国中医药出版社,2019:381-383,632-634.
[16] 曾德金.参附注射液的药理研究及临床应用进展[J].中西医结合研究,2019,11(3):159-161.
[17] 南富耀,马林沁,吴彩军,等.参附注射液治疗脓毒性休克与心脏骤停后综合征的基础与临床[J].中华急诊医学杂志,2021,30(8):920-923.
[18] 杨玉红,杨 阳,裴树亮,等.参附注射液联合多巴胺对急性下壁心肌梗死介入术后低血压病人血压的影响[J].中西医结合心脑血管病杂志,2019,17(11):1675-1677.
[19] 贾启明,张 涛.参附强心汤联合参附注射液治疗重症心力衰竭临床观察[J].实用中医药杂志,2020,36(9):1131-1132.
[20] 刘威良,姬 昱,黄艾祥.β-谷甾醇的研究及开发进展[J].农产品加工,2019(1):77-79,82.
[21] 严 宁,杨春霞,马 娟,等.β-谷甾醇对大鼠心肌缺血再灌注损伤和ERK1/2信号通路的影响[J].心血管病学进展,2020,41(3):321-325.
[22] 陈延勋,李松森,张辉锋.人参皂苷Rg1对冠状动脉粥样硬化性心脏病模型大鼠心功能及血管舒缩功能的影响[J].中医学报,2020,35(7):1491-1496.
[23] CHENG Z K, ZHANG M, LING C L, et al. Neuroprotective effects of ginsenosides against cerebral ischemia[J]. Molecules, 2019, 24(6): E1102.
[24] WANG S Y, LI M H, GUO Y, et al. Effects of Panax notoginseng
ginsenoside Rb1 on abnormal hippocampal microenvironment in rats[J]. Journal of Ethnopharmacology, 2017, 202: 138-146.
[25] 杨毅猛,田俊斌,马 磊.穿心莲内酯对高脂血症大鼠心肌缺血再灌注损伤保护作用研究[J].辽宁中医药大学学报,2020,22(6):29-33.
[26] 呂俊林,吕建瑞,贺进进,等.穿心莲内酯对心肌缺血再灌注损伤大鼠炎症的影响[J].湖北中医药大学学报,2020,22(2):21-25.
[27] 阴苏月,姜 瑜,王丹姝,等.牛舌草总黄酮通过ROS/TXNIP/NLRP3抑制炎症小体活化抗心肌缺血再灌注损伤[J].中国药理学与毒理学杂志,2021,35(10):802.
[28] 萧 闵,向晶晶,王 威,等.金香丹抑制NLRP3/IL-1β/Caspase-1信号通路缓解大鼠心肌缺血再灌注损伤[J].中国实验方剂学杂志,2021,27(20):87-94.
[29] LODDICK S A, ROTHWELL N J. Neuroprotective effects of human recombinant interleukin-1 receptor antagonist in focal cerebral ischaemia in the rat[J]. Journal of Cerebral Blood Flow and Metabolism, 1996, 16(5): 932-940.
[30] 石秀锦,胡志旭,彭文星,等.GPⅢа PLA2、PEAR1、PTGS1基因多态性与阿司匹林临床抗血栓疗效关联性研究[J].中国药物应用与监测,2018,15(1):1-4.
[31] CHEN H N, CHEN Y, ZHOU Z G, et al. A novel role for ketoconazole in hepatocellular carcinoma treatment: Linking PTGS2 to mitophagy machinery[J]. Autophagy, 2019, 15(4): 733-734.
[32] CANDELARIO-JALIL E, GONZ?魣LEZ-FALC?譫N A, GARC?魱A-CABRERA M, et al. Wide therapeutic time window for nimesulide neuroprotection in a model of transient focal cerebral ischemia in the rat[J]. Brain Research, 2004, 1007(1-2): 98-108.
[33] 韩婷婷,王 虹,吴美美,等. sCD40L Lp-PLA2对行急诊PCI中发生心肌缺血/再灌注损伤评估价值[J].河北医学,2020,26(2):240-244.
[34] IBRAHEEM K, YHMED A M A, QAYYUM T, et al. CD40 induces renal cell carcinoma-specific differential regulation of TRAF proteins, ASK1 activation and JNK/p38-mediated, ROS-dependent mitochondrial apoptosis[J]. Cell Death Discovery, 2019, 5: 148.
[35] 熊 鹰,黄 志,游建明,等.原花青素对脑缺血再灌注损伤脑组织中CD40L及MMP-9表达的影响[J].中医临床研究,2021,13(3):59-61.
[36] KUO W T, SHEN L, ZUO L, et al. Inflammation-induced occludin downregulation limits epithelial apoptosis by suppressing caspase-3 expression[J]. Gastroenterology, 2019, 157(5): 1323-1337.
[37] 庞艳利,许二妮,尉 娜,等.腺苷预处理对大鼠脑缺血再灌注损伤后Caspase-3的表達及细胞凋亡的影响[J].山东医药,2020,60(13):42-45.
[38] 史 珑,王向华,杨达胜. AP-1与肿瘤、自身免疫性疾病、哮喘、肾脏疾病关系的研究进展[J].山东医药,2019,59(20):93-96.
