基于网络药理学及全转录组测序对当归四逆汤干预外泌体抑制多发性骨髓瘤血管新生的机制研究
2022-02-19付佳琪蔡治国于漫亚郭志江张云晓崔兴
付佳琪 蔡治国 于漫亚 郭志江 张云晓 崔兴

〔摘要〕 目的 基于骨髓瘤细胞株外泌体测序及网络药理学研究当归四逆汤抑制多发性骨髓瘤血管新生的机制,为后续研究提供有针对性的指导。方法 利用TCMSP在线平台及SwissTargetPrediction网站获取当归四逆汤主要化学成分及对应靶点,借助GeneCards获取多发性骨髓瘤血管新生相关靶点基因,经与当归四逆汤作用靶点匹配后,获得当归四逆汤抑制多发性骨髓瘤血管新生的作用靶点,并筛选出相应作用成分。取正常人(n=5)和骨髓瘤患者(n=6)外周血清提取外泌体进行測序,获得差异表达基因。对骨髓瘤细胞外泌体进行全转录组测序,取交集后获得骨髓瘤来源外泌体差异表达基因。进而与当归四逆汤抑制多发性骨髓瘤血管新生的作用靶点匹配,获得当归四逆汤干预外泌体抑制多发性骨髓瘤的作用靶点。借助STRING平台与Cytoscape 3.8.2软件对靶点间相互作用网络进行分析,并利用Metascape网站进行GO功能和KEGG通路富集分析。运用R语言对结果进行可视化处理。最后对主要有效成分和作用靶点进行分子对接验证。结果 当归四逆汤作用于多发性骨髓瘤血管新生的有效成分有117种,干预外泌体发挥作用的相关靶点39个,包括CCND1、EGF等。GO分析结果显示,当归四逆汤作用于多发性骨髓瘤血管新生潜在靶点的生物功能涉及血管新生、血管系统发育、细胞周期调节等。KEGG通路富集显示,当归四逆汤作用于多发性骨髓瘤血管新生潜在靶点的通路主要涉及PI3K-AKT、HIF-1等与VEGF相关的信号通路等。分子对接结果表明主要有效成分槲皮素、桦木酸与关键作用靶点AKT1之间具有良好的对接活性。结论 本研究初步揭示了当归四逆汤能够通过PI3K-AKT、HIF-1通路干预外泌体抑制多发性骨髓瘤血管新生,为进一步的实验研究提供基础。
〔关键词〕 外泌体;全转录组测序;当归四逆汤;多发性骨髓瘤;血管新生;网络药理学
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.024
〔Abstract〕 Objective To explore the mechanism of Danggui Sini Decoction in inhibition of angiogenesis in multiple myeloma based on exosome sequencing of myeloma cells and network pharmacology, in order to provide targeted guidance for further studies. Methods The main chemical components and corresponding targets of Danggui Sini Decoction were obtained by TCMSP online platform and SwissTargetPrediction website. GeneCards was used to obtain the target genes related to angiogenesis of multiple myeloma. After matching with the targets of Danggui Sini Decoction, the targets of Danggui Sini Decoction inhibiting angiogenesis of multiple myeloma was obtained, and the corresponding action components were screened. Exosomes were extracted from peripheral blood serum of normal persons (n=5) and myeloma patients (n=6) and sequenced to obtain differentially expressed genes. Whole transcriptome sequencing of myeloma exosomes was performed, and the differentially expressed genes of myeloma-derived exosomes were obtained after intersection. Then, the targets of Danggui Sini Decoction in inhibiting angiogenesis of multiple myeloma were matched, and the targets of Danggui Sini Decoction intervening exosomes in inhibiting multiple myeloma were obtained. The interaction network between targets was analyzed by STRING platform and Cytoscape 3.8.2 software, and GO function and KEGG pathway enrichment analysis were performed by Metascape website. R language was used to visualize the results. Finally, molecular docking verification was performed on the main effective components and targets. Results There were 117 effective components of Danggui Sini Decoction on angiogenesis in multiple myeloma, and 39 related targets for intervention of exosomes, including CCND1, EGF, etc. GO analysis showed that the biological functions of potential targets of Danggui Sini Decoction on angiogenesis in multiple myeloma were related to angiogenesis, vascular system development and cell cycle regulation. KEGG pathway enrichment showed that the pathways of Danggui Sini Decoction acting on potential targets of multiple myeloma angiogenesis mainly involved PI3K-AKT, HIF-1 and other VEGF-related signaling pathways. Molecular docking results showed that quercetin and betulinic acid had good docking activity with key target AKT1. Conclusion This study preliminarily revealed Danggui Sini Decoction can intervene exosomes to inhibit multiple myeloma angiogenesis through PI3K-Akt and HIF-1 pathways, providing a basis for further research.
〔Keywords〕 exosome; whole transcriptome sequencing; Danggui Sini Decoction; multiple myeloma; angiogenesis; network pharmacology
多发性骨髓瘤(multiple myeloma, MM)属于中医学“骨蚀”“骨痹”的范畴。中醫理论认为,肿瘤发生发展的重要病因病机是寒凝瘀血内阻。寒凝血瘀证表明肿瘤组织处于缺血缺氧的微环境中[1],这种微环境能促进肿瘤分泌携带有血管生成因子的外泌体[2],促使肿瘤血管的新生。《素问·调经论》中载有“血气者,喜温而恶寒,寒则泣不能流,温则消而去之”的治则,因而可以采用温阳化瘀的中药治疗本病。温阳化瘀中药能够改善机体高凝状态和肿瘤周围组织微循环,不仅可以直接抑制肿瘤血管新生,还能够通过改善肿瘤周围组织微环境,从肿瘤的生物学特征与血管生成相关因子等方面,阻断肿瘤的血管新生[3]。当归四逆汤源于《伤寒杂病论》,为医圣张仲景所作的经典名方。本方温阳活血通脉并举,恰符合抑制外泌体所介导肿瘤血管新生的机制。
肿瘤细胞诱导的血管新生是大多数恶性肿瘤生长和转移的前提[4],越来越多的研究表明,血管新生是MM瘤生长、浸润、转移过程中的重要环节[5]。沙利度胺、来那度胺可以通过抑制血管内皮生长因子(vascular endothelial growth factor, VEGF)、碱性成纤维细胞生成因子(basic fibroblast growth factor, BFGF)等的表达进而抑制血管新生[6],目前在MM的治疗中已取得较好临床效果[4]。外泌体对细胞通讯有着重要作用,能够参与多种生物过程,如细胞凋亡、血管形成、炎症等[7]。在对MM瘤的研究中发现,外泌体中富含双调蛋白(amphiregulin, AREG),而AREG可以通过激活表皮生长因子受体(epidermal growth factor receptor, EGFR)[8]促进血管新生;外泌体亦可通过靶向抑制缺氧诱导因子1(hypoxia inducible factor 1, HIF-1)增强血管生成[9],从而参与骨髓微环境的血管新生,这些特点为抑制MM血管新生的治疗提供了新的靶点。
网络药理学能够系统地研究药物对疾病网络的干预和影响[10],其整体观和系统理论与中医学的整体观念及中药方剂多靶点、多成分的原理相一致,是研究中药复方配伍与药理作用的有效技术方法。分子对接技术通过理论模拟受体与配体之间的相互作用,预测其结合模式和亲和力,从而能够完善药理学实验的设计。
本研究通过提取外泌体并进行分析,结合网络药理学和分子对接技术,旨在阐释当归四逆汤抑制MM血管新生的有效活性成分及可能的分子机制,为后续的实验研究提供一定的基础。
1 材料与方法
1.1 外泌体提取与分析
1.1.1 试剂与仪器 RPMI-1640培养液(产品编号:CF0001-500ML)、RIPA裂解缓冲液均购自济南Spark jade生物技术有限公司;胎牛血清(fetal bovine serum, FBS)(上海Beyotime生物技术有限公司,产品编号:C0256);anti-Calnexin(产品编号:sc-46669)、anti-TSG101(产品编号:sc-101254)、anti-CD63(产品编号:sc-5257)均购自美国Santa Cruz公司;外泌体快速沉淀试剂盒(美国System Bioscience公司);透射电镜(日本Hitachi公司,型号:TEM-HT7700);BCA蛋白质测定试剂盒(上海Beyotime生物技术有限公司)。
1.1.2 临床血清标本 本研究纳入2019年8月在山东中医药大学附属医院(中国济南)血液科住院的6例MM患者。招募5名健康志愿者作为对照组。该研究获得山东中医药大学附属医院伦理委员会批准,所有参与者在试验前签署了知情同意书。将外周血样品收集在真空促凝管中,并在离心(离心半径16 cm,2500 r/min)5 min后获得血清样品。
1.1.3 U266细胞株培养收集上清液 MM细胞系U266来自美国模式培养物保藏所(American Type Culture Collection, ATCC),置于含有10% FBS、1%双抗的培养液中,并放在37 ℃、5% CO2的培养箱中进行培养。培养骨髓瘤细胞到密度80%左右,弃上清,应用PBS洗涤细胞沉淀2次。将培养基更换为含有10%去除外泌体的FBS的RPMI-1640培养基,继续培养36 h后收集细胞上清液。
1.1.4 外泌体提取 通过Exo Quick外泌体快速沉淀试剂盒分离正常人外周血血清及U266细胞上清液的外泌体。将250 μL血清样品与63 μL Exo Quick外泌体沉淀溶液混合,在冰上孵育30 min并离心,然后吸取上清液,离心5 min,最后分离沉淀中的外泌体。
1.1.5 透射电镜分析 用4%多聚甲醛固定外泌体,用PBS洗涤。将样品在室温下放置在碳涂覆的200目铜网格上20 min,并在1%戊二醛中固定5 min,然后用去离子水洗涤3次。用草酸铀酰对样品进行染色5 min,并以1∶9的比例加入一滴4%乙酸铀酰和2%甲基纤维素在冰上包埋,再用透射电子显微镜对干燥的网格成像。
1.1.6 蛋白印迹分析 对MM患者和健康志愿者血清中提取的外泌体分别进行蛋白印迹分析。用RIPA裂解缓冲液(Spark jade)裂解细胞,用BCA蛋白质测定试剂盒测定(Beyotime)蛋白质浓度。等量的样品蛋白用10% SDS-PAGE进行电泳分离,然后转移到PVDF膜上。在5%脱脂奶溶液中浸泡2 h后,将膜在40 ℃下与一级抗体anti-Calnexin, anti-TSG101, anti-CD63(Santa Cruz Biotechnology, Santa Cruz, CA, USA)一起孵育过夜。然后,将膜与第二抗体(Beyotime)一起孵育1 h。最后,使用Alpha Innotech
Fluor Chem Q成像分析系统进行可视化。
1.1.7 高通量测序 利用Illumina Hiseq仪器上述两种来源的外泌体进行150 bp双端测序,相关基因表达分析由上海云序生物科技有限公司进行。
1.2 网络药理学研究
1.2.1 当归四逆汤有效成分及靶点的筛选 通过TCMSP在线平台[11]寻找当归四逆汤中当归、桂枝、白芍、细辛、通草、甘草、大枣的化学组成成分,根据口服生物利用度(oral bioavailability, OB)≥30%和类药性(drug likeness, DL)≥0.18的2个ADME属性值筛选出符合条件的化学成分及其对应靶点,借助UniProt蛋白质数据库,物种设定为“human”,将靶点转换为对应的基因,并利用SwissTargetPrediction网站[12](http://www.swisstargetprediction.ch/)补充药物有效成分的作用靶点信息。
1.2.2 MM靶点的收集与筛选 以“multiple myeloma and angiogenesis”为检索词,通过GeneCards数据库、OMIM数据库检索相应的靶点。合并2个疾病数据库靶点后,删除重复值得到MM靶点。
1.2.3 当归四逆汤成分-作用靶点网络构建 将当归四逆汤成分靶点与MM血管新生靶点取交集,获得当归四逆汤抑制MM血管新生的作用靶点。根据交集靶点反向筛选当归四逆汤有效成分,构建当归四逆汤成分-作用靶点网络,将其导入Cytoscape 3.8.2软件[13],使用Network Analyzer功能进一步分析当归四逆汤成分-作用靶点网络,根据成分与靶点连接情况筛选出当归四逆汤作用于MM的关键成分。
1.3 当归四逆汤干预外泌体抑制MM血管新生的机制研究
1.3.1 当归四逆汤-外泌体靶点基因网络图构建 将当归四逆汤抑制MM血管新生靶点基因与外泌体差异表达基因取交集,即获得当归四逆汤干预外泌体抑制MM血管新生的作用靶点。利用STRING平台[14]与Cytoscape软件,对交集靶点进行网络拓扑分析,并构建当归四逆汤-外泌体靶点基因网络图。
1.3.2 KEGG与GO分析 应用Metascape数据平台对当归四逆汤干预外泌体抑制MM血管新生的相关靶点进行富集分析,以P<0.01为筛选标准,进行GO和KEGG通路富集分析,并借助R语言对富集结果进行可视化处理。
1.3.3 分子对接 筛选出当归四逆汤干预外泌体抑制MM血管新生的主要有效成分与靶点,利用RCSB PDB数据库(https://www.rcsb.org/)获得核心靶点蛋白晶体结构的PDB格式文件,通过TCMSP数据库获得有效成分的Mol2格式文件,利用AutoDock Tools对核心靶点和有效成分进行处理,获得相应的pdbqt格式文件,利用Vina进行分子对接,并统计各模型的结合能,最后用PyMol对活性较高的对接模型进行可视化。
2 结果
2.1 外泌体的鉴定
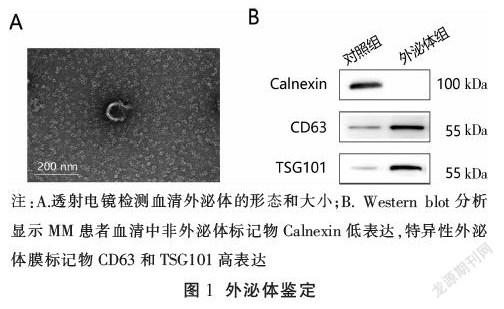
透射电镜显示直径<100 nm的圆形外泌体(图1A)。Western blot分析证实MM患者血清中非外体标记Calnexin的低表达和特异性外体膜标记CD63和TSG101(图1B)的高水平。
2.2 外泌体测序结果
与健康志愿者相比,骨髓瘤患者外周血外泌体高通量测序共发现了20 309个差异表达的mRNA。为筛选表达差异显著的外泌体mRNA,以FC值和P值(FC≥2.0和P<0.05)作为统计学显著性标准,总共有6782个mRNA在MM患者和健康对照组中有显著不同的表达,其中,5982个为上调mRNA,800个为下调mRNA。U266全转录组测序共获得13 629个mRNA。
2.3 当归四逆汤有效成分及靶点
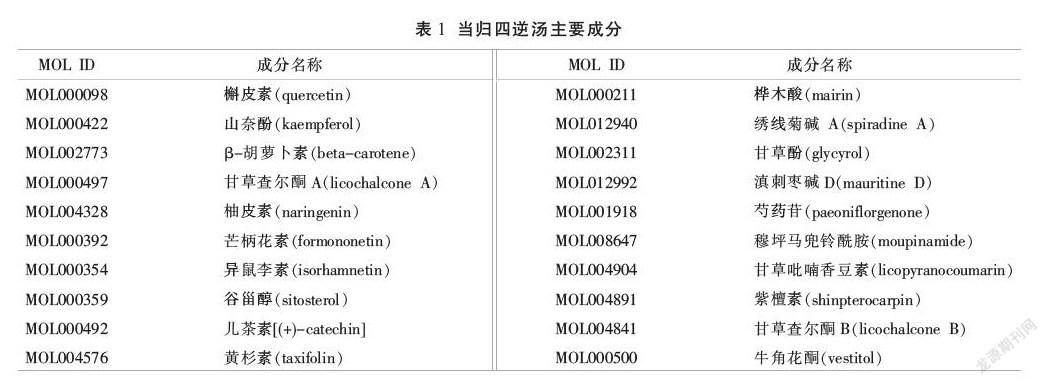
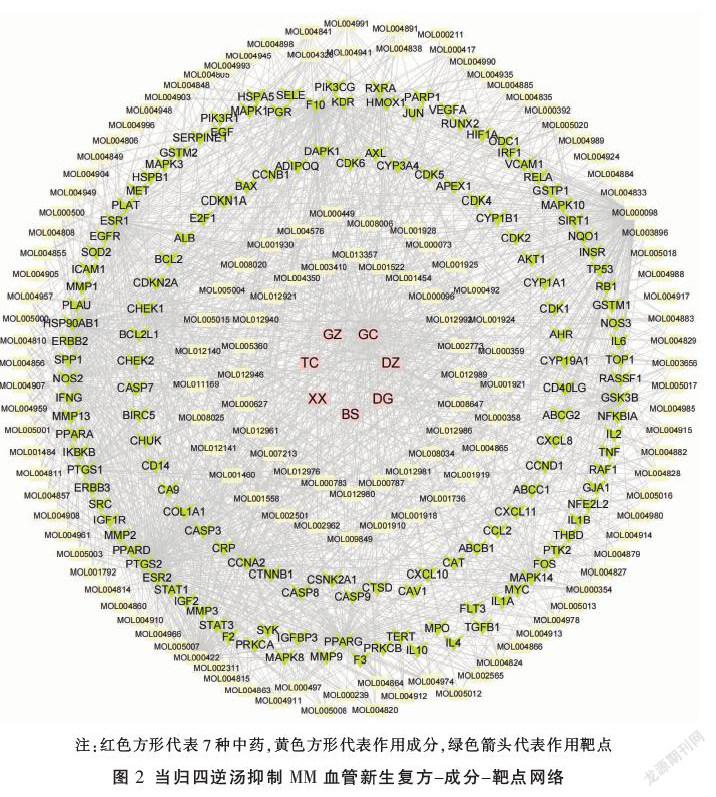
在TCMSP数据库中,初步检索到7味中药化学成分共1069种,经ADME筛选后,得到有效成分155种,删除25种无作用靶点的成分,即130种有效成分(见表1)。将130个有效成分与中药构建复方-成分网络(见图2),并对网络进行拓扑分析,根据“中介中心性”降序排列,前4位的有效成分分别是桦木酸、山柰酚、槲皮素、谷甾醇。
通过TCMSP数据库筛选有效成分靶点信息,结合SwissTargetPrediction在线靶标垂钓,并统一在UniProt蛋白质数据库将化合物作用的蛋白质靶点进行规范。共收集到相关作用靶点共346个(已删除重复值)。
2.4 MM血管新生靶点的获取
从GeneCards数据库获得MM瘤血管新生靶点1770个。设定Score大于中位数的靶点为MM血管新生的潜在靶点,连续进行2次筛选后,结合OMIM数据库补充相关靶点,合并后删除重复值,得到MM相关靶点885个。
2.5 当归四逆汤成分-作用靶点网络构建
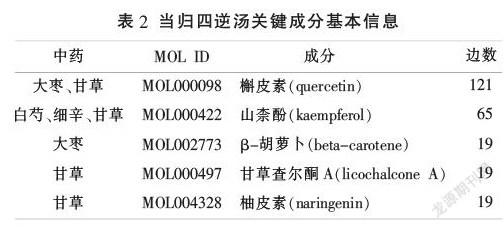
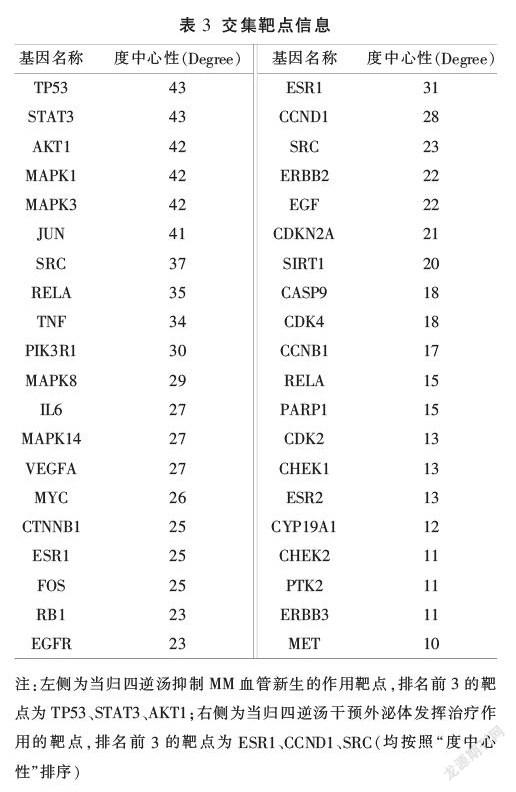
将筛选的当归四逆汤活性成分靶点与MM血管新生靶点通过R语言取交集,并将交集靶点通过STRING平台与Cytoscape软件构建靶点相互作用网络,最终获得143个交集靶点(见表3)。根据交集靶点反向筛选当归四逆汤有效成分,得到作用于MM血管新生的相關活性成分117个,通过Cytoscape软件的Network Analyzer功能构建当归四逆汤成分-靶点网络,根据“度中心性”排序发现,前5位化合物为槲皮素、山柰酚、β-胡萝卜素、甘草查尔酮A、柚皮素(见表2),推测可能为当归四逆汤抑制MM血管新生的关键成分。
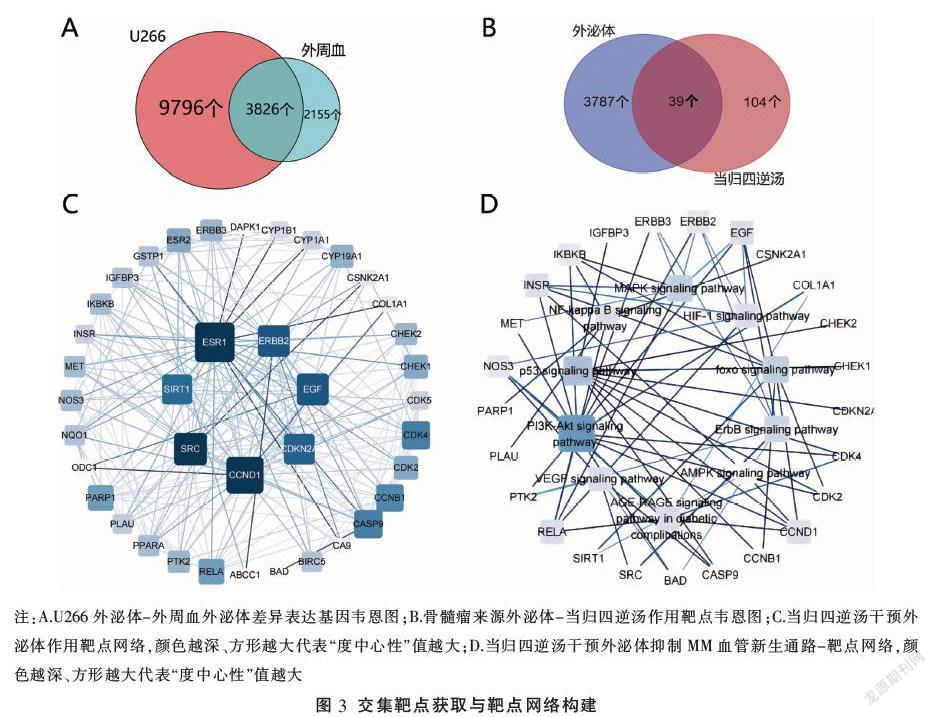
2.6 当归四逆汤-外泌体靶点基因网络构建
将人外周血外泌体差异上调基因与U266测序基因取交集,获得3862个骨髓瘤细胞来源的差异基因(见图3A),将其与当归四逆汤作用靶点匹配,获得当归四逆汤干预外泌体抑制MM血管新生的可能作用靶点39个(见表3,图3B)。借助STRING平台与Cytoscape软件制作当归四逆汤干预外泌体作用靶点网络图(图3C)。
2.7 KEGG与GO分析
应用Metascape数据平台对当归四逆汤干预外泌体抑制MM血管新生相关的39个靶点进行富集分析,以P<0.01为筛选标准,获得GO生物学过程条目587条、KEGG通路27条,运用R语言对富集显著的相关通路进行可视化处理(图4)。
GO生物学过程分析结果显示,相关靶点基因富集在血管发育(blood vessel development)、血管形态发育(blood vessel morphogenesis)、激酶活性的调控(regulation of kinase activity)、细胞周期的调节(regulation of cell cycle)等生物学过程。
KEGG通路包括PI3K-AKT信号通路、p53信号通路、VEGF信号通路、NF-kappa B信号、MAPK信号通路、AGE-RAGE信号通路、HIF-1信号通路等。选取P值在前10位的通路建立靶点-通路网络(见图3D)进行分析,发现多个靶点显著富集在PI3K-AKT信号通路,同时多条信号通路与血管新生有关,如VEGF信号通路、HIF-1信号通路等。这提示当归四逆汤可以通过多条通路干预外泌体从而抑制MM血管新生。
2.8 分子对接
通过KEGG分析并进一步查阅文献,发现当归四逆汤抑制MM血管新生中的多条通路均有PI3K-AKT信号通路的参与,而AKT1是该通路上的关键靶点,而AKT1同时为当归四逆汤发挥作用的关键靶点,因此,选取2种主要有效成分(槲皮素、山柰酚)与AKT1结合模式进行展示(见图5)。由图5可见槲皮素和山柰酚与JUN、MAPK1、AKT1靶点蛋白均形成氢键,表明具有良好的结合性。
3 讨论
肿瘤细胞分泌的外泌体对血管新生具有重要影响,肿瘤细胞来源的外泌体能够通过Hh-GLI信号通路促进VEGF的表达[15],也可通过分泌EGFR诱导血管新生[16]。本研究团队通过对U266细胞外泌体进行测序,并将高表达基因与当归四逆汤抑制MM血管新生的靶点进行匹配,进一步分析发现,U266细胞外泌体差异表达的mRNA中存在VEGF等血管新生相关的mRNA高表达。KEGG通路富集分析显示,主要富集于PI3K-AKT、AGE-RAGE、VEGF、HIF-1等信号通路,揭示了当归四逆汤干预U266外泌体抑制血管新生的主要机制。
网络药理学分析发现,桦木酸、山柰酚、槲皮素、谷甾醇可能是本方发挥作用的重要成分。桦木酸可抑制HIF-1α的转录,进而抑制HIF-1α和STAT3与VEGF基因启动子的结合来减少新生血管形成[17];山柰酚能够通过调节VEGF/VEGF-2及其下游信号级联,从而起到抑制血管新生的作用[18];槲皮素为黄酮类化合物,有研究表明槲皮素能够下调VEGF-A的表达,能够很好的抑制血管新生[19-20]。以上3种成分在当归四逆汤成分中“中介中心性”排序为前3位,提示桦木酸、山柰酚、槲皮素可能是当归四逆汤发挥抗血管新生的重要成分,而通过分子对接技术,验证了槲皮素、山柰酚与相关靶点具有良好的结合性。从而推测当归四逆汤主要通过以下机制干预外泌体抑制骨髓瘤血管新生:(1)槲皮素通过抑制VEGF的表达水平抑制肿瘤血管新生[21];(2)槲皮素可以抑制HIF-1α的转录活性从而抑制肿瘤血管新生[22];(3)槲皮素与山柰酚一同抑制AKT的表达[22],从而抑制MM血管新生。
通路富集结果显示,当归四逆汤干预外泌体抑制血管新生相关的通路主要集中在以下几条:(1)PI3K/AKT信号通路:PI3K为两个亚基构成的异二聚体,包括催化亚基和调节亚基[23],其活化后能够将3,4-二磷酸磷脂酰肌醇(PIP2)转化为3,4,5-三磷酸磷脂酰肌醇(PIP3)[24]。AKT是PI3K的下游信号分子,能够与PIP3相结合,从而激活Ser473位点,进而调控肿瘤细胞的凋亡。VEGF启动子包含多种转录调节因子,如SP1/SP3的结合位点[25],在受到刺激时,PI3K的调节亚基会磷酸化,AKT上Ser473也磷酸化,从而使PI3K/AKT激活,SP1上的Thr453与Thr739被磷酸化,启动VEGF的转录[26]。AKT活化可启动下游信号分子mTOR,mTOR能够促进VEGF的上调,促进血管新生[27]。此外,mTOR还可调节STAT3的活化,而STAT3在肿瘤缺氧环境下,能够和HIF-1α与VEGF启动子结合,从而促进血管新生[28];同时能够促进其下游目标如BFGF、HGF的表达,从而导致新生血管形成。(2)VEGF相关通路:VEGF是血管新生过程中最重要的调节因子之一[29],其介导的各信号级联几乎参与血管新生的各个过程[30]。VEGF的表达水平与骨髓瘤血管新生关系密切,已经有学者将其作为其评价疗效及危险度指标之一[31]。(3)HIF-1α相关通路:HIF-1α为缺氧情况下诱导产生的特异结合蛋白,其与HIF-1β构成活性HIF-1异二聚体,参与缺氧反应基因调节,从而使细胞适应低氧环境,促进血管新生,有研究顯示[32-33],HIF-1α可能通过上调Ang-2表达,进一步上调多种促血管生成因子的表达从而导致肿瘤血管新生。而且在HIF-1α调节其下游基因VEGF的过程中,PI3K/AKT通路也会起重要调节作用[34]。因此,HIF-1α在肿瘤血管新生中具有重要的意义。
综上所述,本研究通过对U266及外周血清外泌体进行高通量测序并结合网络药理学,系统分析了当归四逆汤干预外泌体抑制MM血管新生的作用机制,并通过分子对接技术验证了有效成分与核心靶点之间具有良好的结合活性,从而证实了本研究团队的假说:温阳化瘀中药可以通过干预肿瘤细胞分泌外泌体介导血管新生抑制肿瘤发展,肿瘤所处寒凝血瘀状态与血管新生存在一定的联系。当归四逆汤抑制MM血管新生具有多靶点、多通路的特点,为当归四逆汤的进一步研究提供理论基础。
参考文献
[1] 周华妙,郭 勇.寒凝血瘀对结肠癌肺转移模型小鼠肺组织VEGF、MMP-2表达的影响[J].浙江中西医结合杂志,2012,22(6):429-432.
[2] 周 辉,沈伟锋,邵平扬.缺氧外泌体传递miR-199a-5p对胃癌细胞SGC-7901迁移和侵袭的影响[J].医学信息,2021,34(1):78-82,86.
[3] 熊文杰,刘焕勋,史敦云,等.骨髓瘤细胞来源外泌体对NK细胞表面活化受体的影响[J].中国实验血液学杂志,2017,25(6):1713-1717.
[4] 师 亮,陈 浩,崔慧林,等.青蒿琥酯对人骨髓瘤细胞抗血管生成的作用[J].解剖学杂志,2018,41(2):152-155.
[5] 伏 杰,王松坡,李 琦,等.活血化瘀中药抗肿瘤血管新生的实验研究进展[J].中华中医药学刊,2020,38(4):153-157.
[6] 杨学文,马利敏,赵小强,等.雷利度胺联合化疗治疗急性白血病的临床效果及对血管生成因子的影响[J].中国实验血液学杂志,2016,24(3):702-706.
[7] 王含必,鄧成艳.外泌体的生物功能及临床治疗应用潜能[J].生殖医学杂志,2021,30(7):966-970.
[8] RAIMONDO S, SAIEVA L, VICARIO E, et al. Multiple myeloma-
derived exosomes are enriched of amphiregulin (AREG) and activate the epidermal growth factor pathway in the bone microenvironment leading to osteoclastogenesis[J]. Journal of Hematology & Oncology, 2019, 12(1): 2.
[9] UMEZU T, TADOKORO H, AZUMA K, et al. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1[J]. Blood, 2014, 124(25): 3748-3757.
[10] 张彦琼,李 梢.网络药理学与中医药现代研究的若干进展[J].中国药理学与毒理学杂志,2015,29(6):883-892.
[11] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13.
[12] GFELLER D, MICHIELIN O, ZOETE V. Shaping the interaction landscape of bioactive molecules[J]. Bioinformatics, 2013, 29(23): 3073-3079.
[13] SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504.
[14] SZKLARCZYK D, MORRIS J H, COOK H, et al. The STRING database in 2017: Quality-controlled protein–protein association networks, made broadly accessible[J]. Nucleic Acids Research, 2017, 45(D1): D362-D368.
[15] BHAT A, YADAV J, THAKUR K, et al. Exosomes from cervical cancer cells facilitate pro-angiogenic endothelial reconditioning through transfer of Hedgehog-GLI signaling components[J]. Cancer Cell International, 2021, 21(1): 319.
[16] 刘轩宇,陈 磊.外泌体在胃癌腹膜转移中机制的研究进展[J].外科理论与实践,2021,26(1):76-78.
[17] 高 倩,吴 佩,何 疆,等.青蒿素和桦木酸阻断脂多糖诱导小鼠血管新生及组织增殖[J].中国药学杂志,2015,50(4): 330-338.
[18] CHIN H K, HORNG C T, LIU Y S, et al. Kaempferol inhibits angiogenic ability by targeting VEGF receptor-2 and downregulating the PI3K/AKT, MEK and ERK pathways in VEGF-stimulated human umbilical vein endothelial cells[J]. Oncology Reports, 2018, 39(5): 2351-2357.
[19] 李彩丽,廖应英,成 丹,等.槲皮素对食管癌Eca109细胞迁移侵袭及血管生成的影响[J].国际消化病杂志,2017,37(2):104-108.
[20] TANG S M, DENG X T, ZHOU J, et al. Pharmacological basis and new insights of quercetin action in respect to its anti-cancer effects[J]. Biomedicine & Pharmacotherapy, 2020, 121: 109604.
[21] HAO Y L, ZHANG C P, SUN Y Y, et al. Licochalcone A inhibits cell proliferation, migration, and invasion through regulating the PI3K/AKT signaling pathway in oral squamous cell carcinoma[J]. OncoTargets and Therapy, 2019, 12: 4427-4435.
[22] 史新萌,刘玉萍,瞿 鼎,等.抑制HIF-1α表达的中藥抗肿瘤活性成分研究进展[J].药学学报,2021,56(10):2689-2719.
[23] 耿军辉,张丽军,王亚丽,等.PI3K/Akt信号通路与肿瘤血管新生的研究进展[J].现代肿瘤医学,2018,26(9):1462-1466.
[24] 刘泽宇,万宇翔,黄金昶.当归四逆汤治疗肝细胞癌作用机制的网络药理学分析[J].中国实验方剂学杂志,2020,26(6):185-192.
[25] S?覫LVSTEN C A E, PAOLI F, CHRISTENSEN J H, et al. Voluntary physical exercise induces expression and epigenetic remodeling of VEGF A in the rat Hippocampus[J]. Molecular Neurobiology, 2018, 55(1): 567-582.
[26] SHARMA S, GURU S K, MANDA S, et al. A marine sponge alkaloid derivative 4-chloro fascaplysin inhibits tumor growth and VEGF mediated angiogenesis by disrupting PI3K/Akt/mTOR signaling cascade[J]. Chemico-Biological Interactions, 2017, 275: 47-60.
[27] XU T W, LV Z, CHEN Q H, et al. Vascular endothelial growth factor over-expressed mesenchymal stem cells-conditioned media ameliorate palmitate-induced diabetic endothelial dysfunction through PI-3K/AKT/m-TOR/eNOS and p38/MAPK signaling pathway[J]. Biomedicine & Pharmacotherapy, 2018, 106: 491-498.
[28] LEE H, JEONG A J, YE S K. Highlighted STAT3 as a potential drug target for cancer therapy[J]. BMB Reports, 2019, 52(7): 415-423.
[29] 郑 硕,黄奕红.肝癌组织中血管内皮生长因子、胰岛素样生长因子-Ⅱ的表达情况及影响因素分析[J].吉林医学,2021,42(5):1064-1067.
[30] 向本旭,刘婷婷,孙芳玲,等.VEGF相关信号通路在血管新生中的研究进展[J].中国比较医学杂志,2015,25(12):81-86.
[31] PALTA A, KAUR M, TAHLAN A, et al. Evaluation of angiogenesis in multiple myeloma by VEGF immunoexpression and microvessel density[J]. Journal of Laboratory Physicians, 2020, 12(1): 38-43.
[32] 王宝财,金寿德,张 新.缺氧诱导因子-1α对非小细胞肺癌血管生成及其对预后的影响[J].临床肺科杂志,2021,26(5):747-751.
[33] BAHRAMI A, ATKIN S L, MAJEED M, et al. Effects of curcumin on hypoxia-inducible factor as a new therapeutic target[J]. Pharmacological Research, 2018, 137: 159-169.
[34] WANG D F, ZHAO W, LIU J R, et al. Effects of HIF-1α on spermatogenesis of varicocele rats by regulating VEGF/PI3K/Akt signaling pathway[J]. Reproductive Sciences, 2021, 28(4): 1161-1174.
