临床药师参与治疗MRSA感染性心内膜炎合并肾功能亢进3例经验分享▲
2022-02-18毛晓丽莫李立
覃 禹 毛晓丽 莫李立
(柳州市人民医院药学部,广西柳州市 545005)
肾功能亢进(augmented renal clearance,ARC)在重症患者中普遍存在[1],ARC对经肾排泄药物的代谢常存在影响。临床工作中,药师更多关注肾功能不全患者的用药,往往忽略了ARC患者的用药。本文介绍了临床药师基于万古霉素血药浓度监测,协助临床医师治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)感染性心内膜炎合并ARC患者3例的临床经验,探讨如何优化MRSA感染性心内膜炎合并ARC患者的抗感染方案。
1 病例资料
1.1 病例1 患者男性,29岁,65 kg。因“乏力、周身酸痛3 d”于2021年5月5日入院。入院前3 d,患者睡醒后自觉乏力、全身酸痛,咳嗽以干咳为主,于外院行心脏彩超检查,结果提示三尖瓣赘生物形成,经治疗未见明显好转,遂转至我院继续治疗。既往有长期吸毒史。查体:两肺部呼吸音粗,未闻及干湿性啰音,各瓣膜听诊区未闻及杂音。辅助检查:白细胞计数48.13×109/L,中性粒细胞百分比94.6%,降钙素原25.32 ng/mL,C反应蛋白96.79 mg/L,肌酐43.3 μmol/L,心脏彩超提示三尖瓣赘生物大小约37 mm×17 mm,胸部CT提示两肺多发肺脓肿(见图1)。
入院诊断为感染性心内膜炎、社区获得性肺炎、血流播散性肺脓肿。诊疗经过:初始经验性给予青霉素(560万U/次, 8 h/次)治疗,治疗48 h仍有反复高热,最高体温39 ℃。入院第3天,患者的双侧血培养检出MRSA,药敏试验提示万古霉素、阿米卡星、利福平敏感,遂用药方案更改为万古霉素1 g/次,12 h/次,静脉滴注;阿米卡星0.6 g/次,1次/d,静脉滴注;利福平0.3 g/次,3次/d,口服。患者仍有反复高热,最高体温39.5 ℃,万古霉素血药浓度为8 mg/L。入院第8天,临床药师会诊,计算患者肌酐清除率为163 mL/(min·1.73 m2),考虑患者存在ARC,建议停用阿米卡星和利福平,调整万古霉素为1g/次,8 h/次。调整抗感染方案后,患者体温逐渐恢复正常,复查万古霉素血药浓度为16 mg/L,血培养转阴,感染指标水平明显下降。入院第14天,患者的胸部CT提示两肺病灶明显吸收,心脏彩超提示三尖瓣赘生物大小为25 mm×6 mm,万古霉素血药浓度为17 mg/L。入院第28天复查胸部CT提示两肺多发肺脓肿几乎完全吸收(见图2)。
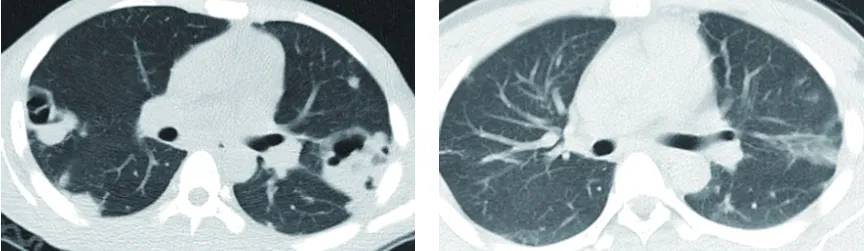
图1 入院第1天胸部CT 图2 入院第28天胸部CT
1.2 病例2 患者男性,35岁,60 kg。因“发热、乏力、纳差7 d”于2020年2月15日入院。患者于入院前1周前出现发热,最高体温为38.8 ℃,伴有乏力、纳差,自行口服感冒药,效果不佳,遂来我院就诊。既往有静脉吸毒史3年。查体:三尖瓣听诊区可闻及3级收缩期杂音,四肢可见小针孔。辅助检查:白细胞计数18×109/L,中性粒细胞百分比90%,C反应蛋白200 mg/L,肌酐 48 μmol/L,胸部CT未见异常,心脏彩超提示三尖瓣赘生物大小约24 mm×15 mm。
入院诊断为感染性发热,并考虑存在感染性心内膜炎的可能。诊疗经过:初始经验性给予头孢唑林(2 g/次,8 h/次)静脉治疗,治疗48 h仍有反复高热,最高体温为40 ℃。3次血培养结果均为MRSA,对万古霉素、左氧氟沙星敏感。根据药敏试验结果,将用药更换为万古霉素1 g/次,12 h/次,静脉滴注。入院第7天,患者体温高峰未见明显下降,加用左氧氟沙星(0.6 g/次,1次/d)静脉滴注。入院第9天,患者仍有发热,最高体温为39.5 ℃,万古霉素血药浓度为4 mg/L。临床药师会诊,计算患者肌酐清除率为144 mL/(min·1.73 m2),考虑患者存在ARC,建议停用左氧氟沙星,调整万古霉素负荷剂量为2 g/d,维持剂量为1 g/d,8 h/次,静脉滴注。调整抗感染方案后,患者体温高峰逐渐下降至正常,入院第12天,复查万古霉素血药浓度14 mg/L,C反应蛋白90 mg/L。入院第16天,患者体温正常72 h,复查心脏彩超提示三尖瓣赘生物大小约20 mm×10 mm,转外科进一步治疗。
1.3 病例3 患儿男性,11岁,35 kg。因“发热9 d”于2018年10月18日入院。患儿于入院前9 d出现发热,最高体温为39 ℃,自行口服阿莫西林无好转,遂于当地医院住院治疗,追问病史发现患者曾于发病前2 d挤压脸部痤疮,心脏彩超提示三尖瓣赘生物形成,大小约8 mm×7 mm,双侧血培养检出MRSA,为求进一步治疗来我院就诊。辅助检查:白细胞计数12.0×109/L,中性粒细胞百分比80%,C反应蛋白50 mg/L,肌酐35 μmol/L,心脏彩超提示三尖瓣赘生物大小约8 mm×7 mm,胸部CT未见异常。
入院诊断为感染性心内膜炎、金黄色葡萄球菌性血流感染。诊疗经过:给予万古霉素[0.5 g/次(15 mg/kg),6 h/次],静脉滴注;抗感染96 h后,体温控制欠佳,最高体温38.8 ℃,加用阿米卡星(0.2 g/次,12 h/次,静脉滴注)抗感染。入院第9天,患儿仍有发热,最高体温为38.5 ℃,C反应蛋白60 mg/L,万古霉素血药浓度为4 mg/L,复查心脏彩超提示三尖瓣赘生物大小约6mm×5mm。临床药师会诊,计算患儿肌酐清除率163 mL/(min·1.73 m2),考虑存在ARC,认为万古霉素剂量已达指南推荐的最大剂量,但谷浓度仍偏低,建议停用万古霉素和阿米卡星,更换为双通道排泄的利奈唑胺[0.35 g/次(10 mg/kg),8 h/次,静脉滴注]。更换用药方案后,入院第13天患儿体温恢复正常,继续采用利奈唑胺抗感染治疗21 d,治疗期间监测血小板未发现异常,复查心脏彩超赘生物消失,患儿好转出院。
2 讨 论
2.1 MRSA感染性心内膜炎概述 右心内膜炎在所有感染性心内膜炎中的占比为5%~10%,静脉吸毒是右心内膜炎最常见的危险因素,86%右心内膜炎患者有静脉吸毒史[2]。MRSA是静脉吸毒者感染性心内膜炎最常见的病原体,比例高达60%~90%[2-5],国外有研究报告,社区获得性 MRSA 感染性心内膜炎多见于静脉药瘾者[6]。静脉吸毒导致的MRSA感染性心内膜炎比例逐年增加。临床上用来治疗MRSA感染性心内膜炎的抗菌药物首选万古霉素,备选达托霉素[7]。利奈唑胺虽然是抑菌剂,但其用药后血药浓度低,一般不推荐应用于感染性心内膜炎的治疗。然而,一项回顾性研究显示,利奈唑胺治疗感染性心内膜炎的成功率达63.6%[8]。在应用万古霉素治疗MRSA引起的菌血症和心内膜炎时,不推荐联合使用庆大霉素和/或利福平,这是因为其无明显益处且不良反应明显[9-10]。治疗MRSA菌血症时也不推荐使用万古霉素联合氟喹诺酮类,因与单用万古霉素相比,万古霉素联合喹诺酮类对减少并发症、缩短退热时间、降低C反应蛋白、缩短抗感染疗程均无特殊益处[11]。
2.2 ARC对机体抗菌药物代谢的影响 ARC一般指肌酐清除率>130 mL/(min·1.73 m2)。8~24 h尿肌酐排出量可准确预测ARC,血清肌酐可作为识别ARC的替代指标[12]。ARC的高危因素包括年龄<50岁、男性、近期有创伤病史、较低的危重病严重程度评分[13-16]。ARC可影响抗菌药物的代谢动力学,特别是经肾排泄、时间依赖性且半衰期较短的抗菌药物,可引起治疗药物浓度不足。长期低浓度抗菌药物暴露可诱发耐药菌的产生,导致治疗失败[17-18]。万古霉素是一种亲水性抗菌药物,与血清蛋白中度结合,主要分布于细胞外液,多经肾脏排泄。ARC可导致万古霉素体内清除过快,ARC患者的万古霉素血药浓度普遍低于非ARC患者,万古霉素的临床亚治疗浓度可导致感染治疗失败率增加和细菌清除率下降[19]。
2.3 ARC患者的万古霉素用药策略 用于评估万古霉素治疗MRSA性菌血症效果的药代动力学和药效动力学(pharmacokinetics/pharmacodynamics,PK/PD)参数为24 h用药时曲线下面积(area under the curve,AUC)与最低抑菌浓度(minimum inhibitory concentration,MIC)的比值(AUC0-24 h/MIC),用药前两天内未达到AUC0-24 h/MIC阈值的患者治疗失败的风险增加两倍,因此识别ARC后制订万古霉素的用药方案至关重要[20]。
策略1—监测万古霉素血药浓度:推荐常规对ARC患者进行万古霉素药物浓度监测,PK/PD的AUC0-24h/MIC目标值为400~650 mg/(h·L),不能监测AUC0-24h/MIC的则以谷浓度代替,要求普通感染时谷浓度维持在10~15 mg/L,严重感染时谷浓度维持在10~20 mg/L,儿童的万古霉素谷浓度维持在5~15 mg/L[21]。
策略2—负荷剂量:对于严重感染的成人患者,负荷剂量推荐25~30 mg/kg,对于严重感染的儿童患者,负荷剂量推荐30 mg/kg。系统评价结果表明,相较于无负荷剂量,负荷剂量(成人患者:25~30 mg/kg;儿童患者:30 mg/kg)可以显著增高血药浓度达标率且不增加肾毒性[22]。
策略3—持续输注:间歇给药无法达到目标值时可采取持续输注,负荷剂量为15~20 mg/(kg·次)、30~40 mg/(kg·d),最大剂量为60 mg/(kg·d)。危重病人维持谷浓度20~35 mg/L持续输注与间歇给药肾毒性相似或更低。何娟等[23]将万古霉素治疗初始浓度不达标的重症胰腺炎患者分为增加给药剂量组和持续输注组,结果显示万古霉素 24 h 持续输注可提高稳态谷浓度,且能显著降低万古霉素日平均剂量。
策略4—替代抗菌药物:更换为经肝或者肝肾通道排泄的抗菌药物。利奈唑胺主要通过非肾脏代谢途径被清除,本研究病例3中,将抗菌药物更换为利奈唑胺后,患儿的病情好转。但有研究报告,ARC可明显提高利奈唑胺的清除率,导致标准剂量下药物暴露不足的高风险,故为了维持2 mg/L以上的有效血药浓度,应采用持续输注(75 mg/h)利奈唑胺的方案[24]。
3 小 结
治疗MRSA引起的菌血症和心内膜炎时可首选万古霉素,不推荐万古霉素基础上加入庆大霉素和/或利福平和/或左氧氟沙星。万古霉素主要经肾排泄,针对ARC患者,万古霉素用药策略包括血药浓度监测、负荷剂量给药、持续输注,或更换非肾脏排泄的抗菌药物。临床药师应积极参与制订临床抗感染治疗方案,并在使用万古霉素时,宜尽早识别ARC患者,除应根据患者的实际情况调整初始给药方案,同时应进行药学监护。
