炭疽芽孢杆菌噬菌体的研究进展
2022-02-18钟佑宏
李 论,王 鹏,李 伟,钟佑宏
(1.大理大学公共卫生学院,大理 671000;2.云南省地方病防治所 云南省自然疫源性疾病防控技术重点实验室,大理 671000;3.中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室,北京 102206)
20世纪初,一类感染细菌的病毒(后称噬菌体)被Frederick Twort等[1-2]发现。由于噬菌体能感染细菌,人类对其在抗细菌感染方面寄予了厚望。然而,随着抗生素的发现与应用,噬菌体在抗细菌感染方面的应用逐渐被忽略。但是,抗生素的广泛应用使细菌的耐药性成为新的难题,一些多耐药菌、泛耐药菌以及超级细菌的出现,迫使人们不得不在抗生素之外寻求抗感染的有效途径。目前,炭疽芽孢杆菌不仅在生物恐怖袭击中存在潜在的威胁,还会对自然环境造成难以清除的污染。有研究表明,噬菌体对生物武器类的炭疽芽孢杆菌有很好的裂解效应,并对土壤样本中的类炭疽芽孢杆菌有较高的杀灭率。这就是为什么全世界都在进行密集的研究,旨在开发有效的方法,防止炭疽芽孢杆菌对我们的侵害[1,3]。
1 炭疽的危害
炭疽(Anthrax)是世界上最古老的疾病之一,可上溯到古巴比伦时代[4]。它是一种分布较广、发病率较高的烈性传染病[5]。炭疽能形成芽孢,即生命力较强的炭疽芽孢杆菌。无论在多么恶劣的环境下,这种细菌都可以在体表形成多层坚硬的外壳,将其DNA保护起来。随着时间的流逝,即使它的外壳会脱落,但孢子的核心部分并不会死亡,一遇合适的环境便会再次复苏。2016年西伯利亚的一场炭疽疫情,使我们对炭疽存活年限的认知从四五十年延长到了七十五年[4,6]。
炭疽菌是需氧芽孢杆菌中唯一对人、畜均有致病性的细菌,它能使受害者在36 h内窒息、大量出汗、休克直至死亡[7]。与其他由呼吸道、胃肠道或皮肤进入的芽孢杆菌不同,炭疽芽孢杆菌一旦进入体内即可导致全身感染和致命疾病[6]。2001年美国的“炭疽邮件”事件导致5人死亡后,炭疽就成为了人们研究的热点[8]。
1956年至1997年间,我国共报告了11.2万例人类病例,并分别在1957年、1963年和1977年发生过3次大规模的暴发[9]。1956年法定报告传染病制度建立后,在炭疽的老疫源地——云南省,炭疽发病率有缓慢上升的趋势,但疫点相对稳定,多发生在炎热多雨的地州,传染源以牛为主,临床大多为皮肤型[10]。2021年8月15日,山东省疾控中心报告了2例炭疽确诊病例,其中一例死亡病例为14岁学生,另一例为35岁男子,从事屠宰牛类活动。为查清炭疽源头,防止进一步扩散,消除潜在风险,继续开展疫情调查和治疗势在必行[11]。由此可见,对于炭疽的防控仍需进一步加强。
由于炭疽芽孢杆菌对理化因子具有极强的抵抗力和致病力,所以一旦自然环境被炭疽芽孢杆菌污染,将很难被彻底清除。目前常规采用的消毒方法为物理方法和化学方法,但这两类方法杀菌效果尚存在局限性[12]。因此,寻找更加快速有效的方法消除炭疽芽孢杆菌对环境的污染迫在眉睫。
2 噬菌体的重要性
噬菌体是地球上最丰富的生物之一,广泛存在于海水、生活污水、土壤、动物或人类排泄物中,是感染细菌、真菌、放线菌和螺旋体的病毒,其结构简单,主要由蛋白外壳和遗传物质核酸组成。噬菌体根据繁殖周期可分为裂解性噬菌体和溶原性噬菌体(图1)。裂解性噬菌体通过吸附蛋白与宿主细胞表面的受体特异性结合,将其遗传物质注入宿主细胞,并在宿主细胞内进行核酸复制、蛋白质合成和后代噬菌体的组装,实现增殖。而溶原性噬菌体将DNA整合到宿主基因组,也可能以质粒形式存在[1,13]。作为一种侵染细菌的病毒,噬菌体不仅能够特异性识别宿主细菌,还可以更加快速地进行鉴别诊断[14-15]。

图1 噬菌体的不同循环周期[13]Fig.1 Different life cycles of phages[13]
噬菌体裂菌技术——一种新型生物消毒技术,近年来得到国内外研究者的极大关注。利用其宿主作用的相对特异性强、裂菌效应快速及持续的特点,将天然的、可以不断繁殖的噬菌体用于动物和人体的抗病原体感染、畜牧业环境净化的探索性研究,已显示出可喜的前景。相关研究也证实自然界存在广谱噬菌体或者可使用人工改造技术将噬菌体宿主谱扩展[12]。随着噬菌体裂解技术的进一步发展,对炭疽芽孢杆菌的分离鉴定将会更加快速准确。
3 炭疽噬菌体的国内外研究现况
3.1 炭疽噬菌体的国外研究现况从时间角度来看,早在1898年,俄罗斯微生物学家H.Φ.伽马莱亚就观察到一种炭疽芽孢杆菌的自溶现象,他认为这种溶菌现象由分解过程中形成的一种物质所致,并将其称为“溶菌素”[16]。1931年,Cowles[17]发现了一株活跃于炭疽芽孢杆菌的噬菌体,他通过对炭疽芽孢杆菌菌株进行连续地过滤,从污水中获得了这种噬菌体,该噬菌体可以裂解美国模式培养物集存库(American Type Culture Collection, ATCC)保存的所有炭疽芽孢杆菌菌株,但并未裂解Cowles发现的两株运动型菌株,因此他怀疑这两株菌株不是炭疽芽孢杆菌。1951年,英国的McCloy[18]从一株非典型芽孢杆菌菌株W中分离除了一株W噬菌体,这是炭疽噬菌体由溶原性蜡样芽孢杆菌菌株分离的先例,她发现该噬菌体可裂解171株炭疽杆菌和54株蜡样芽孢杆菌中的2株。同年,她发现这株噬菌体由一种主要的β形式和一种罕见的α突变体组成,α噬菌体和β噬菌体有着相同的血清学特性[19]。1955年,Brown等[20]从溶原性蜡样芽孢杆菌W菌株中分离出了W噬菌体的变种——γ噬菌体,该噬菌体表现出与W噬菌体不同的特性,即:裂解光滑形式的炭疽芽孢杆菌,且未能裂解所测试的所有蜡样芽孢杆菌。正因为γ噬菌体可以更有效地感染炭疽芽孢杆菌,所以它成为临床上快速诊断炭疽芽孢杆菌的工具[21]。
由于γ噬菌体对炭疽芽孢杆菌的高度特异性,引发了不同年代的学者们对它的关注。1975年,Watanbe等[22]采用电子显微镜和负染色技术研究了炭疽芽孢杆菌γ噬菌体的精细结构。之后,Schuch等[23]第一次对Wβ和Wγ噬菌体感染炭疽芽孢杆菌进行详细的基因组和功能分析,在对两个基因组的比较分析中,他们发现γ噬菌体的变异可能是由亲代Wβ噬菌体大小的缺失、点突变和与炭疽芽孢杆菌基因组的同源重组这些过程中导致的。2006年,Fouts等[24]通过测序和比较分析,确定了炭疽芽孢杆菌噬菌体γ和Cherry的遗传亲缘关系,发现这两株噬菌体的基因组除了3个可变位点外完全相同。
随着科学技术的发展,快速的、新型的检测炭疽的诊断方法可以增强民用和军事对炭疽作为生物武器的意外或故意扩散的反应。目前基于实验室的临床鉴别需要12~120 h,并且需要使用特征明确的γ噬菌体进行空斑分析,这至少还额外需要24 h的细菌培养[25]。为了缩短检测时间,1959年,Chadwick[15]提出了采用噬菌体微量试验法进行炭疽芽孢杆菌的快速诊断,试验结果表明Wα噬菌体对所试验的炭疽芽孢杆菌菌株全部裂解。1961年,Dowdle等[26]提出了使用炭疽芽孢杆菌噬菌体荧光抗噬菌体染色法进行炭疽芽孢杆菌的快速诊断。2015年,Cox等[25]提出了结合测流免疫层析(lateral flow immunochromatography, LFI)快速地检测γ噬菌体扩增的自然特异性。用简单、廉价的LFI检测γ噬菌体扩增,为诊断炭疽芽孢杆菌提供了一种快速、灵敏和现场可部署的方法。该方法中,炭疽菌的产生时间大大缩短,且不需要广泛的实验室培养。
基于炭疽芽孢杆菌对裂解的敏感性,γ噬菌体裂解法成为了鉴定炭疽芽孢杆菌的常用诊断方法,且已被证明其特异性为97%。2017年,Kolton等[27]评估了炭疽芽孢杆菌联合诊断试验的诊断性能。他们发现炭疽芽孢杆菌γ噬菌体裂解诊断试验的特异性为96%,与之前报道的结果一致。虽然γ噬菌体表现出相当狭窄的宿主范围,但相关研究证明,蜡样芽孢杆菌(如ATCC4342)也对该噬菌体易感[28]。所以,在使用γ噬菌体检测炭疽芽孢杆菌时,应考虑此种误差的可能性。此外,也有研究表明,炭疽的特异性噬菌体,尤其是γ噬菌体,无法感染有荚膜的炭疽芽孢杆菌。因此,Negus等[29]认为这种炭疽特异性噬菌体不太可能有治疗剂的效用。
除γ噬菌体外,还有许多其他炭疽噬菌体被发现。1958年,Ivanovics和Lantos采用“链霉素分离法”由土壤样品中分离到炭疽噬菌体,并证明其对炭疽芽孢杆菌具有特异性。1959年,Stamatin等也由土壤样品中分离到一株噬菌体,并命名为E噬菌体。同年,Ciuca等[15]将W、γ和E噬菌体应用于130株地方性炭疽菌株,做了比较试验,试验结果表明,E噬菌体对所试验的炭疽芽孢杆菌特异性最高。1963年,Buck等[30]从实验室保存的溶原性炭疽芽孢杆菌中分离出了25株炭疽噬菌体,并选择了其中的5株与γ噬菌体进行比较,结果显示这些噬菌体对于鉴定炭疽芽孢杆菌是有一定帮助的。1974年,Nagy[31]在链霉素分离法的帮助下,由土壤样品中分离到一株炭疽芽孢杆菌特异性噬菌体,命名为AP50。噬菌体AP50的核酸为RNA,病毒粒子包含了5种不同的磷脂,这是第一次从革兰氏阳性宿主中分离出来的含有磷脂的RNA噬菌体。随后,Nagy对其进行了详细的研究,发现AP50似乎具有一些不寻常的特征——对宿主的极端特异性:即34株炭疽芽孢杆菌仅有1/3被裂解,属于6种不同杆菌片段的52个菌株中没有一个对AP50敏感。1996年,Jameel等[32]分离出一株Φ20噬菌体,该噬菌体为双链DNA病毒,具有48 756 bp的基因组大小,及直径65 nm、长217 nm、宽15 nm的多面体头、尾。其限制性位点图显示了包括BamHⅠ、BglⅡ和SstⅠ等9个酶切位点。2002年,Walter等[33]研究了来自爱荷华州表层土壤的3株炭疽芽孢杆菌噬菌体(Nk、DB、MH)的特征。研究表明,这3株噬菌体均可裂解炭疽芽孢杆菌。其中两株为肌尾噬菌体(噬菌体Nk和DB),另一株为短尾噬菌体(噬菌体MH)。与肌尾噬菌体SP50相比,虽然Nk和DB的形态与SP50类似,但Nk和DB均未感染枯草芽孢杆菌HWA 1243;Nk、DB和SP50的蛋白质图谱以约97 kDa的条带区分,这些条带存在于Nk的结构蛋白图谱中,但在DB和SP50中均不存在;DB的蛋白质比Nk和SP50的大;电泳分析表明,只有SP50的DNA不易被限制性内切酶EcoRⅠ切割。噬菌体MH与噬菌体Φ29的形态也非常相似,但噬菌体MH未能感染枯草芽孢杆菌;MH和Φ29的蛋白质谱在66 kDa和97 kDa间的条带数量和强度以及30 kDa以下紧密迁移条带的大小上也有所不同。MH DNA迁移略高于Φ29 DNA(19.2 kb),接近23 kb。综上所述,噬菌体Nk和DB在形态上类似于肌病毒科噬菌体SP50,噬菌体MH在形态上也类似噬菌体Φ29,但它们的宿主范围、蛋白质和DNA特征方面都有所不同。
噬菌体Fah在前苏联被用于鉴定炭疽芽孢杆菌,该噬菌体由俄罗斯Pokrov修复工厂生产。2005年,Minakhin等[34]分析了炭疽芽孢杆菌噬菌体Fah基因组的37 974 bp序列,并检测了该噬菌体在蜡样芽孢杆菌模型宿主中的基因表达。他们发现,Fah基因组的一半包含编码结构蛋白和宿主裂解功能的基因,这是长尾噬菌体科(Syphoviridae)的典型排列方式。基因组的另一半包含编码病毒基因组复制酶和许多可能调节病毒基因表达的转录因子的基因。
2009年,Schuch等[35]新发现了一种从赤子爱胜蚓(Eisenia fetida)的肠道中分离出来的炭疽芽孢杆菌噬菌体——蠕虫肠道噬菌体1(Wip1)。该噬菌体表现出非常狭窄的宿主范围,并对炭疽芽孢杆菌具有高度特异性。2013年,Negus等[29]检验了γ、Fah、F7和F9四种噬菌体的溶菌能力。研究发现,F7和F9通过裂解57株杆菌(包括4株炭疽芽孢杆菌)建立了宿主特异性,且F7和F9属于长尾噬菌体科(Siphoviridae),两者都有长且不可收缩的尾巴和二十面体的头部。2018年,Alkalay等[36]从土壤样品中分离到新型高效的炭疽芽孢杆菌噬菌体Negev_SA、Carmel_SA和Tavor_SA,并对其全基因组进行测序和分析,他们表明,这些噬菌体在未来的炭疽噬菌体治疗中具有潜在的应用价值。2020年,Hassim等[37]从怀疑死于炭疽的角马尸体上分离出一种dsDNA噬菌体,并采用经典细菌学方法对不同条件下分离的噬菌体进行检测,以模拟不断恶化的尸体状况。他们采用全基因组测序确定该噬菌体和Crookii噬菌体间的关系,发现这株噬菌体属于肌尾噬菌体科(Myoviridae),与另一株和非洲炭疽菌尸体相关的噬菌体WPh密切相关。Crookii噬菌体对蜡样芽孢杆菌组成成员具有溶解性,但较低浓度(<1×108PFU/mL)的噬菌体对有荚膜的炭疽芽孢杆菌表现出更大的亲和力。这种噬菌体的异常分离证明了噬菌体在环境中的较少剂量和炭疽芽孢杆菌在尸体部位处于的生命周期中的作用。
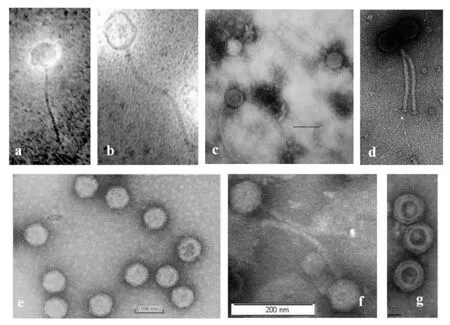
图2 不同的炭疽芽孢杆菌噬菌体电镜图Fig.2 Transmission electron micrographs of different Bacillus anthracis phage
3.2 炭疽噬菌体的国内研究现况1963年,董树林等[39]分离到我国第一株炭疽芽孢杆菌噬菌体,编号为AP631,并对其耐力、宿主范围及裂解特异性进行了初步试验。经裂解试验表明,AP631能够完全裂解国外炭疽强毒菌株、国内分离的地方性炭疽强毒菌株,以及弱毒炭疽芽孢杆菌共计102株。对其他需氧芽孢杆菌,如蜡状芽孢杆菌、蕈状芽孢杆菌、巨大芽孢杆菌、枯草芽孢杆菌等共计13株,全部未能裂解。证明其宿主范围广泛,特异性强。为了进一步利用AP631进行病原学诊断,2005年,王秉翔等[5]按测定噬菌体效价的方法检测AP631裂解已形成荚膜的炭疽菌的作用,结果说明AP631不能裂解已形成荚膜的炭疽芽孢杆菌。将在产荚膜条件和非产荚膜条件下培养的Pasteur NO.2菌分别与AP631进行吸附后,从电镜下可见到AP631大量吸附于未形成荚膜的细菌体周围,而不吸附于有荚膜者。这两个试验证明了炭疽芽孢杆菌的荚膜能够掩盖其噬菌体受体。其实用意义在于用噬菌体鉴定炭疽芽孢杆菌必须在细菌的非产荚膜条件下进行,以避免漏检而影响疾病的诊断。
噬菌体裂解法是鉴定炭疽芽孢杆菌的可靠方法之一。常规方法需要使用幼龄肉汤培养物、试验平板置37℃培养18~24 h后观察结果。为简化手续,缩短鉴定时间,刘茂贤等[40]曾对炭疽芽孢杆菌W噬菌体裂解现象及结果的影响因素作了实验观察,并拟定出3~5 h得出确切结果的快速裂解法,即加大测试菌量、辅以玻璃棒均匀涂布,直接取分离培养物做裂解试验。经实验室保存和疫区新分离炭疽芽孢杆菌的鉴定,证明该法快速、简便、准确,适用于炭疽芽孢杆菌的快速鉴定。
2016年,张慧娟等[41]对陕西省延安市甘泉县炭疽疫点现场分离的5株菌进行蜡样芽孢杆菌的鉴定,通过PCR扩增、小白鼠毒理测定试验和MLST基因检测等方法对该5株菌和实验室保存的3株被AP631炭疽噬菌体裂解的蜡样芽孢杆菌进行毒理和基因测定。结果确定了8株可被AP631炭疽噬菌体不完全裂解的蜡样芽孢杆菌,从疫点采集分离的5株菌青霉素敏感试验阴性,炭疽毒力基因PCR扩增阴性,排除了炭疽芽孢杆菌;蛋白质毒素结晶试验染色试验为阴性,排除了苏云金芽孢杆菌;根据溶血试验和生化反应等一系列鉴别实验鉴定为蜡样芽孢杆菌。这一研究首次证明我国使用的炭疽芽孢杆菌诊断AP631噬菌体可以不完全裂解部分蜡样芽孢杆菌,存在非特异性裂解现象,提示今后使用噬菌体鉴定炭疽芽孢杆菌时,对于外环境分离到的可疑芽孢杆菌,特别要注意关于噬菌体不完全裂解的问题,这为炭疽诊断标准的正确制定提供新的认识并有重要的指导意义。
2019年,Liu等[42]对AP631噬菌体进行了完整的基因组序列测序,并与蜡样芽孢杆菌及其相关物种的其他噬菌体进行了基因组比较分析。噬菌体AP631的双链环状DNA基因组长度为39 549 bp,G+C的含量为35.01%。通过分析发现,噬菌体AP631属于蜡样芽孢杆菌噬菌体分支Ⅱ。基因组比较分析显示,AP631噬菌体与炭疽芽孢杆菌噬菌体Wβ、γ、Cherry和Fah具有高度的序列相似性。
综上所述,我国炭疽芽孢杆菌噬菌体的裂解情况比之国外较少。我们需要更多的炭疽噬菌体,在面对炭疽疫情的暴发时才会有更多有效、可靠的鉴别诊断手段。
4 展望
地球上的噬菌体数量繁多,并且在精准治疗以及耐药菌感染的防控方面展现出巨大的潜力,如果能够合理利用,将是人类面对感染性疾病的重要资源库[43]。但是炭疽噬菌体在分离鉴定等方面仍存在一些不可控因素。比如,所采样的环境中是否含有目标噬菌体,噬菌体的富集过程产生的不可预测的结果,细菌对噬菌体的耐受,以及噬菌体的特异性。由于噬菌体的特异性不仅体现在不同细菌之间,在同一种细菌的不同菌株之间也有体现。由前文的综述可以看出,目前已分离出的可以裂解炭疽芽孢杆菌的噬菌体,也存在裂解其他杆菌的现象。这些问题不仅是分离鉴定炭疽噬菌体的阻碍,也是将炭疽噬菌体用于炭疽芽孢杆菌鉴定以及炭疽的治疗和预防的一大难点。除此之外,若想将炭疽噬菌体用于临床治疗,我们需要更好地了解噬菌体如何与人类免疫系统相互作用,以及清除细菌感染的后果[44],还有就是将炭疽噬菌体用于生态防控,我们需要更多的炭疽噬菌体,并对其进行深入分析、评价,建立相应的评价体系,这对于开发基于噬菌体的应用是至关重要的。
