培养有序思维,发展模型认知
2022-02-18卢晓平张贤金
卢晓平 张贤金
摘要:基于有序思维的培养,在选修课程原电池工作原理的教学中,利用数字化实验设计“原电池装置的改进及原理”的探究教学,通过建立原电池原理的系统认识视角和分析思路,实现由单液原电池到双液原电池装置的改进设计、原理分析和应用举例,培养有序思维,构建有序思维模型,发展模型认知水平。
关键词:模型认知;有序思维;原电池
文章编号:1008-0546(2022)02-0048-05中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.02.010
*本文系全国教育科学“十三五”规划2019年度立项课题教育部青年专项课题“新时代乡村教师精准培训体系构建研究”(课题编号:EKA190518)研究成果。
在利用系统分析思维解决化学实际问题的过程中,有序思维被认为是一种有效思维方式。所谓有序思维是在解决问题过程中,按照一定的顺序、步骤,有效完成任务的思维方式[1]。有序思维化“繁”为“简”,不仅是解决问题的有效思维方式,也是重要的学科思维方法。本文在选修课程“原电池的工作原理”教学中,打破常规教学限制,设计了“原电池装置的改进及原理”的探究教学,通过建立原电池工作原理的认识视角——这一思维的“序”,而后利用数字化实验依“序”解决双液原电池的提出缘由、装置构成和工作原理。在具体问题解决的过程中,培养学生的有序思维,构建有序思维模型,发展学生的模型认知水平。
一、教学思路和流程
在必修课程学习基础上,以铜-锌原电池为例,在复习原电池原理的基础上,设计了建立认识视角、电池缺陷分析、改进设计与论证、应用举例与总结等4个教学环节。教学流程如表1所示。

二、教学过程
1.建立认识视角
【讲述】基于上节课复习建构的原电池工作原理,我们可以建立原电池原理分析的系统认识视角——电极反应、电路构成(包括外电路电子导体导电和内电路离子导体导电)、能量转化。
设计意图:开门见山地总结原电池原理分析的系统认识视角,建立后续具体问题分析、有序思维的出发点。
2.电池缺陷分析
【学生分组实验】铜锌单液原电池工作电流的测定:将打磨好的锌片和铜片连接电流传感器和温度传感器并浸入0.5 mol/L CuSO4溶液。实验装置和数据如图1。

【问题】实验现象和你预期的现象有何不同?
【学生回答】除了铜片表面有铜析出,锌片表面也有铜析出;反应过程中电流逐渐减小,温度逐渐升高。
【问题】结合实验现象和原电池原理分析的三个视角思考为什么反应过程电流减小?
【学生讨论、回答】原电池电流减小的原因是由于Zn与Cu2+直接接触反应,导致外电路部分Cu2+没有在正极得电子,致使反应过程电子移动的数目减小;温度升高表示部分化学能转化为热能;生成的铜覆盖在锌片表面,使锌失电子变困难。
【问题】刚才我们从反应、外电路电子移动情况和能量转化的视角分析电流减小的原因。那么内电路离子移动的情况如何呢?是否会对电流大小产生影响呢?
【讲述】下面我们来通过微观图示分析原电池内电路离子的移动情况和离子分布变化。首先,我们应该明确在原电池中离子移动的动力主要是电场作用和因离子浓度差引起扩散作用[2]:即在电场作用下,阴离子移动到负极,阳离子移动到正极;在离子浓度不均匀的溶液中,离子总是从浓度大的区域扩散到浓度小的区域,以使溶液中的各离子浓度分布均匀。在构成原电池装置前,硫酸铜溶液中Cu2+、SO2-4离子分布均匀(如图2A所示)。构成原电池后,负极Zn溶解形成Zn2+,正极Cu2+转化为Cu析出,使负极区的Zn2+、Cu2+浓度大于正极区对应离子浓度,此时电场作用和扩散作用一致,均使Zn2+、Cu2+向正极移动(图2B)。而SO2-4在反应过程中浓度不变,但在电场作用下,SO2-4移动到负极区,而移动过程中又会受到扩散作用的阻碍,移动较慢。由于各离子的移动速率不同(Zn2+、Cu2+移动速率也可能不同),一段时间后,溶液中就会出现电荷不平衡的情况,如负极区负电荷过剩,正极区正电荷过剩(图2C),这种情况也可能导致电流减小。
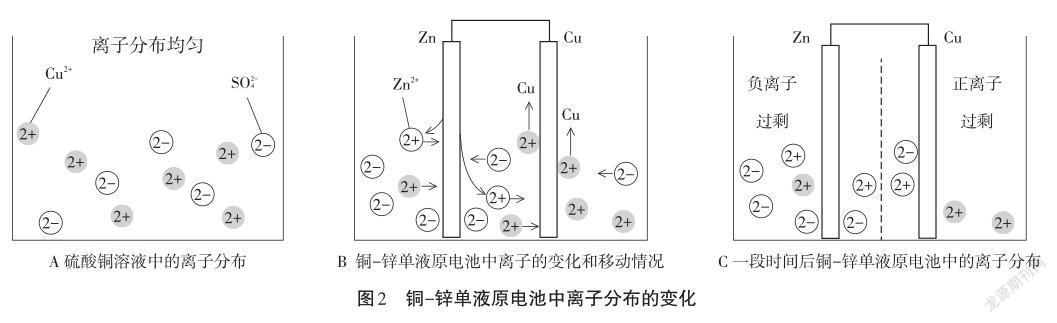
【小結】通过我们刚才的讨论,我们一起来总结一下单液原电池的缺陷——电流衰减是由哪些原因引起的?我们是如何找到原因分析的出发点的?我们从原理模型建立原电池分析的三个视角——电极反应、电路构成、能量转化出发,分析三者的变化情况。反应的变化——锌和硫酸铜直接接触反应;电路的变化——外电路电子转移数目减少,内电路离子分布不均;能量变化——部分化学能转化为热能,化学能转化为电能的能量效率降低。这三个方面变化的关键问题都在于锌铜直接接触反应引起的。
设计意图:本环节通过数字化实验,发现铜锌单液原电池的缺陷,讨论缺陷成因,引导学生通过原电池原理分析的认识视角和思路,从装置的反应变化、能量转化变化、内外电路的电子移动变化和离子分布变化三个视角进行有序思维,建立解决问题的程序性思维方法。为下一环节原电池装置的改进分析提供有序思维范例。
3.改进设计与论证
【问题】通过刚才的单液原电池的缺陷分析过程,同学们能否设计一个原电池的改进装置,提高电流效率呢?
【学生回答】将锌和硫酸铜分开。
【问题】非常好,如何将锌和硫酸铜分开呢?我们同样从三个视角——电极反应、电路构成、能量转化出发,设计方案对单液原电池装置进行改进。从电极反应视角分析,如何将铜-锌单液原电池拆分为双液原电池,使锌与硫酸铜溶液不直接接触?
【学生回答】锌和硫酸锌一个装置,铜和硫酸铜一个装置。
【讲述】根据两个电极半反应单液原电池拆分为两个装置,我们称之为双液原电池——负极锌片和负极生成物锌离子(硫酸锌)组成负极池,正极铜片和正极反应物硫酸铜组成正极池。正负极池可以是两个容器,也可以使用隔板隔开,形成双液原电池。
【问题】从电路构成视角分析,如何使两个半电池装置,构成闭合回路。根据原电池模型可以使用离子导体联通,也可以使用电子导体联通。请同学们尝试利用电子导体(锌片、铜片、导线)和离子导体分别画出一种改进装置图。
【学生讨论、设计】图3为学生设计装置。
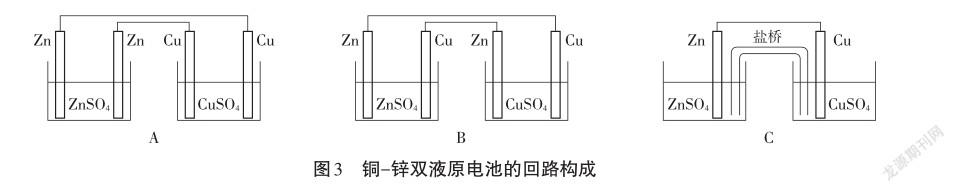
【设问】这里的“盐桥”是什么?“盐桥”的成分是什么?起到什么作用?盐桥是在两个分隔开的半反应装置间架起一座“电解质桥”,为正、负极池间提供一个离子通道。這个通道需要使用一定的载体,比如滤纸、棉花以及课本中提及的琼脂等吸收电解质溶液做成“盐桥”。
【问题】如何证明你的设计方案是否实现了单液原电池的缺陷改进?
【学生回答】测定反应过程温度是否不变,电流是否稳定。
【学生分组实验】下面请同学们分组进行实验探究,分别组装图3中的实验装置,其中装置C的盐桥分别使用吸收0.5 mol/L CuSO4溶液、0.5 mol/L ZnSO4溶液、饱和KCl溶液的滤纸,以及装有吸收KCl饱和溶液的琼脂的U型管,同时使用数字传感器记录反应过程的电流变化和温度变化(图4)。请小组同学分配任务进行实验,然后再汇总实验结果,并进行讨论分析。
【学生汇报】使用电子导体连接两个半电池,效果不理想:装置A电流接近0,原因可能是电极相同,不产生电流;装置B能产生电流,但电流仍不稳定,随反应进行而逐渐减小,反应过程中温度也在持续上升,推测装置B可能因为仍然是像单液原电池一样锌与硫酸铜直接接触,电流效率较低。装置C中使用各种载体,反应过程的温度都没有明显变化,但电流都很小,其中使用硫酸锌溶液和硫酸铜溶液制作的盐桥电流接近0,而使用饱和氯化钾溶液制作的盐桥,无论是用滤纸做载体还是用琼脂做载体,形成的电流相对较大,但其电流较单液原电池还是减小很多。琼脂和滤纸两种载体相比,琼脂吸收氯化钾做盐桥的效果最好,产生电流最稳定且最大。
【讲述】同学们的讨论非常好。使用电子导体连接两个半电池,效果不理想。而使用不同溶液作为盐桥的效果也不尽相同,为什么KCl饱和溶液的效果最佳呢?为了解决这个问题,我们首先应该弄清盐桥的作用是什么。由于双液原电池反应过程中负极区生成Zn2+,使正离子过剩,因此Cl-移动到负极区,平衡电荷;而正极区消耗Cu2+,使负离子过剩,因此K+移动到正极区,平衡电荷。由于在外加电场作用下,饱和KCl溶液中K+和Cl-移动速率相近,从而实现两极区的电荷平衡,提供稳定电流,而CuSO4溶液、ZnSO4溶液中阴、阳离子的迁移速率不同,一段时间后,仍然会使两极的电荷不平衡,因此效果不如KCl饱和溶液。而同样使用KCl饱和溶液,载体使用琼脂和滤纸的效果不同,可能原因是滤纸固定溶液的效果不够理想。
【小结】1.盐桥材料应选择能通过离子的微孔材料,如滤纸、牛皮纸等,实验室往往使用琼脂方便吸收和固定溶液,形成较稳定的电流;2.选择阴阳离子迁移速率接近的溶液,如KCl,可使两个半电池的电荷平衡;盐桥的作用是构成回路(离子导体),平衡电荷;3.与单液原电池相比,双液原电池电流稳定,能量没有明显损失,但电流变小,可能是由于盐桥的截面积较小,单位时间通过的电子数目少引起的【3】。
设计意图:本环节应用原电池三个认识视角系统分析单液原电池的装置改进,从控制电极反应不变的视角引导学生拆分单液原电池,从电子导体和离子导体两方面设计方案构成双液原电池的闭合回路,从电流稳定性和能量转化效率视角论证装置的可行性。体会有序思维方法在解决问题中的重要作用。
4.应用举例与总结
【问题】那么我们再来思考,如果两个半电池使用隔板隔开,中间隔板(或隔膜)有什么要求呢?这种装置相较使用盐桥的双液原电池的优点有什么?
【学生回答】隔板要有孔。这种装置更轻便。
【讲述】是的,隔板(或隔膜)上要有微孔,甚至有些隔膜只允许某种特定的离子通过,这就是我们后面会介绍的离子交换膜。这种装置除了轻便以外,研究表明[3]其电流接近单液原电池大小,因此运用广泛。比如课本介绍的碱性锌锰干电池(图5A[4]),使用牛皮纸为隔膜;纽扣式银锌电池使用浸了KOH溶液的隔板(图5B[5]);锂离子电池使用隔膜(图5C[6])等。


【小结】本节课通过原电池的工作原理模型,建立分析原电池问题的三个认识视角——电极反应、电路构成、能量转化,讨论了单液原电池的缺陷、改进方案,设计了双液原电池并通过实验检验得出通过盐桥和隔膜,可以将单液原电池拆分为双液原电池,这种电池克服了单液原电池电流衰减的问题,产生的电流稳定,电流效率高,尤其是使用隔膜的电池电流大且稳定,效果更佳。通过本节课的学习,同学们今后在解决具体化学问题时,首先应寻找问题中蕴含的化学原理,善于利用化学原理模型,建立认识视角,通过有序思维分析和解决问题,形成解决问题的一般思路(图6)。

设计意图:本环节通过利用隔膜拆分单液原电池的设想分析和应用举例,引起学生对学习价值的认同。最后梳理整节课有序思维的过程,构建应用有序思维解决问题的程序模型,形成程序性学科思维方法。
三、教学反思
选修课程双液原电池工作原理的教学中常见的设计是直接给出电池装置,分析其优缺点,解释盐桥的作用。这种设计只是将知识直接给予学生,却未关注知识的来龙去脉,导致学生学习后对双液原电池装置的认识不深,不理解两个半反应装置的设计思路,经常在遇到陌生双液原电池时,不能有效分析其装置原理。因此,教学中有必要就双液原电池装置的设计思路进行探究,让学生知其然且知其所以然,同时在探究过程中,通过系统地建立认识视角,进行有序思维,并最终构建有序思维模型,提升模型认识水平,实现从显性的学科知识到隐性的学科思维的升华[7]。
参考文献
[1]周玉芳.让学生思维从“无序”走向“有序”——浅谈学生有序思维方式的培养[J].化学教与学. 2012(3):8-9.
[2]陈益,孙夕礼.促进学生认识发展的学科教学认识的构建——以“原电池”为例[J].化学教育(中英文),2018,39(1):27-32.
[3]王俊祺,杨明生,徐浩年.化学学科核心素养为导向的课堂实录——探究原电池的发展[J].化学教育(中英文),2020,41(3):33-37.
[4]曹波.废旧碱性干电池的实验教学案例[J].中国现代教育装备,2015(6):50-52.
[5]王祖浩.普通高中课程标准实验教科书:化学反应原理[M].南京:江苏教育出版社,2014:15.
[6]江合佩.基于真实情境的项目式化学教育[M].济南:山东科学技术出版社,2019:55
[7]张丽华,杨玉琴.“原电池”教学30年演进研究[J].化学教育(中英文),2019,40(15):41-47
