美洲大蠊提取物对脓毒症小鼠心肌的保护作用及PGC-1α、UCP2表达的影响
2022-02-17杜金穗唐品清吴冬雪董辰辰
李 洁,杜金穗,唐品清,吴冬雪,董辰辰
(1. 东南大学附属中大医院,江苏 南京 210009;2. 东南大学医学院,江苏 南京 210009)
脓毒症是由感染诱发的机体系统性炎症反应,通过激活免疫系统释放多种炎症因子,免疫失衡的炎症反应会导致全身多系统、多器官功能障碍,是临床重症监护病房危重患者的死亡常见原因[1]。脓毒症导致的心肌损伤累及心脏收缩和舒张功能,一旦并发休克出现血流动力学异常,通常预后较差,故早期干预脓毒症心肌损伤具有重要的临床意义[2]。脓毒症心肌损伤的发病机制与机体炎症反应、氧化应激、一氧化氮及能量代谢失衡等因素密切相关。线粒体是合成三磷酸腺苷(ATP)的主要细胞器,其还参与钙储备调控、细胞信息传递以及细胞凋亡调控,对各种损伤极为敏感,是防治脓毒症心肌损伤的主要干预靶点。脓毒症发生时,活性氮和氧自由基的生成增加,线粒体内外钙稳态失衡,线粒体嵴被破坏,引起线粒体发生肿胀、碎裂,损伤线粒体有氧呼吸功能,导致合成ATP功能障碍[3]。目前研究证实,中医药可从线粒体能量代谢、线粒体融合与分裂、线粒体氧化应激等多个方面调控机体五脏阴阳平衡,阐明了中医药以细胞线粒体为靶点调节“气”的作用机制[4]。脓毒症心肌损伤以正虚毒损、络脉瘀滞为主要病机,中医药能通过清热解毒、扶正固本、活血化瘀等调节机体的气血阴阳平衡,进而防治脓毒症心肌损伤[5]。心脉隆注射液以美洲大蠊成虫为原料提取、精制而成,其可以通过激活P13/Akt通路、抑制Erk1/2-P38MAPK信号通路抑制心肌细胞自噬,减轻抗肿瘤药物表柔比星对心脏的毒性作用[6],但其对于脓毒症心肌损伤的保护作用及机制尚不明确。本研究采用具有抗原性的脂多糖(LPS)建立脓毒症小鼠模型,探讨了心脉隆注射液对脓毒症心肌保护作用及可能作用机制。
1 实验材料与方法
1.1实验动物 SPF级健康雄性C57BL/6J小鼠30只,体重(25±2)g,由东南大学实验动物中心提供,动物合格证号:SYXK(苏)2016-0014。动物饲养在温度(23±2)℃、湿度40%~70%的动物房,12 h明暗循环,自由饮食和饮水。
1.2药物和试剂 心脉隆注射液(云南腾药制药股份有限公司,批号:1712101,规格:2 mL/100 mg);LPS(血清型O111:B4,Sigma-Aldrich公司);超氧化物歧化酶(SOD)活力检测试剂盒以及丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;小鼠肿瘤坏死因子-α(TNF-α) ELISA试剂盒购自联科生物科技公司;过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)抗体、解耦联蛋白2(UCP2)抗体购自武汉赛维尔生物有限公司。
1.3实验动物分组与给药 将小鼠随机分为3组:空白组和脓毒症组连续3 d腹腔注射生理盐水,心脉隆注射液组连续3 d腹腔注射心脉隆注射液200 mg/(kg·d),脓毒症组和心脉隆注射液组第3天同时腹腔注射LPS 10 mg/kg。
1.4检测指标及方法
1.4.1心肌酶及氧化应激指标 LPS注射8 h后,采用20%乌拉坦(0.5 mL/100 g)腹腔注射麻醉各组小鼠(包括空白组小鼠),开胸心脏取血5 mL,置不加抗凝剂的试管内,3 000 r/min离心10 min,分离血清,-20 ℃保存。应用全自动生化分析仪检测血清乳酸脱氢酶-1(LDH-1)及肌酸磷酸激酶同工酶(CK-MB)水平,应用黄嘌呤氧化酶法检测血清超氧化物歧化酶(SOD)活力,应用分光光度法检测血清丙二醛(MDA)水平。
1.4.2心肌组织病理表现 取血后,迅速分离心肌组织,新鲜组织用固定液固定24 h,脱水浸蜡,将浸蜡的组织于包埋机内进行包埋,于-20 ℃冻台冷却,将修整好的蜡块置于石蜡切片机切片,厚4 μm。切片漂浮于摊片机40 ℃温水上将组织展平,载玻片将组织捞起,60 ℃烘箱内烤片,取出常温保存,HE染色后进行镜下观察。
1.4.3心肌组织中TNF-α含量 称取心肌组织,按重量与体积1∶9 的比例,加入9倍体积的生理盐水,冰水浴条件下制成 10%的匀浆,2 500 r/min离心10 min,取上清,按ELISA试剂盒说明书,酶标仪450 nm波长处测定OD值。根据标准品的浓度和OD值做标准曲线,根据标准曲线方程计算出TNF-α含量。
1.4.4心肌组织中 PGC-1α、UCP2蛋白表达情况采用Western blot法检测:心肌组织块用预冷的PBS洗涤2~3次,剪成小块置于匀浆管中,采用BCA法对心肌组织进行蛋白定量。将蛋白溶液按照4∶1的比例加入上样缓冲液,沸水浴变性15 min后-20 ℃冰箱保存。SDS-PAGE电泳,转膜,将转印完的膜放入装有TBST缓冲液的孵育槽中,室温下封闭30 min。倒掉孵育槽中的封闭液,加入配置好的一抗GAPDH(1∶1 000)、PGC-1α(1∶1 000)、UCP2(1∶2 00),4 ℃孵育摇床过夜;回收一抗,洗膜,然后加入TBST缓冲液,放置脱色摇床上快速洗脱,每次5 min,洗3次;将二抗用TBST缓冲液按照1∶5 000的比例进行稀释,室温下孵育30 min;用TBST缓冲液快速涮洗膜3次,然后再加入TBST缓冲液,放置脱色摇床上快速洗脱,每次5 min,洗3次。 在暗室中将PVDF膜的蛋白面朝上放在曝光匣两层薄膜之间,加入混合好的ECL溶液充分反应,1~2 min后,去尽残液,盖上层薄膜开始压胶片。压完的胶片用显影、定影试剂进行显影和定影。Alpha软件处理系统分析目标带的光密度值。

2 结 果
2.1各组小鼠血清LDH-1、CK-MB水平比较 脓毒症组小鼠血清LDH-1、CK-MB水平均明显高于空白组(P均<0.05),心脉隆注射液组小鼠血清LDH-1、CK-MB水平均明显低于模型组(P均<0.05)。见表1。
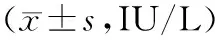
表1 空白组和脓毒症各组小鼠血清LDH-1、CK-MB水平比较
2.2各组小鼠血清SOD、MDA水平比较 与空白组比较,脓毒症组小鼠血清SOD水平明显降低(P<0.05),血清MDA水平明显增高(P<0.05);与脓毒症组比较,心脉隆注射液组小鼠血清SOD水平明显增高(P<0.05),血清MDA水平明显降低(P<0.05)。见表2。
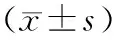
表2 空白组和脓毒症各组小鼠血清SOD、MDA水平比较
2.3各组小鼠心肌组织病理形态 HE染色显示,空白组小鼠心肌细胞形态及排列正常,无明显炎性细胞浸润,组织间隙无异常改变;脓毒症组小鼠心肌细胞排列紊乱,有炎性细胞浸润;与脓毒症组比较,心脉隆注射液组小鼠心肌细胞排列紊乱减轻,心肌组织中炎性细胞浸润较少。见图1。

图1 空白组和脓毒症各组小鼠心肌组织HE染色表现(×200)
2.4各组小鼠心肌组织中TNF-α含量比较 空白组、脓毒症组、心脉隆注射液组TNF-α含量分别为(71.69±10.95)pg/mL、(283.23±58.07)pg/mL、(157.82±29.06)pg/mL,脓毒症组明显高于空白组(P<0.05),心脉隆注射液组明显低于模型组(P<0.05)。
2.5各组小鼠心肌线粒体中PGC-1α、UCP2蛋白表达情况比较 脓毒症组小鼠心肌线粒体中PGC-1α、UCP2蛋白表达量均明显低于空白组(P均<0.05),心脉隆注射液组均明显高于脓毒症组(P均<0.05)。见图2。

图2 空白组和脓毒症各组小鼠心肌线粒体中PGC-1α和UCP2蛋白表达情况
3 讨 论
心脉隆注射液具有益肾、利尿消肿、改善循环等作用,可保护脓毒症患者的肠黏膜屏障,缓解临床症状,改善患者预后[7]。近年心脉隆注射液用于心力衰竭的研究显示,其不仅可以缓解慢性充血性心力衰竭患者气阳两虚、瘀血内阻等相关症状[8],还可以调控心肌细胞钙转运,改善肌浆网对钙离子的调节作用,缓解线粒体内外的钙稳态失衡,维持重症心力衰竭患者的血流动力学稳定[9]。本课题组前期研究结果表明,美洲大蠊提取物可通过pink1/parkin信号通路调控自噬相关蛋白线粒体融合蛋白1(MFN1)、线粒体融合蛋白2 (MFN2)、OPA1、Drp1的表达,拮抗LPS诱导的H9C2心肌细胞凋亡[10];还可以通过AMPK/PGC-1α信号途径抑制LPS诱导的肝细胞氧化应激以及炎症反应过程,维持肝细胞线粒体膜电位平衡,有效拮抗LPS诱导的线粒体结构和功能损伤[11],但心脉隆注射液对脓毒症心肌损伤的保护作用及机制仍不十分明确。
氧化应激反应是脓毒症发病进程中的重要环节。脓毒症时释放的炎症介质诱导产生大量氧自由基,氧自由基可以通过c-Scr /脱乙酰化酶-3通路介导炎症因子TNF-α的表达,诱导mtDNA出现氧化损伤,影响线粒体氧化磷酸化效应,加速心肌线粒体DNA损伤和能量合成障碍,影响心脏收缩和舒张功能,导致脓毒症患者血流动力学不稳定;另外氧化应激反应可导致线粒体动力平衡失调,伴线粒体膜内膜和外膜结构的损伤,诱发组织器官损伤[12-13]。 动物实验也证实,LPS诱导脓毒症大鼠体内氧化系统和抗氧化系统失衡,产生大量氧自由基,引起心肌氧化损伤[14]。本实验采用腹腔注射LPS制备脓毒症心肌损伤模型,结果显示脓毒症组小鼠血清LDH-1、CK-MB、MDA水平及心肌组织中TNF-α含量明显升高,SOD水平明显降低,病理观察显示心肌组织有炎性细胞浸润,提示脓毒症小鼠发生炎症反应及氧化应激反应,导致心肌损伤;心脉隆注射液组小鼠血清LDH-1、CK-MB、MDA水平及心肌组织中TNF-α含量均明显低于脓毒症组,SOD水平明显高于脓毒症组,表明心脉隆注射液能抑制心肌炎症及氧化应激反应,对脓毒症诱发的心肌损伤具有保护作用。
有研究表明,PGC-1α参与调节线粒体质量控制和能量代谢,PGC-1α与线粒体内膜上UCP2相结合可以介导UCP2的表达;UCP2的过表达能抑制氧自由基产生,调控线粒体的钙摄取,缓解炎症导致的心肌线粒体损伤[15-16]。本实验结果显示, 脓毒症组小鼠心肌线粒体中PGC-1α、UCP2蛋白表达量均低于空白组,心脉隆注射液组均高于脓毒症组,提示心脉隆注射液可能通过激活PGC-1α/UCP2通路抑制脓毒症小鼠心肌氧化应激以及炎症反应。
综上所述,美洲大蠊提取物心脉隆注射液对脓毒症小鼠的心肌细胞具有保护作用,其作用机制与抑制PGC-1α/UCP2介导的心肌炎症及氧化应激反应有关,为探讨中西医结合防治脓毒血症心肌损伤提供了新的思路。
利益冲突:所有作者均声明不存在利益冲突。
