香港牡蛎(Crassostrea hongkongensis)新型凝集素ChPerlucin的基因克隆与功能研究
2022-02-17赵泽慧张爱娇杨雨澄毛帆肖述李军张扬向志明喻子牛
赵泽慧, 张爱娇, 杨雨澄, 毛帆, 肖述, 李军, 张扬, 向志明,喻子牛
1. 中国科学院热带海洋生物资源与生态重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 中国科学院大学, 北京100049
先天性免疫是无脊椎动物最主要的免疫防御体,而凝集素作为一种模式识别受体(pattern recognition receptor, PRR), 是先天性免疫中研究得最多的蛋白家族。该蛋白可以同病原表面的分子结合, 促进细胞进行吞噬, 以及促进下游信号的传导, 激活免疫系统, 或者直接引起病原的凝集、杀菌等(Ni et al,1996)。目前, 动物的凝集素分子按照识别多糖的特异性、结合位点、分子结构和功能进行分类, 主要可以分为C-型凝集素(C-type lectin)、S-型凝集素(galectin)、P-型凝集素(P-type lectin)等(Drickamer,1993)。典型的凝集素都有钙离子识别位点, 需要依赖钙离子来识别和结合病原, 并且还有糖基识别结构域(carbohydrate recognition domain, CRD), 也称C-型凝集素结构域(C-type lectin domain, CTLD), 宿主可以通过CTLD 结构域识别侵染的外源病原(王昊, 2006)。例如, 甲壳动物C-型凝集素可以通过该结构域凝集细菌(Sun et al, 2008)、吞噬细胞(Luo et al,2006), 以及抗病毒等(Zhao et al, 2009)。
甘露聚糖结合凝集素(mannan-binding lectin,MBL)是一种比较特殊的C-型凝集素, 可识别并结合甘露聚糖, 抵抗外来细菌、病毒的侵染(顾圆圆 等,2008)。MBL 包含胶原样区(collagen-like region)、富含半胱氨酸的 N 末端(cysteine-rich regions)、颈区(neck region)和能够识别抗原糖基的糖识别域(carbohydrate recognition domain, CRD)(Taylor et al,1989; Presanis et al, 2003)。MBL 可选择性结合表面富含甘露寡糖的病原体; 可特异性结合细胞表面受体, 活化巨噬细胞, 介导调理吞噬作用, 促进溶解细菌, 吞噬病毒和调节炎症等; 也可通过MBL 途径激活补体, 抵抗外来细菌、病毒的侵染(Endo et al,2003)。
目前, 相关研究者在软体动物中已克隆了多个甘露聚糖结合蛋白基因, 如澳洲绿唇鲍(Haliotis rubra) (Mann et al, 2000)、海湾扇贝(Argopecten irradians) (Huang et al, 2013)、杂色鲍(Haliotis diversicolor) (Mann et al, 2000)等, 并进行了一系列的功能研究。例如, 栉孔扇贝的重组 CFLec-1 蛋白可显著抑制溶壁微球菌的生长, 在Ca2+存在下对大肠杆菌也有明显的凝集作用(王昊, 2006)。香港牡蛎(Crassostrea hongkongensis)是我国重要的水产养殖品种, 其因较高的营养价值而受到市场欢迎(农业农村部渔业渔政管理局 等, 2019)。该物种有关先天性免疫基因的研究非常多, 而且很多先天性免疫的基因都有被发掘和研究, 然而关于香港牡蛎C-型凝集素甘露聚糖结合蛋白基因的克隆与表达分析尚未有报道。
本文首次在香港牡蛎中克隆了一种新C-型凝集素超家族成员——甘露聚糖结合蛋白编码基因, 并分析了其序列特征、组织分布和发育时期的转录表达水平。 在溶血性葡萄球菌(Staphylococcus haemolyticus)、溶藻弧菌(Vibrio alginolyticus)刺激后,ChPerlucin基因表达发生了显著性变化; 将其成功导入毕赤酵母pPIC3.5K 蛋白表达载体, 通过毕赤酵母表达了ChPerlucin 蛋白, 并研究了该蛋白的蛋白功能。本文研究结果将有助于揭示香港牡蛎抗细菌感染的分子机制。
1 材料与方法
1.1 实验材料
2018 年6 月, 实验所用的成体香港牡蛎采自湛江市东海岛养殖场, 挑选壳高约为 90mm 的香港牡蛎若干, 暂养于实验室循环水养殖系统, 水温27℃,盐度22‰, 连续充气, 每天投喂海藻粉2 次。
1.2 细菌感染
实验分为3 组: 实验组为溶藻弧菌(V. alginolyticus)和溶血性葡萄球菌(S. haemolyticus), 对照组注射相同体积的磷酸盐缓冲溶液(phosphate buffer saline,PBS)。每个实验组含30 只香港牡蛎, 以每100g 需100μL 的剂量, 对闭壳肌注射浓度为1×108CFU·mL–1的菌液。注射后于0、6、12、24 和48h, 每组取5 只香港牡蛎, 分别提取血淋巴细胞,离心后加Trizol、匀浆, 保存于-80℃冰箱中备用。
1.3 RNA 提取与cDNA 的合成
选取5 只健康香港牡蛎, 分别取唇瓣、外套膜、性腺、消化腺、闭壳肌、鳃、心脏和血淋巴细胞8个组织, 分别加入1mL Trizol, 匀浆, 保存于-80℃冰箱中备用。对于胚胎发育时期的样品, 本研究收集香港牡蛎在受精卵、2 细胞、4 细胞、囊胚、原肠胚、担轮幼虫、D 形幼虫等不同时期的发育样品, 分别加入 1mL Trizol, 匀浆, 保存于-80℃冰箱中备用。按照说明书步骤, 利用Trizol(Invitrogen)法提取总RNA, 采用1.5%的琼脂糖凝胶电泳和NanoDrop 2000 分光光度计检测其浓度和质量, 并保存于-80℃冰箱。用Prime ScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)试剂盒进行反转录, 操作方法按说明书进行。
1.4 ChPerlucin 基因克隆
根据组内已有的转录组数据, 筛选到ChPerlucin部分序列, 根据此序列利用Premier 5.0软件设计5′RACE 和3′RACE 特异性引物(表1), 全长扩增采用SMART RACE cDNA Ampilification Kit(TaKaRa)试剂盒, 通过巢式PCR 进行RACE 扩增,操作方法按说明书进行。第 1 轮PCR 反应条件为:95℃ 3min; 95℃ 30s, 72℃ 3min, 5 个循环; 95℃30s, 70℃ 30s, 72℃ 3min, 5 个循环; 95℃ 30s, 68℃30s, 72℃ 3min, 30 个循环; 72℃ 10min, 4℃保存。以第1 轮PCR 产物为模板, 进行第2 轮PCR 反应,反应条件为: 95℃ 3min; 95℃ 30s, 68℃ 30s, 72℃3min, 30 个循环; 72℃ 10min, 4℃保存。PCR 产物用1.5%的琼脂糖凝胶电泳检测, 产物胶回收后连接PMD19-T, 使用DH5α 感受态细胞进行转化, 筛选阳性克隆并送至华大基因进行测序。

表1 引物信息Tab. 1 Sequences of designed primers used in this study
1.5 ChPerlucin 基因生物信息学分析
利用NCBI 数据库(https://blast.ncbi.nlm.nih.gov/Blast/) 进行同源序列分析, ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)进行开放阅读框确定及序列翻译, 蛋白分子量与等电点的预测使用Compute pI/Mw 工 具 (http://web.expasy.org/compute_pi/), 结构域的预测使用 SMART(http://smart.embl.de/), 利用 MEGA X 中的 Neighbor-Joining(NJ)构建系统进化树。
1.6 不同组织、发育时期ChPerlucin mRNA 的表达模式
采用SYBR® Premix Ex TaqTM(TaKaRa)染料法,在LightCycler 480Ⅱ荧光定量PCR 仪上进行PCR反应。检测ChPerlucin在健康香港牡蛎不同组织中的表达, 包括唇瓣、外套膜、性腺、闭壳肌、消化腺、鳃、心脏和血淋巴细胞; 同时采用受精卵、2细胞、4 细胞、囊胚期、原肠期、担轮幼虫、D 型幼虫等不同发育时期的样品做定量表达, 检测目标基因在不同发育时期的表达情况, NADPH 为内参基因。NADPH 引物来自文献(Qu et al, 2015)。PCR 反应程序为: 50℃ 2min, 95℃ 2min; 95℃ 15s, 55℃30s, 72℃ 30s, 40 个循环。熔解曲线程序为: 95℃ 15s,60℃ 30s, 95℃ 15s。每个样品做3 个重复。运用2–ΔΔct法计算ChPerlucin基因在不同组织和不同胚胎发育时期的相对表达量, 使用SPSS19.0 软件对实验组和对照组的表达量进行单因素方差分析。
1.7 血淋巴组织应答免疫刺激后ChPerlucin 基因的差异表达
取刺激后的cDNA 模板, 检测ChPerlucin基因在血淋巴细胞中的表达情况, 其分析方法与组织的表达分析方法相同, 分别采用SPSS 17.0 软件和t检验法进行多重比较及显著性分析(P<0.05 为显著水平)。
1.8 ChPerlucin 重组蛋白的获取和纯化
1.8.1 pPIC3.5K-ChPerlucin重组表达载体的构建
分别在ChPerlucin表达扩增的蛋白质编码区上游和下游引物中添加BamHⅠ和EcoRⅠ酶切位点,以及ATG 翻译起始密码与His 表达标签序列。通过酶切、连接、转化至TOP10 菌株中, 挑选单克隆菌株, 酶切、测序检测, 获得pPIC3.5K-ChPerlucin阳性克隆载体。
1.8.2 pPIC3.5K-ChPerlucin重组表达载体的转化
用Sac1 酶对pPIC3.5K-ChPerlucin质粒进行线性化, 采用电转化仪电转化于毕赤酵母(GS115)感受态中。涂布 150μL 转化后的酵母液于 RDB+G418(1mg·mL-1)平板(1mol·L-1的山梨醇、10%的13.6%YNB、10%的20%葡萄糖、1%的100×AA、0.2%的500×B、100μg·mL–1的G418)上, 30℃培养4~5d。
1.8.3 小量表达筛选
挑取RDB+G418 平板上的单克隆进行PCR 鉴定, 将鉴定为阳性的单克隆置于装有 1.5mL YPG(1.0%的酵母浸出物、2.0%的蛋白胨、2.0%的丙三醇)液体培养基的试管中培养48h, 同时点在YPG平板上保种。试管取出后静置5~6h, 弃上清, 加入1mL 含1%甲醇的YP(1.0%的酵母浸出物、2.0%的蛋白胨、10%的pH6.0 磷酸缓冲液)在30℃下培养24h,再加入200uL 含5%甲醇的YP 进行诱导, 30℃下培养24h。抽提蛋白, 上样PAGE 胶进行凝胶电泳、蛋白免疫印迹法(Western blot)检测。
1.8.4 摇瓶发酵
根据小量表达筛选结果扩大培养, 将验证的阳性克隆单菌落按照Pichia Expression KitTM说明书所推荐的方法进行诱导表达, 取样, 裂解细胞后再进行RT-PCR 和SDS-PAGE 电泳检测外源基因的表达情况。
1.8.5 蛋白免疫印迹法检测ChPerlucin 蛋白
使用镍柱亲和层析法对蛋白进行纯化, 分别取洗脱诱导蛋白、穿透液和原液进行蛋白质聚丙烯凝胶电泳。取SDS-PAGE 电泳后蛋白胶, 电转至PVDF膜上; His 标记一抗(兔抗)4℃过夜反应, TBST 缓冲液(北京华越洋生物科技有限公司)洗涤; HRP(辣根过氧化物酶)标记二抗反应1.5h, 再TBST 洗涤; 用ECL 试剂(赛默飞)孵育后曝光、显影、定影, 最后进行结果分析。
1.9 ChPerlucin 蛋白的抗菌活性检测
使用 BCA 蛋白 Assay 试剂盒(赛默飞)进行ChPerlucin 重组蛋白和BSA 的浓度测定, 方法按照说明书操作。采用37℃过夜生长的溶藻弧菌, 按照1:100 进行接种, 分别加入BSA、ChPerlucin、Amp,检测目标蛋白的抑菌效果, 阴性对照组为BSA(50μg·mL–1), 实验组为纯化的ChPerlucin 重组蛋白(50μg·mL–1), 阳性对照组为Amp(50μg·mL–1)。每组3 个重复, 摇床37℃下转速设为220rpm, 每隔20min 测一回OD600, 每回测3 次, 取平均值。
2 结果
2.1 ChPerlucin 全长cDNA 的克隆
ChPerlucincDNA 全长577bp, 包含一个21bp的5'-非编码区(untranslated region, UTR)和73bp 的3'-UTR(图1)。该基因有一个483bp 的开放阅读框(open reading frame, ORF), 以及典型的起始密码子ATG 和终止密码子TAG。其ORF 编码有160 个氨基酸, 理论分子量为18kDa, 等电点为5.95。SMART分析显示ChPerlucin包含一个典型的lectin 结构域。序列已提交 NCBI 数据库, 其基因编号为 MW 666179。

图1 ChPerlucin 全长cDNA 核苷酸序列及其编码的氨基酸序列(a)和CLECT 结构域(b)小写字母表示UTR 区, 大写字母表示ORF 区, 起始密码子ATG 和终止密码子TAG 为加粗字体, 结构域CLECT 用方框标出。*代表蛋白翻译终止, 最后连续的小写字母a 表示polyA 尾Fig. 1 Nucleotide and amino acid sequences of ChPerlucin (a) and CLECT domain (b). Lower-case letters indicate UTR area,and upper-case letters indicate ORF area. Start codon ATG and stop codon TAG are bold, and the structure domain CLECT has been marked with a box. * represents the termination of protein translation, and the last continuous lower-case letter a represents the polyadenylation tail
2.2 ChPerlucin 氨基酸序列的同源性分析
将ChPerlucin氨基酸序列与长牡蛎(Crassostrea gigas)、美洲牡蛎(Crassostrea virgnica)、巨海扇蛤(Pecten maxiumus)、海湾扇贝(Argopecten irradians)、虾夷扇贝(Mizuhopecten yessoensis)、澳洲绿唇鲍(Haliotis laevigata)、盘鲍(Haliotis discus discus)、杂色鲍(Haliotis diversicolor)、菲律宾蛤仔(Ruditapes philippinarum)、海蜗牛(Aplysia californica)、仿刺参(Apostichopus japonicus)、线虫(Drosophila elegans)和人(Homo sapiens)的C-型凝集素氨基酸序列进行比对分析, 结果显示ChPerlucin的氨基酸序列与长牡蛎C-型凝集素超家族的同源性最高。Perlucin氨基酸序列中含有保守的半胱氨酸残基(图2), 这个基序对糖基的识别和Ca2+的结合有重要作用。

图2 香港牡蛎与其他物种ChPerlucin 氨基酸序列的多重比对保守的半胱氨酸位点以黑色五角星标记, 保守的EPN、WVD 位点以红色方框标出, 同色阴影部分表示相同部分, “---”代表氨基酸缺失。Gene Bank 序列号(NCBI): 香港牡蛎(MW666179); 长牡蛎(XP_011424364.2); 美洲牡蛎(XP_022310854.1); 巨海扇蛤(XP_033732131.1); 虾夷扇贝(XP_021347615.1); 海湾扇贝(ACS72239.1); 澳洲绿唇鲍(CBK19533.1); 盘鲍(ABO26595.1); 杂色鲍(AEQ16381.1); 菲律宾蛤仔(ACU83224.1); 海蜗牛(XP_012943835.2); 仿刺参(BBA19537.1); 线虫(XP_017112449.1); 人(sp|Q8IZS7.1|)Fig. 2 Multiple alignment of the putative amino acid sequences of ChPerlucin from Crassostrea hongkongensis with other organisms homologues. The conservative cysteine sites are marked with a black five-pointed star, and the conservative EPN and WVD sites are marked with a red box. The shaded part of the same color indicates the same part, and "---" represents the amino acid deletion. Gene Bank serial number (NCBI): Crassostrea hongkongensis(MW666179); Crassostrea gigas(XP_011424364.2); Crassostrea virginica(XP_022310854.1); Pecten maximus(XP_033732131.1); Mizuhopecten yessoensis(XP_021347615.1); Argopecten irradians(ACS72239.1); Haliotis laevigata(CBK19533.1); Haliotis discus discus(ABO26595.1);Haliotis diversicolor(AEQ16381.1); Ruditapes philippinarum(ACU83224.1); Aplysia californica(XP_012943835.2);Apostichopus japonicus(BBA19537.1); Drosophila elegans(XP_017112449.1); Homo sapiens (sp|Q8IZS7.1|)
2.3 ChPerlucin 氨基酸系统进化树分析
利用14 个物种的C-型凝集素氨基酸序列构建系统进化树, 结果显示香港牡蛎与长牡蛎(C. gigas)、美洲牡蛎(C.virg in ica)、巨海扇蛤(P.m a x i m u s)聚为一支, 区别于脊椎动物中的人(图3), 说明C-型凝集素基因在进化过程中相对保守。

图3 基于NJ 法构建的ChPerlucin 系统进化树黑色三角形表示香港牡蛎Fig. 3 Neighbor-Joining phylogenetic tree of ChPerlucin amino acid sequences. Black triangle represents Crassostrea hongkongensis
2.4 ChPerlucin 基因在不同胚胎发育时期的表达分析
ChPerlucin基因在香港牡蛎不同发育时期的表达丰度结果显示, 其在囊胚和担轮幼虫时期的表达量最高, 在原肠胚时期表达不高, 在D 形幼虫时期的表达量也较低(图4)。

图4 ChPerlucin 在不同胚胎发育时期的表达模式表达量数据为每个样品3 个重复的平均值±标准差, 不同的小写字母表示差异显著(P<0.05)Fig. 4 Expression pattern of ChPerlucin in different embryonic development stages. We show the mean ± standard deviation of three replicates, and use different lower-case letters to indicate significant differences (P<0.05)
2.5 ChPerlucin 基因的组织特异性表达分析
ChPerlucin基因在香港牡蛎不同组织中的表达丰度结果显示, 其在唇瓣、外套膜、性腺、闭壳肌、消化腺、鳃、心脏和血淋巴细胞中均有表达, 其中在唇瓣中的表达量最高, 其次是消化腺, 在外套膜、闭壳肌、血淋巴中的表达量较低(图5)。
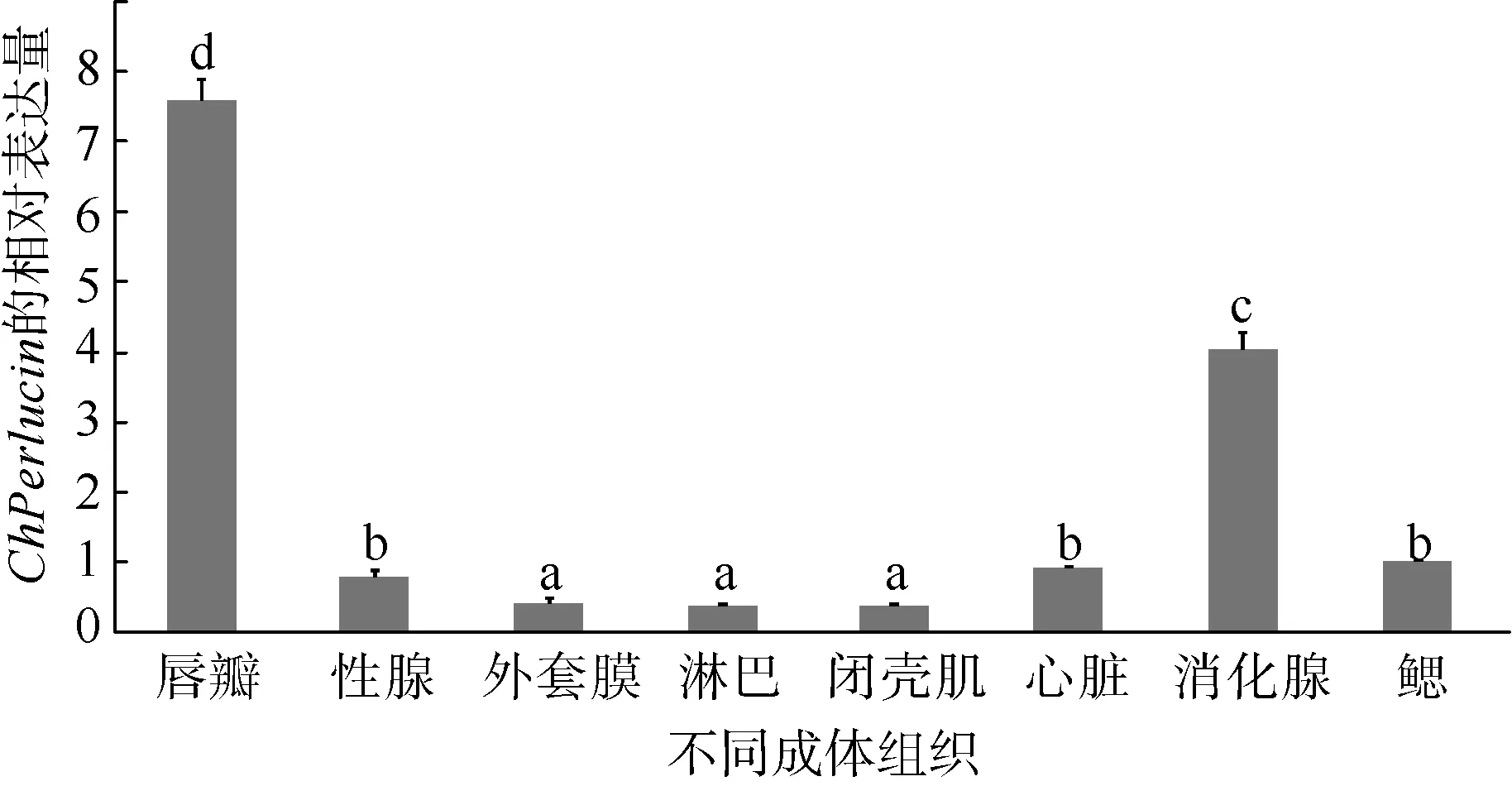
图5 ChPerlucin 在不同成体组织中的表达模式表达量数据为每个样品3 个重复的平均值±标准差, 不同的小写字母表示差异显著(P<0.05)Fig. 5 Expression pattern of ChPerlucin in different tissues. We show the mean ± standard deviation of three replicates, and use different lower-case letters to indicate significant differences (P<0.05)
2.6 ChPerlucin 基因在细菌感染下的表达模式
在溶藻弧菌(V. alginolyticus)感染 6h 后,ChPerlucin表达水平显著升高, 12h 达到最高, 与对照组(PBS)相比显著升高(P<0.01), 随着时间的增加,ChPerlucin表达量逐渐下降(图6a)。在溶血性葡萄球菌(S. haemolyticus)感染 6h 后,ChPerlucin开始显著上调并达到最高, 与对照组相比显著升高(P<0.05), 随着时间的增加,ChPerlucin的表达量逐渐下降(图6b)。

图6 ChPerlucin 在细菌感染下的表达模式表达量数据为每个样品3 个重复的平均值±标准差, 菌刺激下不同时间点的表达量均以对照(0h)的倍数表示, *代表与对照差异显著(P<0.05), **代表与对照差异极显著(P<0.01)Fig. 6 Expression profiles of ChPerlucin in hemocytes tissue under bacterial stress. We show the average ±standard deviation of three replicates. The expression levels at different times under bacterial stimulation are expressed as multiples of the control (0h), * represents a significant difference from the control (P<0.05), and ** represents the control difference is extremely significant (P<0.01)
2.7 ChPerlucin 蛋白的免疫印迹法验证
构建真核表达载体, 将重组质粒 pPIC3.5KChPerlucin线性化后电转至毕赤酵母(GS115)中。经过小量表达筛选, 挑选RDB+G418 平板阳性克隆,接种至YPG 液体中培养, 经甲醇诱导, 将上清蛋白进行镍柱亲和层析法纯化, 将洗脱液、穿透液、原液进行SDS-PAGE 凝胶电泳。转膜, 抗体孵育, 显色后显示有条带大小在18kD 左右(图7)。该结果与理论蛋白相对分子质量一致, 表明ChPerlucin 重组蛋白成功表达。

图7 ChPerlucin 蛋白的免疫印迹法验证M: 蛋白分子量标准(marker); 1: 洗脱液; 2: 穿透液; 3: 原液Fig. 7 ChPerlucin protein westernblot verification. M:marker; 1: eluent; 2: penetrating solution; 3: stock solution
2.8 ChPerlucin 真核表达与纯化
将摇瓶发酵的阳性菌株经甲醇诱导后, 用250mL STET 缓冲液重悬, 破酵母后离心保留上清,浓缩, 用镍柱进行纯化目标蛋白, 将纯化蛋白进行SDS-PAGE 凝胶电泳, 对照为pPIC3.5K 空载体转化的株, 检测纯化结果。可见目的条带大小与预测蛋白大小一致, 则表达成功(图8)。

图8 ChPerlucin 真核表达与纯化M: 蛋白分子量标准(marker); 1: 纯化蛋白; 2: 对照Fig. 8 ChPerlucin eukaryotic expression and purification.M: marker; 1: purified protein; 2: control
2.9 ChPerlucin 蛋白的抗菌活性
随着时间的延长, 阴性对照组的OD 值始终比实验组和阳性对照组要大, 说明ChPerlucin 蛋白和氨苄(Amp)起到了抑菌效果。在相同浓度下,ChPerlucin 蛋白抑菌能力弱于氨苄(图9)。

图9 ChPerlucin 蛋白的抗菌活性OD 数据是每个样品3 个重复的平均值±标准差, 不同的小写字母表示差异显著(P<0.05)Fig. 9 Antibacterial activity of ChPerlucin. We show the mean ± standard deviation of three replicates, and use different lower-case letters to indicate significant differences (P<0.05)
3 讨论
本实验获得香港牡蛎ChPerlucin基因cDNA 全长577bp, 包括5′末端非翻译区21bp、3′末端非翻译区73bp 和开放阅读框483bp(编码160 个氨基酸)。从半胱氨酸数量上看, C-型凝集素可分为两种: 1) 具有4 个半胱氨酸残基的“短型”; 2) 在N 端多出2 个形成二硫键的半胱氨酸残基的“长型”(王昊, 2006)。序列分析结果显示,ChPerlucin基因含有1 个钙离子结合的糖类识别结构域(CLECT)和6 个半胱氨酸残基, 该CLECT 结构域与王昊(2006)报道的栉孔扇贝体内的C-型凝集素超家族基因含有的CLECT 结构域相似, 因此它是牡蛎“长形”凝集素的一个新成员,同时也是一种Perlucin 蛋白。进一步比对氨基酸序列发现,ChPerlucin与长牡蛎Perlucin氨基酸序列相似性最高。从进化树可看出,ChPerlucin氨基酸序列与软体动物的Perlucin聚在一起, 人的C-型凝集素样蛋白单独聚为外支。
本研究中的ChPerlucin与其他动物的同源家族蛋白一样有着EPN 基序, 该基序可特异性识别甘露糖(Weis et al, 1998), 说明它具有与含甘露糖的病原结合的功能。在大鼠髓鞘碱性蛋白MBP-A 的C-型凝集素样蛋白的CTLD 结构域中, EPN 基序与单糖形成氢键并确定结合的特异性。因为CTLD 中所含的羰基侧链提供2 个Ca2+配位键, 可与单糖形成氢键, 因而可确定结合的特异性。在已知的半乳糖特异性的 CTLD 中, 结合基序为 QPD(Weis et al,1998)。已有研究证明, 在大鼠的MBP-A 中, 用半乳糖型QPD 序列替换MBP-A 中的EPN 序列, 可以将结合的特异性由甘露糖转换为半乳糖(Drickamer,1992)。同时,ChPerlucin的氨基酸序列还含有WVD基序, 这一基序与高等脊椎动物的WND 基序有所不同, 与日本沼虾的WTD 结合基序也不同(孙盛明等, 2019)。该基序是Ca2+结合位点, 也可识别甘露糖。不同的糖基结合位点可识别不同的糖基分子。初步推测, 海洋生物面对的病原多糖与陆生高等脊椎动物面对的病原多糖不同, 导致了两者的钙离子结合基序有差异。
实时荧光定量PCR 结果显示,ChPerlucin基因在多种组织中均有表达, 在唇瓣中表达量最高, 其次是消化腺(包含肝胰腺)。唇瓣是杯状细胞所在处,唇瓣上的纤毛和黏液在食物的分拣和运输中起重要作用。ChPerlucin基因在唇瓣和消化腺的高表达可能与牡蛎在摄食到外源多糖类物质时活化该器官的免疫机制有关, 这与前人发现的MBL 在海湾扇贝、虹鳟的肝脏和脾脏中表达量最高(Nakao et al, 2006;Kania et al, 2010; Zhang et al, 2012)的现象有部分重合(牡蛎的消化腺包含了肝胰腺)。在哺乳动物中,MBL 也主要在肝脏中合成。由此可见, 在面对病原体入侵时, 机体通过合成分泌抗体、凝集素等免疫蛋白来抵抗侵染。而肝脏在这一过程中承担了合成免疫因子(凝集素)的作用, 说明了肝脏在抵御微生物感染时承担着重要免疫器官的角色。ChPerlucin基因在鳃和血淋巴中亦有一定量的表达, 说明ChPerlucin基因也发挥着免疫作用, 但正常情况下其表达量不是很高。
贝类在囊胚至原肠胚时期, 其细胞分化会形成不同的胚层, 在担轮幼虫时期细胞分化频率高, 很快会进入到面盘幼虫阶段。在快速分化时期, 各种组织器官会在面盘幼虫阶段发育形成, 随之形成初步的免疫系统。伴随着幼虫的发育, 母体效应带来的免疫基因mRNA 逐渐消失, 幼虫开始表达自体的免疫基因(Tirapé et al, 2007; Yue et al, 2013a, b;Wang et al, 2015)。溶藻弧菌感染后, qPCR 结果显示ChPerlucin基因在血淋巴中于6h、12h 均上调表达;溶血葡萄球菌感染后,ChPerlucin基因在血淋巴中于6h 上调表达。这表明ChPerlucin基因参与了免疫应答。
本文成功构建了pPIC3.5K-ChPerlucin真核表达载体, 并高效诱导表达了ChPerlucin 重组蛋白,在抑菌试验中也证明了其具有抑菌活性。有研究表明, 在斑节对虾中存在C-型凝集素蛋白, 其重组蛋白rLvPLP3 可与金黄色葡萄球菌、副溶血弧菌结合(Bi et al, 2020); 人的甘露聚糖结合凝集素(mannan-binding lectin, MBL)能够与白色念珠菌、新隐球菌结合(Neth et al, 2000); 中华白对虾的C-型凝集素蛋白FcLec1 能够破坏细菌的细胞壁, 会抑制细菌和真菌的生长(刘逸尘 等, 2012); 中华绒螯蟹的C-型凝集素重组蛋白rEsLecD 对大肠杆菌、金黄色葡萄球菌有杀菌效果(方紫妍, 2016)。本文通过溶藻弧菌的抑菌实验表明,ChPerlucin 蛋白具有抑菌功能。牡蛎的甘露糖结合蛋白也表现出了和其他物种C-型凝集素相似的抑菌功能, 这一结果充分说明了甘露聚糖结合蛋白在香港牡蛎天然免疫防御中发挥着重要作用。
先天免疫的作用是保护自身免受病原侵袭的重要防线, 牡蛎甘露聚糖结合蛋白的发现, 丰富了人们对牡蛎的先天免疫系统的认识, 进一步阐释了牡蛎面对外来病原体入侵的分子机制, 因此对牡蛎养殖的水产病害研究具有积极意义。
