挤压温度对大豆分离蛋白与原花青素复合物结构和功能特性的影响
2022-02-16王振国高育哲时家峰张俊杰江睿生霍金杰肖志刚
王振国,高育哲,时家峰,张俊杰,江睿生,霍金杰,苏 爽,肖志刚
挤压温度对大豆分离蛋白与原花青素复合物结构和功能特性的影响
王振国,高育哲,时家峰,张俊杰,江睿生,霍金杰,苏 爽,肖志刚※
(沈阳师范大学粮食学院,沈阳 110034)
为了探究不同挤压温度(40、60、80、100和120℃)对大豆分离蛋白(Soy Isolate Protein,SPI)与葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)复合物功能性质及结构特性的影响。该研究以溶解度、乳化性、乳化稳定性、-电位、粒度为指标,利用荧光光谱、红外光谱分析该复合体系中大豆分离蛋白功能性质及结构的变化。结果表明:相较于挤压SPI,经过挤压处理的SPI-GSPE复合物的溶解度、乳化活性指数、乳化稳定性指数、-电位绝对值及持水性均显著提高(<0.05),其表面疏水性、持油性显著下降(<0.05)。随着挤压温度的升高,SPI-GSPE复合物的溶解度、持油性及乳化活性均先增大后减小且在80℃达到最大值,而其表面疏水性先减小后增大且最小值在80℃,-电位绝对值、乳化稳定性及持水性均随温度的升高而降低。粒径分析结果表明,挤压处理后SPI与GSPE形成了更加致密的复合物;荧光光谱及红外光谱结果表明,与GSPE的复合及挤压处理使SPI氨基酸残基所处微环境发生变化,蛋白结构发生变化。以上结果表明挤压温度为80℃时SPI-GSPE复合物功能性质提高幅度最大,为GSPE与SPI复合提高SPI的功能性质提供参考。
挤压;结构特性;功能特性;原花青素;大豆分离蛋白
0 引 言
大豆分离蛋白是一种全价蛋白,经低温脱脂豆粕加工而成。其主要组分为甘氨酸和-伴球蛋白。甘氨酸由一个酸性亚基和一个碱性亚基组成,由一个二硫键连接。-伴球蛋白由′3种亚基构成[1]。大豆分离蛋白(Soy Isolate Protein,SPI)具有一系列功能特性,如溶解度、乳化性、持水性等,目前已被广泛地应用于食品加工[2]。原花青素是自然界中发现的一种多酚,是一类含有双黄酮衍生物的天然多酚化合物的总称[3]。葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)来源于葡萄籽由黄烷-3-醇通过C-C键或CO-C键聚合而形成,因其具有的生物活性而被广泛研究。酚类化合物与蛋白质的相互作用可能导致蛋白质的结构及功能性质发生变化,如溶解度、热稳定性和乳化性。
目前,蛋白质和多酚的复合作用日益受到重视。一些研究人员发现,蛋白质与多酚之间的复合作用会导致蛋白质结构性质的改变。Hasni[4]研究发现酚类化合物与蛋白通过亲水和疏水相互作用结合。Relkin等[5]研究表明酚类化合物分散在中性水溶液中会与蛋白质结合,从而降低蛋白质的溶解度。在Rawel等[6]研究中发现酚类化合物与蛋白质的反应可引起蛋白质的交联。蛋白质的二级和三级结构发生变化,分子的表面性质受到影响,使其具有亲水性。Tsai等[7]观察到超氧化物歧化酶(Superoxide Dismutase, SOD)与酚类化合物相互作用后热稳定性增加,并且随着加工温度的提高两者结合能力越强。
挤压技术是一种物理改性技术,它集成了多个单元操作,如物料混合、均质化、蒸煮和成型[8]。它具有改善食品材料功能特性的能力。分子变化的激活和化学键的建立导致功能特性的改变。在挤压过程中,蛋白质通过机械和热能的协同作用,失去了其固有的、有组织的结构,导致蛋白质变性[9],其构象发生变化。尽管挤压技术在工业上已经成熟使用,但是挤压对蛋白质功能性的研究及应用尚未得到充分理解。目前食品营养成分相互作用引起了研究者的广泛关注,但是对于多酚与蛋白相互作用的研究主要集中在湿热条件下,且鲜见涉及在挤压体系下多酚与蛋白的相互作用。同时考虑到蛋白质和酚类物质对人类健康、食品营养和质量等方面的重要作用。因此本试验探究了在挤压体系内挤压温度对大豆分离蛋白与葡萄籽原花青素复合物(Soy Isolate Protein -Grape Seed Proanthocyanidin Extract,SPI-GSPE)的溶解性、乳化活性、持水性等功能性质和结构的影响,以期了解两者之间相互作用后功能性质及结构的变化,拓宽大豆蛋白食品的应用范围(如植物基素肉),为生产功能型SPI-GSPE复合产品提供理论依据。
1 材料与方法
1.1 材料与试剂
原花青素,苏州天恒生物;大豆分离蛋白,哈尔滨高科技术有限公司;氯化钠、氢氧化钠、Tris、甘氨酸冰乙酸、8-苯氨基-1-萘磺酸(8-Anilino-1-Naphthalenesulfonic Acid,ANS)、浓盐酸,天津市永大化学试剂有限公司;十二烷基硫酸钠(Sodium Dodecyl Sulphate,Ammonium Persulfate,SDS),麦克林化学试剂有限公司。其他化学试剂均为分析纯。
1.2 仪器与设备
电子分析天平,上海舜宇恒平科学仪器有限公司;离心机,美国贝克曼库尔特公司;小型超微粉碎机,广州旭朗机械设备有限公司;ULTRA TURRAX®高速分散机及磁力搅拌器,德国IKA公司;UV1800-型紫外分光光度计,上海美普达仪器有限公司;Zetasizer Nano ZS90分子粒度和Zeta电位分析仪,英国Malvern公司;分光光度计,上海元析仪器有限公司。DS56-Ⅲ双螺杆挤出机,济南赛信膨化机械有限公司;BT-100SD电磁加水泵,中国上海嘉鹏科技有限公司;冷冻干燥机,松原华兴科技发展有限公司;AVATAR 370FT-IR 红外光谱仪,德国布鲁克公司。
1.3 试验方法
1.3.1 样品制备
挤压试验在双螺杆食品挤压机中进行,如图1所示。将SPI与 GSPE按质量比(w/w)为16:1(4%)制备基料,对该基料及天然SPI分别在5种不同的挤压温度下进行处理:40、60、80、100、120 ℃,双螺杆挤出机的挤出参数设置为:进料速度8 kg/h,螺杆速度250 r/min。采用电磁加水泵以8.54 L/h的输入速率向挤压机中加水,并使各桶区含水率保持在55%。挤出机有10个独立的加热区。在本试验中,第一区至第五区机筒温度保持25 ℃不变,采用五区进料,将第六至第十区筒体挤压温度同时设置为40、60、80、100、120 ℃。挤压后获得5种挤压温度的试样,在冷冻干燥机中冻干18 h,并研磨过80目筛(直径=0.178 mm)进行下一步试验(以上挤压机参数及多酚添加量均根据前期预试验所得)。
1.3.2 SPI、SPI-GSPE复合物指标的测定
1)溶解度的测定
配置0.01g/mL蛋白溶液10 mL并通过磁力搅拌1.5 h,然后在7 000 r/min离心20 min,通过双缩脲法测得上清液中蛋白质质量。蛋白质的溶解度按下式计算:

1.发动机 2.变速箱 3.喂料口 4.注水口 5.螺杆 6.加热区 7.模头区
1.Motor 2.Gearbox 3.Feeding zone 4.Water filling nozzle 5.Screw 6.Heating zone 7.Die zone
图1 挤压机示意图
Fig.1 Schematic diagram of extruder
2)乳化性及乳化稳定性的测定
根据文献[10]的方法稍作修改,配置2 mg/mL SPI溶液30 mL,加入10 mL大豆油混匀。使用高速分散机在10 000r/min转速下均质1min后,立即和10 min后取溶液底部的40L乳液,将其加入5 mL质量分数为0.1% SDS溶液中,混合均匀,使用分光光度计测定波长为500 nm处的吸光值,分别记为0和1。乳化活性指数(Emulsifying Activity Index,EAI)及乳化稳定性指数(Emulsion Stability Index,ESI)按下式计算:
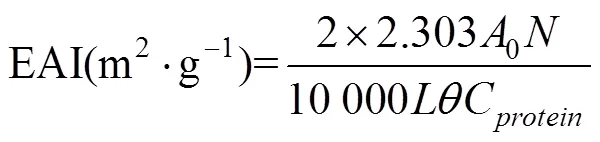
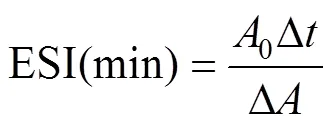
式中为稀释倍数;为油脂占总数的比例;为光路长度,cm;C为蛋白质浓度,g/mL;0为初始吸光值;为间隔时间,min;为吸光度差值。
3)持水性的测定
采用文献[11]的方法稍加修改,配置20 mg/mL SPI溶液10 mL,蛋白与离心管总质量记为1(g)。涡旋震荡1 min后进行7 000 r/min离心10 min,用滤纸将离心管上层的水吸出,离心管及剩余沉淀总质量记为2(g)。持水性按下式计算:
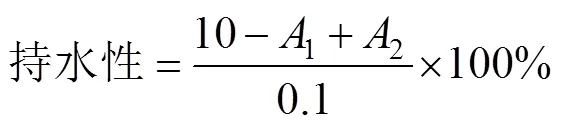
4)粒度及-电位
用去离子水配置10 mL质量分数为0.01%的蛋白溶液,磁力搅拌0.5 h,通过分子粒度仪及Zeta电位分析仪对蛋白粒度大小分布及-电位进行测定。
5)表面疏水性
依据Shi等[12]的方法并适当修改,8 mmol/L ANS贮备液和10 mg/mL蛋白溶液均用磷酸盐缓冲液(0.1 mol/L,p H值7.0)制备。蛋白溶液在8 000 r/min离心10 min,蛋白浓度按梯度稀释为0.005~0.500 g/L之间,将50L ANS与5 mL多酚蛋白混合物溶液混合均匀。设置荧光光谱的测定条件:激发波长及发射波长分别设为390 nm和470 nm,狭缝5 nm,扫描速率20 nm/s。表面疏水性指数是通过计算荧光指数相对于蛋白浓度的初始斜率而获得的。
6)持油性的测定
采用文献[13]的方法并加以修改,称取0.1 g大豆分离蛋白装入50 mL离心管中,离心管及蛋白总质量记为1(g)。向离心管中加入5 mL的色拉油,充分混合均匀后,在4 000 r/min离心15 min,将上层清液倒出,并将附着在离心管壁内外的所有油滴擦拭干净后,记录此时离心管及剩余沉淀的总质量为2(g)。持油性按以下公式计算:
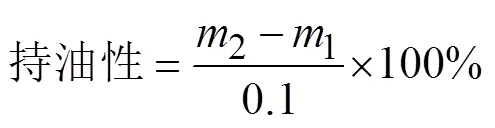
7)二级结构的测定
将完全干燥的样品与溴化钾粉末按照1:100的比例均匀混合后,经玛瑙研钵研磨后进行压片处理,光谱记录在400~4 000 cm-1的范围内,扫描次数32次。使用Peakfit Version 4.12 软件进行分析,对酰胺Ⅰ带(1 700~1 600 cm-1)处进行二阶导数拟合,计算蛋白的二级结构。
8)荧光光谱的测定
使用荧光分光光度计对蛋白的荧光光谱进行测定。将蛋白进行适当稀释。设置荧光光谱的测定条件:激发波长及扫描波长分别为290 nm,300~500 nm,狭缝宽为5 nm。
1.4 数据处理
采用IBM SPSS Statistics 25软件进行数据处理,PeakFit v4.12软件进行红外拟合,Origin 2021软件作图。
2 结果与分析
2.1 溶解度
溶解度是蛋白质最重要的性质之一,它对其他功能特性有直接影响。表1为挤压温度(40、60、80、100和120 ℃)对SPI及SPI-GSPE复合物溶解度的影响。挤压后SPI的溶解度显著降低(<0.05)。这可能是由于蛋白质的疏水基团之间热诱导形成不溶性聚集体[14]。当挤压温度从40 ℃升至80 ℃时,SPI及SPI-GSPE溶解度均增加。这可能是由于蛋白质在挤压机作用下,蛋白质分子展开及二硫键的断裂使蛋白质与水的相互作用增强。80 ℃后,SPI及SPI-GSPE溶解度均显著降低(<0.05),这可能是由于SPI中的蛋白组分在高温高压高剪切的处理下,甘氨酸的碱性亚基与-伴球蛋白的-亚基之间形成了难以溶解的聚集体,这降低了蛋白的溶解度。Silva等[15-16]也有相关研究也得出类似结论。

表1 不同挤压温度下SPI及SPI-GSPE复合物溶解度
注:样品1为大豆分离蛋白(Soy Isolate Protein,SPI)。样品2为大豆分离蛋白与葡萄籽原花青素复合物(Soy Isolate Protein -Grape Seed Proanthocyanidin Extract,SPI-GSPE)。字母a、b、c…为不同挤压温度下及未挤压SPI或SPI-GSPE显著性分析结果,*为挤压后SPI及SPI-GSPE复合物组间有显著差异(<0.05)(下同)
Note: Sample 1 was Soy Isolate Protein (SPI). Sample 2 was Soy Isolate Protein-Grape Seed Proanthocyanidin Extract (SPI-GSPE).The letters a, b, c... is the significant analysis results of SPI or SPI-GSPE at different extrusion temperatures and without extrusion, * is the difference between groups of SPI and SPI-GSPE complex after extrusion (<0.05) (the same below).
由表1可知,不同温度下,较挤压SPI,SPI-GSPE复合物蛋白溶解度显著提高(<0.05)。这可能是由于GSPE与SPI疏水基团作用,且原花青素分子上的羟基一部分与水形成氢键,间接增强了大豆分离蛋白的水合作用,故而在一定程度上增大了溶解度。胡湘蜀[17]也报道了茶多酚可提高SPI的溶解性。
2.2 乳化性
乳化活性指数(Emulsifying Activity Index,EAI)和乳化稳定性指数(Emulsion Stability Index,ESI)分别代表了蛋白质在油水界面形成和稳定乳化液的能力,这对各种传统食品和新型食品的开发至关重要。由图2可知,挤压后SPI及SPI-GSPE复合物的EAI高于未挤压SPI。随挤压温度的增加,SPI的EAI增加。SPI-GSPE复合物的EAI在挤压温度40~80 ℃随着温度的升高而增加。这可能是因为蛋白质虽经过挤压后溶解度下降,但是乳液制备过程中均质施加的机械力破坏了分子间相互作用,并暴露了蛋白质表面下的疏水基团。蛋白质表面活性得到了提高,从而导致EAI的提升[18]。此后随着温度的升高(80~120 ℃),SPI-GSPE复合物EAI降低,这可能是由于GSPE在高温下部分降解,从而导致其EAI下降。李明月[19]研究表明,过高的温度可使原花青素氧化聚合从而导致其含量降低。
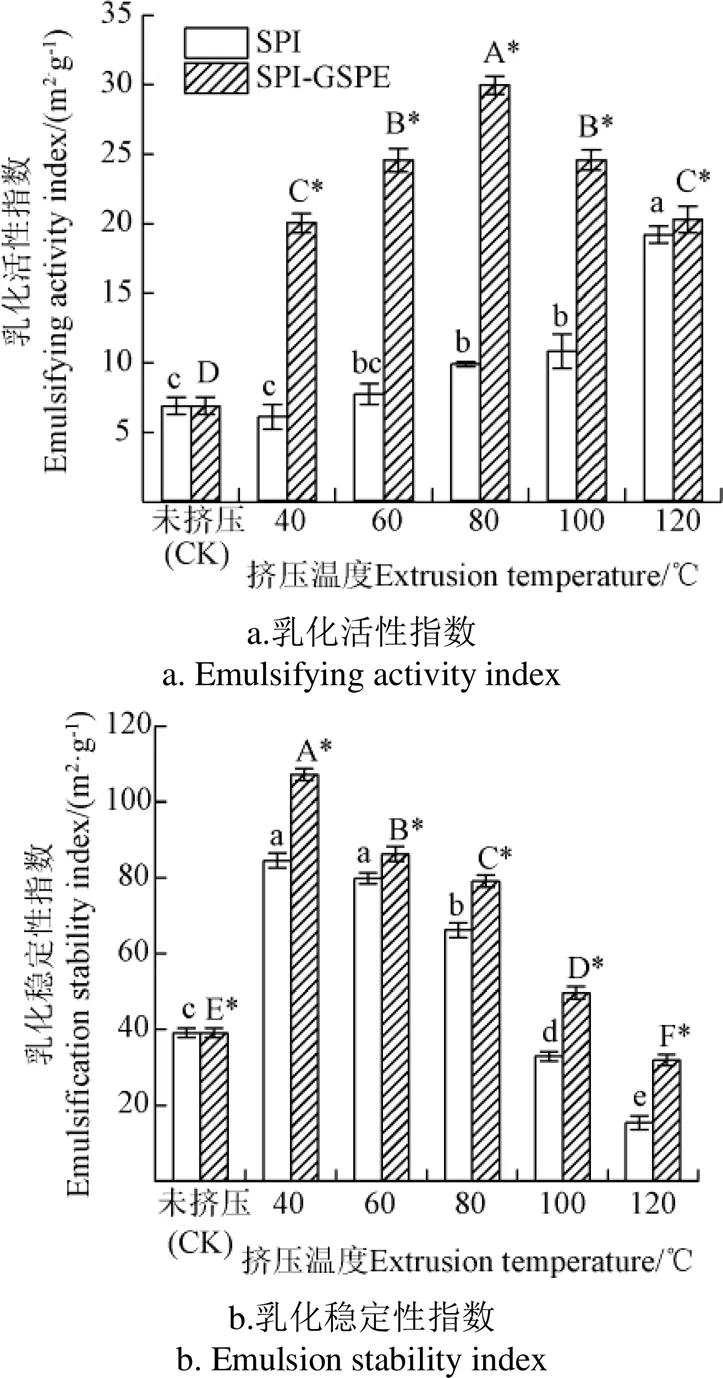
注:大写字母A、B、C…为不同挤压温度下SPI-GSPE显著性分析结果(下同)(P<0.05)。
由图2可知,挤压SPI的ESI高于未挤压SPI,这可能是由于挤压及均质对蛋白结构造成破坏而暴露出的疏水基与油性物质交联可形成脂肪球,而亲水基和水分子结合包裹在脂肪球表面可以提高乳液的稳定性。随着温度的提高,SPI及SPI-GSPE复合物ESI显著降低(< 0.05)且挤压SPI于100℃后低于未挤压蛋白,这可能是因为热能输入和机械剪切破坏了蛋白质结构,导致蛋白质变性和展开,从而形成小分子肽和游离氨基酸[20]。已知较小的肽在稳定乳液方面的效率较低,因为由于电荷排斥和表面疏水性,肽可能不容易团聚产生脂肪球膜。挤压过程中形成的较小肽被认为是ESI降低的主要原因。
由图2所示,SPI的EAI和ESI均通过与GSPE结合而显著增加(<0.05),这可能是由于SPI与GSPE结合后,蛋白的构象和界面行为发生了改变。Karefyllakis等[21]也发现,酚类化合物对蛋白质的界面和乳化特性有积极的影响。这可能是由于随着GSPE的加入,界面膜的表面压力和粘弹性被增强,导致界面膜更加稳定,从而增加了SPI-GSPE复合物的EAI及ESI。
2.3 表面疏水性
表面疏水性定义为非极性基团与极性溶液在蛋白质表面接触的数量。未挤压SPI的表面疏水性指数(0)(<0.05)显著低于挤压SPI(图3)。这可能是由于挤压过程中,SPI在高压和高剪切力作用下暴露出一些疏水性氨基酸残基,从而导致其表面疏水性增加[22]。随着挤压温度的升高,0先降低后升高,这可能是由于挤压时蛋白质通过疏水相互作用而聚集,从而使疏水点大部分被限制在聚集物内部。在80 ℃达到最低值,之后随着温度的升高而升高。这一趋势反映了在较高温度条件下,挤压过程可能导致聚集物或蛋白质发生部分解离现象。如图3所示,不同温度下,SPI-GSPE复合物的0值相较于SPI显著降低(<0.05)。这可能是由于GSPE与SPI的相互作用引起了蛋白的结构改变,蛋白内部的部分亲水区域暴露,从而导致蛋白的疏水性降低。Nguela等[23]研究中也有相似结论。
2.4 挤压热处理对SPI-GSPE复合物ζ-电位的影响
-电位代表了蛋白质分散稳定性,其绝对值越高表明该体系越稳定。所有样品的-电位(表面电荷)值如图4所示,挤压处理显著降低了SPI表面电荷绝对值(<0.05),且随着温度的升高而降低;这表明SPI在挤压过程中发生的变性导致了分子表面负电荷基团的减少,从而降低了-电位绝对值。除120 ℃外,随着GSPE的加入,蛋白的-电位绝对值显著提高(<0.05),表明SPI和GSPE形成了表面有更多的阴离子基团的复合物,SPI-GSPE具有较强的物理稳定性,因为SPI与GSPE之间较强的静电斥力会抑制它们的聚集和沉降[24]。
2.5 粒径
蛋白质粒径的大小对蛋白功能性质至关重要。图5表明,经过挤压处理后SPI的曲线向右侧移动,挤压后蛋白粒径提高且随着温度的提高而增大(40~80 ℃),这可能是由于蛋白质的疏水基团之间热诱导形成聚集体,然后在80 ℃团聚。随着温度的继续升高,由于蛋白质的分解和降解,颗粒尺寸减小[25]。可以观察到,在不同温度下加入GSPE后,SPI-GSPE复合物粒径相较于挤压后的SPI显著降低(<0.05)。这可能是由于SPI与GSPE相互作用的增强。挤压热处理导致蛋白质结构的变性和重排,暴露了隐藏的疏水氨基酸残基,并解开了多肽链,从而大大加强了SPI与GSPE的相互作用,形成了更加致密的复合物[26]。
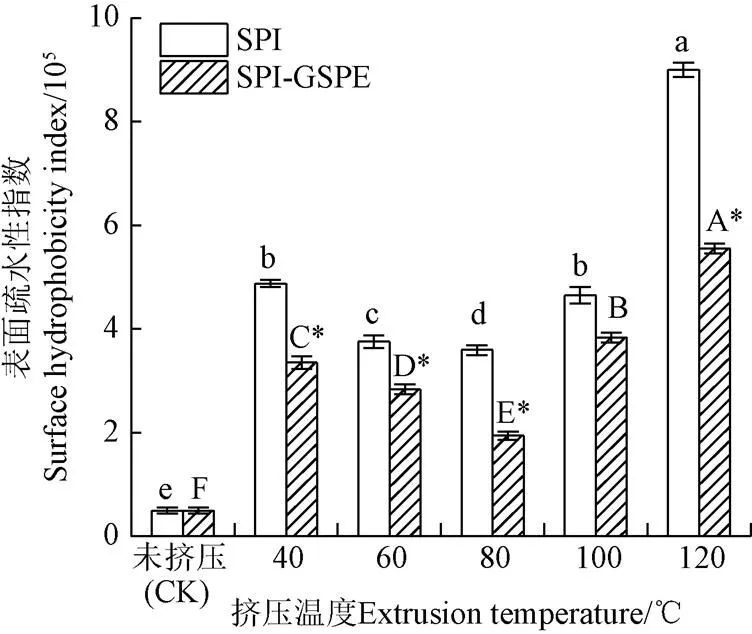
图3 不同挤压温度下SPI及SPI-GSPE复合物疏水性
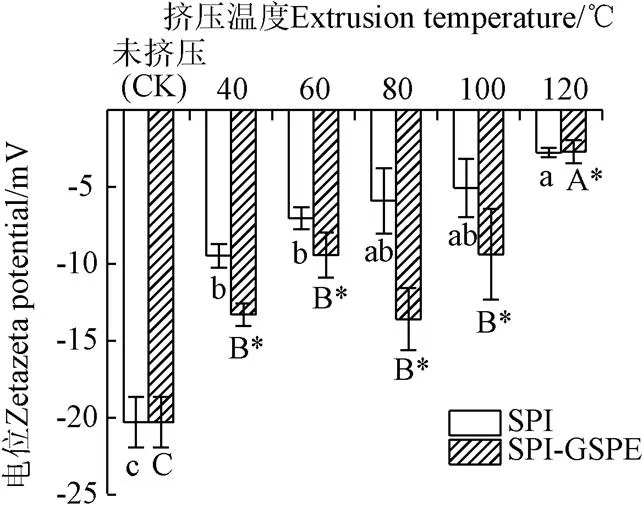
图4 不同挤压温度下SPI及SPI-GSPEζ-电位
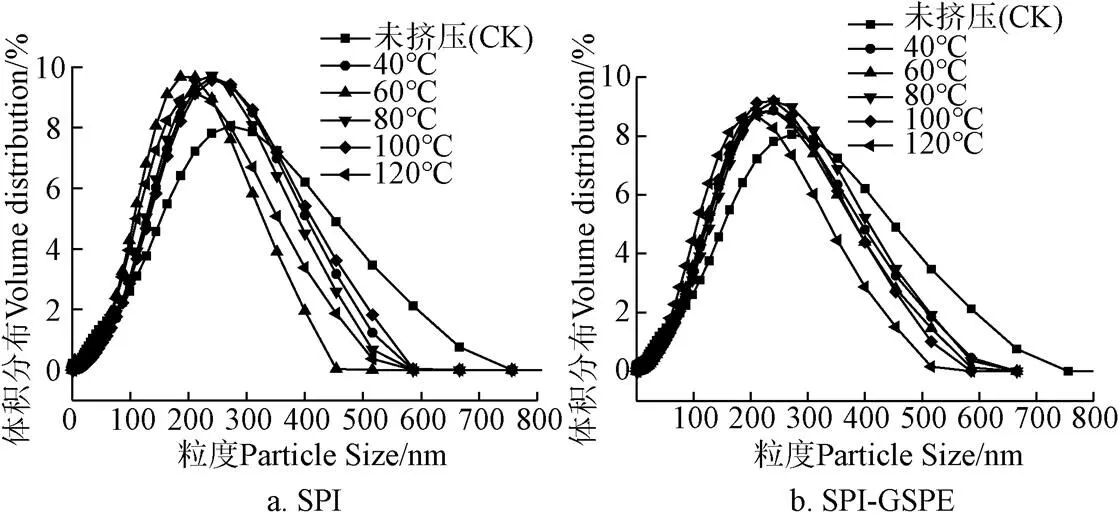
图5 不同挤压温度下SPI及SPI-GSPE粒径分布
2.6 持水性及持油性
图6显示了不同挤压温度(40、60、80、100和120 ℃)下SPI和SPI-GSPE的持水性。随着挤压温度的升高,SPI及SPI-GSPE复合物的持水能力均降低。这可能是由于蛋白经过挤压处理后,其疏水基团暴露导致水结合位点减少,持水性降低[27]。与SPI相比,随着GSPE的加入,蛋白的持水性显著提高(<0.05),这可能是由于GSPE的活性基团通过氢键和疏水键等非共价键与SPI连接,形成可溶性的聚集体,氢键和范德华力的相互作用力可以使水分子进入蛋白内部,从而SPI的持水性得到提高[28]。
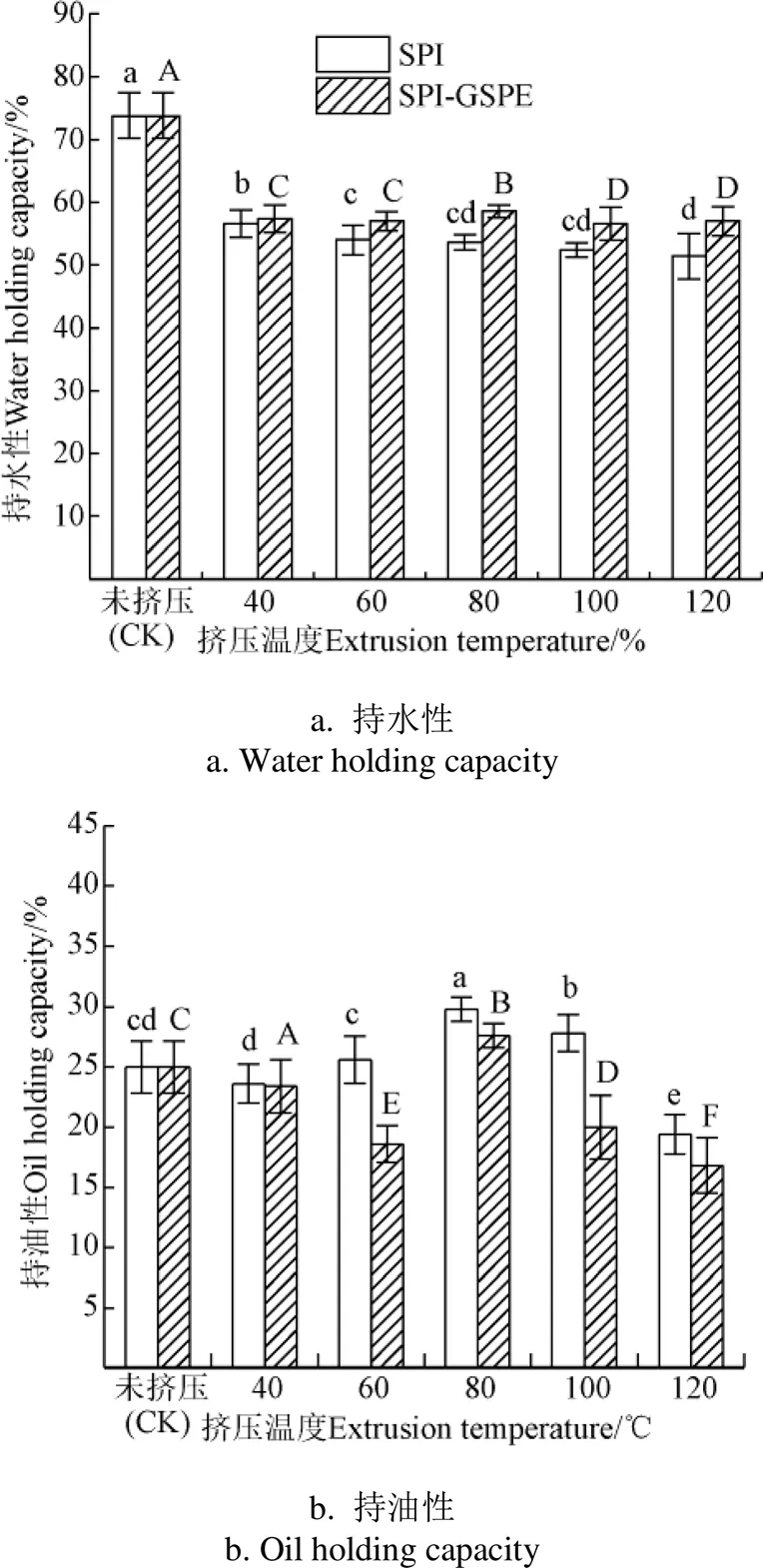
图6 不同挤压温度下SPI及SPI-GSPE持水性及持油性
持油性在食品加工中的应用也是重要的指标。图6显示的是不同挤压温度对SPI的持油性的影响。SPI挤压后持油性变化不大。随着温度的升高,挤压SPI持油性先升高后降低,并在80 ℃时达到最大值。这可能与亲脂性位点的增加有关。经过挤压处理后,蛋白质的结构遭到破坏,导致溶剂接触环境的极性表面所不能接触到的部位暴露。露出的疏水基团能与更多脂肪相互作用,因此増加了蛋白质的持油性[29]。温度在80 ℃后,持油性的降低可能归因于新的分子间键、结构和不溶性蛋白质复合物的形成。加入GSPE后,除40 ℃和80 ℃外,其余温度下蛋白持油性均显著下降(<0.05),这可能是由于随着SPI与GSPE的相互作用,两者形成不可溶复合物,蛋白与脂质结合能力下降,蛋白持油性下降[30]。
2.7 荧光光谱
蛋白质其色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基,被认为具有固定的发射荧光。激发波长为280 nm时,可以忽略苯丙氨酸。图7为不同挤压温度下SPI的内源荧光光谱和最大吸收波长(max)。max与色氨酸残基所处微环境有关,max大于330 nm表明色氨酸残基暴露于蛋白质分子外部的极性环境中,max越大色氨酸残基的微环境极性越强[31]。
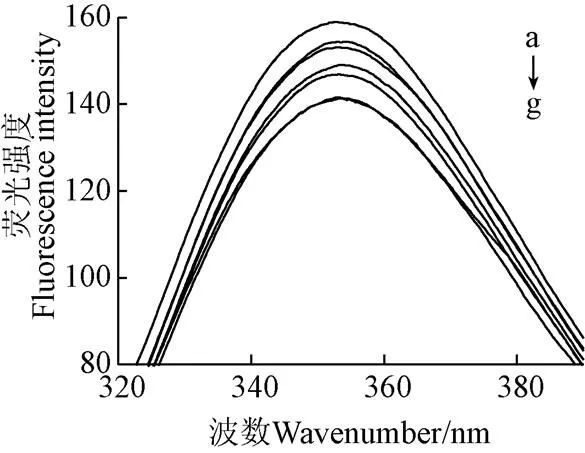
注:a为挤压温度为80 ℃的SPI-GSPE复合物,b→f分别为挤压温度为80、60、100、120、40 ℃的SPI,g为未挤压SPI。
未经挤压处理的SPI表现出最低水平的荧光强度。温度处于40 ℃时,SPI荧光强度与未挤压SPI无显著性差异,随着挤压温度的提高(40~80 ℃),荧光强度呈现升高的趋势,并使得SPI的max从353.2 nm红移至354.5 nm,这表明色氨酸残基周围环境趋于极性,同时使SPI三级结构变的松散。这可能是由于经过挤压处理后,蛋白质结构被破坏。随着温度的升高(80~120 ℃),荧光强度呈现下降的趋势,且max蓝移1.4 nm至353.1 nm。这可能是由于在高温高剪切的作用下,蛋白的空间结构更紧密,发色基团被掩埋。如图7所示,在80 ℃时,随着GSPE的加入,蛋白质最大发射峰max发生轻微蓝移,使其从354.5 nm蓝移至353.4 nm,这意味着蛋白中荧光团残基的周围环境在加入GSPE后变得普遍趋于非极性,即GSPE对蛋白构象产生了一定的影响。Li等[32]发现原花青素会导致牛血清蛋白荧光光谱蓝移,与本试验结果一致。
2.8 红外光谱
利用FT-IR进一步表征不同挤压温度对SPI及SPI-GSPE复合物的二级结构影响(图8)。酰胺I带和酰胺II带的光谱位移代表着蛋白质二级结构的改变,酰胺A(3 600~3 300 cm-1)位置的峰强度通常可以表示SPI分子内部及其分子间-H、O-H、C-H键伸缩振动的强度[33]。随着温度不断升高(40~80 ℃),在2 932 cm-1位置的峰呈现震动,这说明挤压热处理对SPI分子内的C-H 键产生了一定的影响。当挤压温度达到80 ℃时,可以看到波数在3 000 cm-1左右发生明显变化,该区主要为C-H伸缩振动区,表明当挤压温度达到80 ℃时,蛋白质开始发生变性。除此之外,酰胺A带(3 300 cm~3 400 cm-1)伸缩振动也可用于佐证蛋白质与多酚结合后复合物二级结构的变化。酰胺Ⅰ带(1 700~1 600 cm-1)可以体现蛋白二级结构的改变。研究表明[34],蛋白质二级结构与各吸收峰间波数的对应关联为:-螺旋:1 646~1 664 cm-1;-折叠:1 615~1 637 cm-1和1 682~1 700 cm-1;-转角:1 664~1 681 cm-1;无规卷曲:1 637~1 645 cm-1。如图8所示,随着GSPE的添加,SPI酰胺I带(1 700~1 600 cm-1)的吸光度下降,并且其红外吸收峰发生蓝移,这表明SPI通过与GSPE的相互作用使蛋白的二级结构发生了改变。

注:a为未挤压SPI、b→f分别为挤压温度在120、100、80、40、60 ℃的SPI。
同时计算得出蛋白质二级结构不同种类的含量,结果见表2。
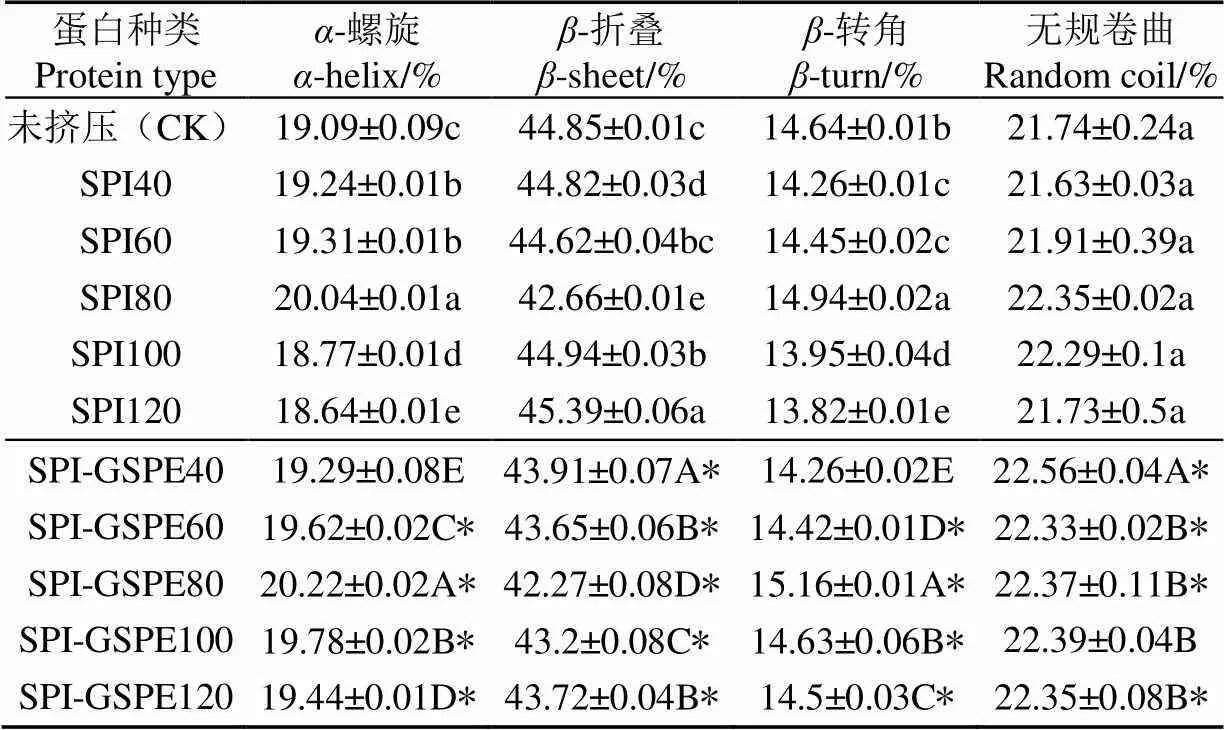
表2 SPI及SPI-GSPE复合物的二级结构含量
注:SPI40为挤压温度40 ℃下的SPI;*为挤压后SPI及SPI-GSPE复合物组间有差异性。
Note: SPI40 is SPI at extrusion temperature of 40 ℃; * is SPI after extrusion and SPI-GSPE complex has differences among groups.
数据表明,SPI的二级结构主要是以-折叠为主,这与Plietz等[35]研究结果一致。蛋白二级结构经过不同挤压温度处理后,各成分含量有明显变化。在第一阶段(40~80 ℃)螺旋、-转角及均呈现增加的趋势,且于80 ℃达到最大值,-折叠呈现递减的趋势,无规卷曲变化不大。表明-折叠结构转化为-螺旋及-转角结构。李杨等[36]研究80 ℃以上处理SPI也得出相似结论。随着温度的提高(80~120 ℃),-螺旋及-转角结构呈现降低的趋势,而-折叠呈上升趋势,这可能是由于SPI全部变性,其他二级结构转变为-折叠结构,而-折叠结构含量反映了蛋白疏水位点的暴露程度[37]。
如表2所示,与挤压SPI相比,所有添加GSPE样品的SPI的二级结构含量都发生了改变,其中-螺旋、无规则卷曲及-转角含量显著升高(<0.05),可能是由于GSPE与SPI间的氢键作用引起的。
3 结 论
本试验探究了挤压热处理SPI与SPI-GSPE复合物对蛋白结构与功能性质的影响。结果表明:
1)相较于未挤压大豆分离蛋白(Soy Isolate Protein,SPI),挤压SPI的乳化活性指数(EmulsifyingActivity Index,EAI)、表面疏水性及粒径均显著提高(<0.05),其溶解度、-电位绝对值、持水性显著下降(<0.05),SPI乳化稳定性指数(Emulsion Stability Index,ESI)经过挤压处理后显著提升,但当温度超过80 ℃时,SPI的ESI低于未挤压SPI。
2)不同温度下,葡萄籽原花青素(Grape Seed Proanthocyanidin Extract,GSPE)的加入使得挤压热处理SPI的-电位绝对值增大,复合物粒径变小,EAI、ESI、持水性及溶解度增强,但表面疏水性、持油性有所下降。
3)随着温度升高(40~80 ℃),SPI-GSPE复合物的溶解度、EAI、粒径显著增大(<0.05),其ESI、表面疏水性、及-电位绝对值显著减小(<0.05),当温度进一步升高(80~120 ℃),SPI-GSPE复合物表面疏水性显著增大(<0.05),其EAI、ESI、溶解度、-电位绝对值、粒径、及持油性均显著降低(<0.05)。
4)荧光光谱结果表明与GSPE的复合使得蛋白质内部结构中的发色基团所处的微环境极性提高,蛋白结构发生变化。
5)红外光谱结果显示随着GSPE的加入,蛋白-螺旋、-转角及无规卷曲含量均提高,SPI与GSPE在挤压过程中通过疏水相互作用结合。随着挤压温度的升高,螺旋、-转角至80 ℃达到最大值。-折叠结构转化为-螺旋及-转角结构。以上结果表明挤压温度达到80 ℃时,结构和功能性质较好。本研究结果阐明了不同挤压温度对SPI-GSPE复合物功能性质及结构影响,为进一步改善SPI的功能性质,使其更好地应用于食品工业生产提供了一定的理论基础。
[1] Rani P, Yu X, Liu H, et al. Material, antibacterial and anticancer properties of natural polyphenols incorporated soy protein isolate: A review[J]. European Polymer Journal, 2021, 152:110494.
[2] 江连洲,杨宗瑞,任双鹤,等. 空化射流对大豆分离蛋白结构及乳化特性的影响[J]. 农业工程学报,2021,37(3):302-311.
Jiang Lianzhou, Yang Zongrui, Ren Shuanghe, et al. Effect of cavitation jet on structure and emulsification properties of soybean protein isolate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(3): 302-311. (in Chinese with English abstract)
[3] Qi Q, Chu M, Yu X. Anthocyanins and proanthocyanidins: Chemical structures, food sources, bioactivities, and product development[J/OL]. Food Reviews International, [2022-09-10], https://doi.org/10.1080/87559129.2022.2029479
[4] Hasni I, Bourassa P, Hamdani S, et al. Interaction of milk-and-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2): 630-639.
[5] Relkin P, Shukat R. Food protein aggregates as vitamin-matrix carriers: Impact of processing conditions[J]. Food Chemistry, 2012, 134(4): 2141-2148.
[6] Rawel H M, Czajka D, Rohn S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(34): 137-150.
[7] Tsai P J, She C H. Significance of phenol- protein interactions in modifying the antioxidant capacity of peas[J]. Journal of Agricultural and Food Chemistry, 2006, 54(22): 8491-8494.
[8] Yu X, Zhang J, Wang L, et al. Changes in physicochemical properties and structural characteristics of rice starch during extrusion processing: The role of glutelin and different extrusion zones[J]. Innovative Food Science & Emerging Technologies, 2022, 82: 103163.
[9] Toro-Uribe S, López-Giraldo L J, Decker E A. Relationship between the physiochemical properties of cocoa procyanidins and their ability to inhibit lipid oxidation in liposomes[J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4490-4502.
[10] Aat A, Aus B. The replacement of cereals by legumes in extruded snack foods: Science, technology and challenges[J]. Trends in Food Science & Technology, 2021, 116: 701-711.
[11] 肖志刚,王依凡,王可心,等. 高压均质-冷冻干燥技术制备大豆分离蛋白微粒及其功能特性[J]. 农业工程学报,2021,37(13):306-313.
Xiao Zhigang, Wang Yifan, Wang Kexin, et al. Preparation and functional properties of soybean protein isolated particles by high pressure homogenization-freeze drying[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(13): 306-313. (in Chinese with English abstract)
[12] Shi R, Li T, Li M, et al. Consequences of dynamic high-pressure homogenization pretreatment on the physicochemical and functional characteristics of citric acid-treated whey protein isolate[J]. LWT- Food Science and Technology, 2021, 136: 110303.
[13] Huang Y L, Ma Y S. The effect of extrusion processing on the physiochemical properties of extruded orange pomace[J]. Food Chemistry, 2016, 192: 363-369.
[14] 许艳华,赵光远,敬思群,等. 高压微射流对大豆分离蛋白化学性质及结构的影响[J]. 食品工业,2018(3):44-48.
Xu Yanhua, Zhao Guangyuan, Jing Siqun, et al. Effects of high pressure microjet on chemical properties and structure of soybean protein isolate[J]. Food Industry, 2018(3): 44-48. (in Chinese with English abstract)
[15] Silva A, Areas E, Silva M A, Effects of extrusion on the emulsifying properties of rumen and soy protein[J]. Food Biophysics, 2010, 5(2): 94-102.
[16] Wagner J R, Sorgentini D A, Añón M C. Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepared soy protein isolates[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3159-3165.
[17] 胡湘蜀. 茶多酚组分解析及其与大豆分离蛋白相互作用的研究[D]. 无锡:江南大学,2015.
Hu Xiangshu. Analysis of Tea Polyphenols and Their Interaction With Soybean Protein Isolate[D]. Wuxi: Jiangnan University, 2015. (in Chinese with English abstract)
[18] Mozafarpour R, Koocheki A, Milani E, et al. Extruded soy protein as a novel emulsifier: Structure, interfacial activity and emulsifying property[J]. Food Hydrocolloids, 2019, 93: 361-373.
[19] 李明月. 山葡萄籽原花青素的高压脉冲电场提取及其稳定性与抗氧化活性[D]. 长春:吉林大学,2017.
Li Mingyue. Extraction of Proanthocyanidins From Grape Seeds Under High Pressure Pulsed Electric Field and its Stability and Antioxidant Activity[D]. Changchun: Jilin University, 2017. (in Chinese with English abstract)
[20] Ma W, Qi B, Rokayya S, et al. Conformational and functional properties of soybean proteins produced by extrusion-hydrolysis approach[J]. International Journal of Analytical Chemistry, 2018, 2018:1-11.
[21] Karefyllakis D, Altunkaya S, Berton-Carabin Claire C, et al. Physical bonding between sunflower proteins and phenols: Impact on interfacial properties[J]. Food Hydrocolloids, 2017, 73: 326-334.
[22] Condés M C, Afión M C, Mauri A N. Amaranth protein films prepared with high-pressure treated proteins[J]. Journal of Food Engineering, 2015, 166: 38-44.
[23] Nguela J M, Vernhet A, Sieczkowski N, et al. Interactions of condensed tannins with saccharomyces cerevisiae yeast cells and cell walls: Tannin location by microscopy[J]. Journal of Agricultural & Food Chemistry, 2015, 63(34): 7539-7545.
[24] Chen F L, Wei Y M, Zhang B, et al. System parameters and product properties response of soybean protein extruded at wide moisture range[J]. Journal of Food Engineering, 2010, 96(2): 208-213.
[25] Chen Y, Zhang R, Xie B, et al. Lotus seedpod proanthocyanidin-whey protein complexes: Impact on physical and chemical stability of-carotene- nanoemulsions[J]. Food Research International, 2019, 127(4): 108738.
[26] Ren C, Xiong W, D Peng, et al. Effects of thermal sterilization on soy protein isolate/polyphenol complexes: Aspects of structure, in vitro digestibility and antioxidant activity[J]. Food Research International, 2018, 112: 284-290.
[27] Tehrani M M, Ehtiati A, Azghandi S S. Application of genetic algorithm to optimize extrusion condition for soybased meat analogue texturization[J]. Journal of Food Science & Technology, 2017, 54(5): 1119-1125.
[28] Xu J, Guo S, Li X, et al. Gel properties of transglutaminase- induced soy protein isolate-polyphenol complex: Influence of epigallocatechin-3-gallate[J]. Journal of the Science of Food and Agriculture, 2021 Jul; 101(9): 3870-3879.
[29] 段庆松,段玉敏,肖志刚,等. 挤压稳定化处理对米糠各组分蛋白结构及功能性质的影响[J]. 农业工程学报,2020,36(19):283-290.
Duan Qingsong, Duan Yumin, Xiao Zhigang, et al. Effects of extrusion stabilization on protein structure and functional properties of rice bran components[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(19): 283-290. (in Chinese with English abstract)
[30] 岳鑫. 红松种鳞多酚稳定性及其与乳清蛋白相互作用的研究[D]. 哈尔滨:东北林业大学,2019.
Yue Xin. Study on Stability of Polyphenols and Their Interaction with Whey Protein of Korean Pine Seed Scale[D]. Harbin: Northeast Forestry University, 2019. (in Chinese with English abstract)
[31] Ulrih N P. Analytical techniques for the study of polyphenol-protein interactions[J]. Critical Reviews in Food Science & Nutrition, 2017, 57(10): 2144-2161.
[32] Li X, Wang G, Chen D, et al. Interaction of procyanidin B3 with bovine serum albumin[J]. Rsc Advances, 2014, 4(14): 7301-7312.
[33] Chen Z Q, Wang C, Gao X D, et al. Interaction characterization of preheated soy protein isolate with cyanidin-3-O-glucoside and their effects on the stability of black soybean seed coat anthocyanins extracts[J]. Food Chemistry,2019, 271: 266-273.
[34] Jia J J, Gao X, Hao M H, et al. Comparison of binding interaction between beta-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J]. Food Chemistry, 2017, 228: 143-151.
[35] Plietz P, Damaschun G. The structure of the 11S seed globulins from various plant species: Comparative investigations by physical methods[J]. Studia Biophysica, 1986, 116(3): 153-173.
[36] 李杨,王中江,王瑞,等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技,2016,37(8):104-109.
Li Yang, Wang Zhongjiang, Wang Rui, et al. Infrared spectrum analysis of soybean protein isolate under different heat treatment conditions [J]. Science and Technology of Food Industry, 2016, 37(8): 104-109. (in Chinese with English abstract)
[37] Guo Z, Teng F, Huang Z, et al. Effects of material characteristics on the structural characteristics and flavor substances retention of meat analogs[J].Food Hydrocolloids, 2020, 105(5/6): 105752.
Effects of extrusion temperature on the functional and structural properties of soybean protein isolate and proanthocyanidin complex
Wang Zhenguo, Gao Yuzhe, Shi Jiafeng, Zhang Junjie, Jiang Ruisheng, Huo Jinjie, Su Shuang, Xiao Zhigang※
(,110034,)
The interaction between macromolecules and small molecules has gradually attracted widespread interest in recent years, especially for the interaction between proteins and polyphenols in food components. Phenolic compounds are the parts of the secondary metabolites, mainly found in plant species with great structural diversity. They can exist as glycosides or aglycones, mainly composed of polymeric or monomer structures. Protein is widely found in animals and plants. In the course of food processing, the protein and polyphenols can inevitably coexist in the same system and then interact with each other, which often changes the structure of protein levels. There are some effects of the interaction between polyphenols and proteins on the functional properties of proteins, mainly including the hydration properties (water retention, viscosity, and solubility) and surface properties (foaming and emulsification). The beneficial interactions can improve the nutritional and functional properties of foods. However, the interaction between proteins and polyphenols is susceptible to a variety of factors, including internal factors (self factors, such as the structural characteristics and relative concentrations of proteins and polyphenols), and external factors (environmental factors, mainly including the solvent composition and solution parameters, such as temperature, ionic strength, and pH). The extrusion technique is a physical modification to integrate multiple unit operations, such as material mixing, homogenization, cooking, and molding. In this study, an attempt was made to clarify the effect of proanthocyanidins on the physicochemical properties of soy protein as a representative plant protein, considering the important role of proteins and phenols in health, nutrition, and food quality. Specifically, an investigation was implemented on the effects of different extrusion temperatures (40, 60, 80, 100, and 120℃) on the functional and structural properties of Soybean Protein Isolation (SPI) and Grape Seed Procyanidins Extractive (GSPE) complex. The indicators were selected as emulsifying activity index, emulsion stability index, zeta potential, and particle size. Fluorescence and infrared spectroscopy were used to analyze the functional properties and structure of SPI in the composite system. The results show that there were significantly improved solubility, emulsifying activity, emulsifying stability, absolute value of Zeta potential, and water holding capacity of SPI-GSPE composite after extrusion treatment, compared with the extruded SPI. But, there was an observable decrease in the surface hydrophobicity and oil-holding capacity of the SPI-GSPE composite. Specifically, the solubility, oil retention, and emulsification activity of SPI-GSPE composite first increased, then decreased, and finally reached the maximum at 80℃, with the increase of extrusion temperature. By contrast, the surface hydrophobicity of the SPI-GSPE composite first decreased, then increased, and finally reached the minimum at 80℃. The absolute value of Zeta potential, emulsification stability, and water retention all decreased with the increase in temperature. The particle-size analysis showed that the SPI and GSPE formed a more compact complex after extrusion. The fluorescence spectrum showed that the composite and extrusion with the GSPE were used to extend the skeleton of SPI polypeptide chain for the protein structure, indicating a significant quenching effect on the SPI fluorescence. Ir spectra showed that the non-covalent cross-linking of GSPE to SPI varied greatly in the secondary structure of proteins. The composition and extrusion with the GSPE increased the-helix, irregular crimp, and-corner contents of the SPI, but decreased the-fold contents. This finding can provide important theoretical guidance for the utilization of SPI and GSPE resources.
extrusion; structural properties; functional properties;procyanidins; soy isolate protein
10.11975/j.issn.1002-6819.2022.21.032
TS213.3
A
1002-6819(2022)-21-0279-08
王振国,高育哲,时家峰,等. 挤压温度对大豆分离蛋白与原花青素复合物结构和功能特性的影响[J]. 农业工程学报,2022,38(21):279-286.doi:10.11975/j.issn.1002-6819.2022.21.032 http://www.tcsae.org
Wang Zhenguo, Li Hang, Zhang Junjie, et al. Effects of extrusion temperature on the functional and structural properties of soybean protein isolate and proanthocyanidin complex[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(21): 279-286. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.21.032 http://www.tcsae.org
2022-03-29
2022-07-30
辽宁省“揭榜挂帅”科技攻关专项计划(2021JH/104000340201)、国家自然科学基金(32072139)
王振国,研究方向为粮食油脂及植物蛋白工程。Email:wangzhenguo12216@163.com
肖志刚,博士,教授,研究方向为粮食油脂及植物蛋白工程。Email:zhigang_xiao@126.com
