Mg-HAP-HA 复合吸附剂对Pb(Ⅱ)离子的吸附性能研究
2022-02-16苏可心薛田田李静萍
郑 瑶, 苏可心, 薛田田, 李静萍
(兰州交通大学化学与化工学院, 甘肃 兰州 730070)
0 前 言
金属采矿、印染工业、造纸、农药、汽车制造等诸多行业的生产环节及日常生活中的废水排放,对土壤和水体资源造成了严重的污染。 含Pb(Ⅱ)离子的废水主要来源于蓄电池生产、石油加工、铅冶炼、废铅酸蓄电池回收利用等行业,一般的工业废水中Pb(Ⅱ)离子浓度在15 mg/L 左右,重工业废水中Pb(Ⅱ)离子浓度通常高于100 mg/L。 根据现行有效的国家水污染排放标准“城镇污水处理厂污染物排放标准”(GB 18918-2002)和“污水综合排放标准”(GB 8978-1996)可知[1],在处理设施排放口采样,Pb(Ⅱ)离子最高允许浓度不得超过1.0 mg/L。
当Pb(Ⅱ)离子进入环境后,由于具有残留周期长、不可逆、污染小等特点,很容易通过富集、迁移等方式污染环境,对人体健康和社会安全造成严重危害[2,3]。 因此,寻找高效、安全、低耗的去除废水中铅离子的方法,具有重要的应用价值。
国内外除去土壤和水体中重金属离子的方法主要有化学沉淀法、微生物法、离子交换法、反渗透法和吸附法等[4]。 吸附法由于具有操作简便,能耗较少,而且能够同时处理几种污染物,吸附后的溶液可经过简单浓缩手段后再循环利用,所需工艺要求简单等特点而被广泛应用[5]。
羟基磷灰石(HAP)是一种环境友好型材料,对污染物有良好的吸附能力[6]。 此外,HAP 还具有制备工艺简单[7,8]、成本低、原料来源广等优势,但也存在分散性不好、吸附时易团聚的缺陷。 腐植酸(HA)[9]是一类广泛存在于自然界中的有机质,有良好的吸附性能,并具有胶体性质[10,11]。
为了充分利用本土资源,本工作采用的原料腐植酸(HA)从甘肃天祝褐煤中提取制得。 将腐植酸(HA)与掺镁羟基磷灰石(Mg-HAP)复合,制备出了一种新型的Mg-HAP-HA 复合吸附剂,就Mg-HAP-HA、HA、Mg-HAP 3 种吸附剂对Pb(Ⅱ)离子的吸附效果进行了对比,探究了3 种吸附剂对Pb(Ⅱ)离子吸附率的影响因素,并对吸附Pb(Ⅱ)离子后的Mg-HAP-HA 复合吸附剂进行解吸脱附再生性能实验。 通过吸附动力学实验,确定了Mg-HAP-HA 复合吸附剂对Pb(Ⅱ)离子的吸附动力学模型。
1 试 验
1.1 实验试剂及仪器
相关实验用试剂及仪器详见表1,表2。
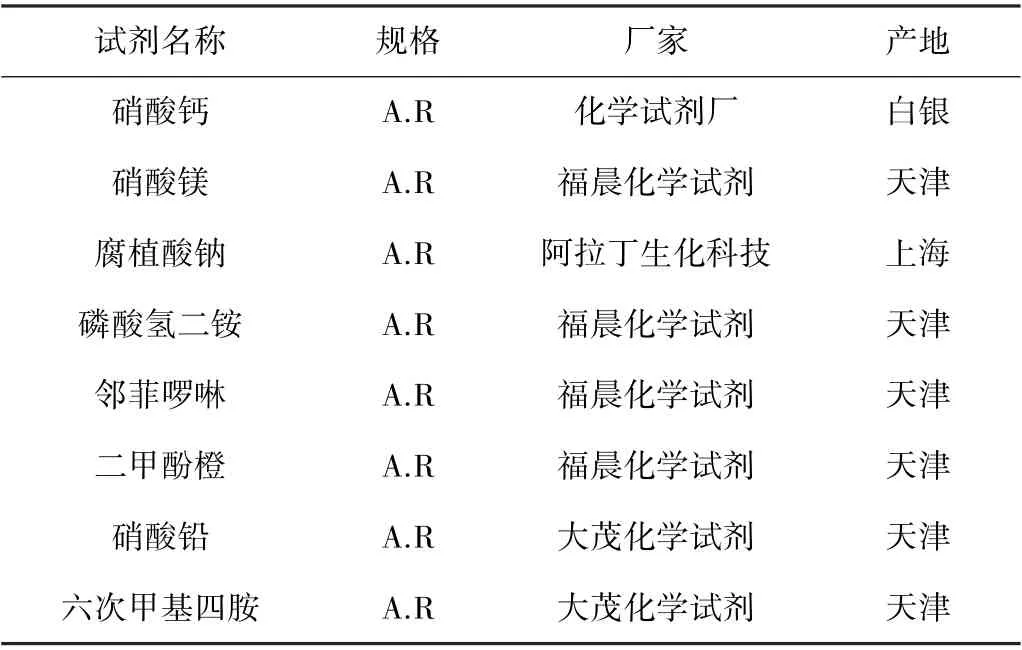
表1 实验试剂Table 1 List of reagents used in the experiment
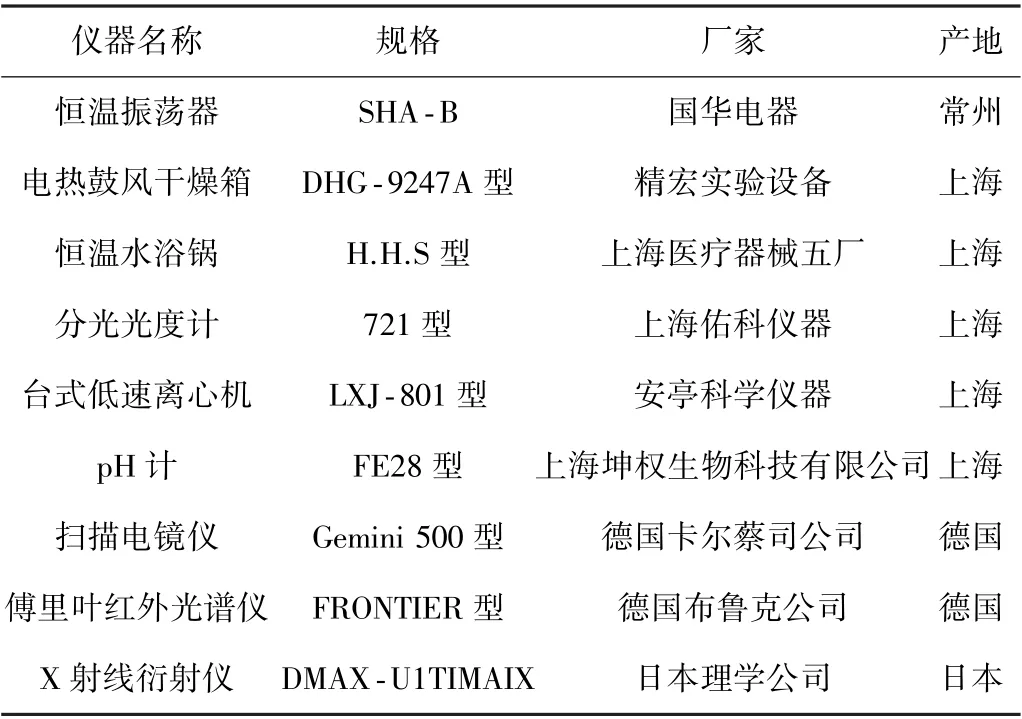
表2 实验仪器Table 2 List of instruments used in the experiment
1.2 HAP-HA 的制备
1.2.1 腐植酸的提取
向盛有20 g 腐植酸钠的烧杯中加入400 mL 蒸馏水,充分搅拌至腐植酸钠全部溶于水,用2 mol/L 的H2SO4溶液调节pH 值至1~2 左右后,有大量的絮状沉淀物生成,即为腐植酸。 静置12 h 后,将沉淀过滤、用蒸馏水洗涤至滤液中无出现为止,80 ℃条件下烘干,充分研磨后过200 目筛,记为HA。
1.2.2 羟基磷灰石的制备
以Ca (NO3)2· 4H2O、 Mg (NO3)2· 6H2O、(NH4)2HPO4为原料,采用共沉淀法制备羟基磷灰石。在烧杯中加入250 mL 0.5 mol/L 的Ca(NO3)2,再将150 mL (NH4)2HPO4慢慢地滴加至Ca(NO3)2溶液中(Ca ∶P 摩尔比为5 ∶3)。 用氨水调节溶液的pH 值为10,搅拌30 min,在70 ℃温度下陈化8 h 后,将产物抽滤、洗濯至pH 值不变,90 ℃条件下烘干,充分研磨后过200 目筛,记为HAP。
1.2.3 掺镁羟基磷灰石的制备
将羟基磷灰石通过加入Ca(NO3)2·4H2O 和Mg(NO3)2·6H2O 混合溶液的方法引入镁离子。 在烧杯中加入250 mL 0.5 mol/L 的Ca(NO3)2,再将150 mL(NH4)2HPO4缓慢滴加至Ca(NO3)2中。 表3 是根据Mg ∶Ca 的10 种不同摩尔比,保持(Mg+Ca) ∶P 摩尔比为5 ∶3 制备的掺镁羟基磷灰石。 用氨水调节溶液的pH 值为10 左右,搅拌30 min,在70 ℃下陈化8 h后,将产物抽滤、洗涤至pH 值不变,90 ℃条件下烘干,充分研磨后过200 目筛,记为Mg-HAP。

表3 不同Mg ∶(Ca+Mg)摩尔比配制Mg-HAP 用料表Table 3 Table of materials for preparing Mg-HAP with different Mg ∶(Ca+Mg) molar ratio
1.3 Mg-HAP-HA 复合吸附剂的制备
1.3.1 不同质量比Mg-HAP-HA 复合吸附剂的制备
用不同Mg ∶(Ca+Mg)摩尔比的掺镁羟基磷灰石对Pb(Ⅱ)离子进行吸附试验,得出Mg ∶(Ca+Mg)摩尔比为0.2 的掺镁羟基磷灰石吸附效果最佳,将其与HZ 进行不同质量比的复合,制备掺镁羟基磷灰石-腐植酸复合吸附剂:
称取一定量的HA 于大烧杯中,加入500 mL 蒸馏水,超声分散30 min。 按照不同的复合质量比(如表4所示)加入掺镁羟基磷灰石,机械搅拌24 h 后,过滤洗涤,90 ℃条件下烘干即可得到掺镁羟基磷灰石-腐植酸复合吸附剂,记为Mg-HAP-HA。
1.3.2 最佳掺镁比例的确定
准确量取50 mL 浓度为1 200 mg/L 的Pb(Ⅱ)离子溶液至250 mL 具塞锥形瓶中,分别加入表4 中的19种不同掺杂比例的Mg-HAP 各0.1 g,在25 ℃下,恒温振荡吸附60 min 后离心,测定吸光度,计算吸附率。

表4 Mg-HAP-HA 质量比Table 4 Mg-HAP-HA mass ratio
图1 为不同复合质量比Mg-HAP-HA 对Pb(Ⅱ)离子的吸附率。 由图可知:复合质量比为0.70 ∶0.30的14 号Mg-HAP-HA 复合吸附剂对Pb(Ⅱ)离子的吸附率最高,达到97.10%,将其标记为Mg-HAP-HA14。从图中可以看到当Mg-HAP ∶HA 复合质量比较低时,吸附率也较低,这是因为HA 对Pb(Ⅱ)离子吸附能力要低于Mg-HAP。 随着复合质量比增大,吸附率也随之提高,到Mg-HAP-HA14时吸附率最大,其后继续增大复合质量比,吸附率开始下降,这是由于Mg-HAP 含量比较高,导致复合吸附剂分散性不好,易在水中团聚。

图1 不同复合质量比Mg-HAP-HA 对Pb(Ⅱ)离子吸附率Fig. 1 Effect of Mg-HAP-HA on Pb(Ⅱ) adsorption rate
1.4 吸附Pb(Ⅱ)离子的影响因素
不同吸附条件下同一吸附剂对Pb(Ⅱ)离子的最优吸附结果不同。 因此设计单因素实验,研究吸附剂对吸附Pb(Ⅱ)离子的最佳条件。 在250 mL 具塞锥形瓶中,准确量取50 mL 的一定浓度的Pb(Ⅱ)离子溶液,再加入一定质量的吸附剂,分别改变溶液的pH 值、Pb(Ⅱ)离子初始浓度、吸附时间、温度、吸附剂投加量条件之一,恒温震荡至吸附平衡。 测定吸光度,按照以下公式计算其吸附率、吸附量:
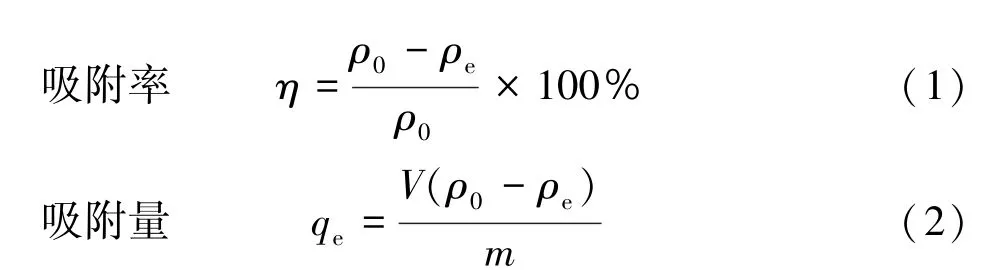
式中:ρ0为吸附质初始浓度,mg/L;ρe为吸附平衡浓度,mg/L;V为吸附质溶液体积,mL;m为吸附剂投加量,mg。
1.4.1 吸附pH 值
准确称取6 组质量为0.06 g 的Mg-HAP-HA14复合吸附剂,放置于250 mL 的具塞锥形瓶中,分别加入1 200 mg/L 的Pb(Ⅱ)离子溶液50 mL,调整pH 值分别为1,2,3,4,5,6,在35 ℃条件下,恒温振荡吸附60 min,离心结束取上清液,测定其吸附后的吸光度值,计算吸附率。 因Pb(Ⅱ)离子在碱性条件下(pH≥7)容易水解并形成沉淀析出,影响吸附剂实际吸附性能,且重金属Pb(Ⅱ)离子废水的pH 值一般为弱酸性[12],因此本实验不考虑吸附剂在碱性条件下的吸附情况。 以HA 和Mg-HAP 为吸附剂,重复上述实验,对比分析pH值对HA、Mg-HAP、Mg-HAP-HA14吸附Pb(Ⅱ)离子的影响。
1.4.2 Pb(Ⅱ)离子初始浓度
准确称取7 组质量为0.06 g 的Mg-HAP-HA14复合吸附剂,放置于250 mL 具塞锥形瓶中,分别加入浓度为500,800,1 000,1 200,1 500,1 800,2 000 mg/L 的Pb(Ⅱ)离子溶液50 mL,调整溶液pH 值为6,在35 ℃条件下,振荡吸附60 min,离心结束后取上清液,测定其吸附后的吸光度值,计算吸附率。 然后再以HA 和Mg-HAP 为吸附剂,重复上述实验,对比分析Pb(Ⅱ)离子初始浓度对HA、Mg-HAP、Mg-HAP -HA14吸附Pb(Ⅱ)离子的影响。
1.4.3 吸附时间
准确称取10 组质量为0.06 g 的Mg-HAP-HA14复合吸附剂,放置于250 mL 具塞锥形瓶中,分别加入50 mL 浓度为1 200 mg/L 的Pb(Ⅱ)离子溶液,调整pH为6,在35 ℃条件下,恒温振荡吸附10,20,30,40,50,60,70,80,90,100 min 后,离心结束取上清液,测定其吸附后的吸光度值,计算吸附率。 然后再以HA 和Mg-HAP 为吸附剂,重复上述实验,对比分析吸附时间对HA、Mg-HAP、Mg-HAP-HA14吸附Pb(Ⅱ)离子的影响。
1.4.4 吸附温度
准确称取6 组质量为0.06 g 的Mg-HAP-HA14复合吸附剂,放置于250 mL 具塞锥形瓶中,分别加入50 mL的1 200 mg/L 的Pb(Ⅱ)离子溶液,调整pH 值为6,将温度分别设置为25,30,35,40,45,50 ℃,振荡吸附60 min,离心结束取上清液,测定其吸附后的吸光度值,计算吸附率。 然后再以HA 和Mg-HAP 为吸附剂,重复上述实验,对比分析吸附温度对HA、Mg-HAP、Mg-HAP-HA14吸附Pb(Ⅱ)离子的影响。
1.4.5 吸附剂投加量
准确称取0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08 g 的Mg-HAP-HA14复合吸附剂8 份,放置在250 mL 具塞锥形瓶中,分别加入等量50 mL 的1 200 mg/L Pb(Ⅱ)离子溶液,调整pH 值为6,在35 ℃条件下,振荡吸附60 min,离心结束取上清液,测定其吸附后的吸光度值,计算吸附率。 再以HA 和Mg-HAP 为吸附剂,重复上述实验,对比分析吸附剂投加量对HA、Mg -HAP、Mg-HAP-HA14吸附Pb(Ⅱ)离子的影响。
1.5 吸附剂的解吸循环再生实验
在吸附工艺中,吸附剂因吸附大量的吸附质,会逐渐趋向饱和并最终丧失吸附能力。 解吸主要是去除吸附剂上的可逆吸附分子,并使吸附剂再生。 根据现有文献资料以及从实用、经济的角度考虑,本实验用化学处理方法[13,14]解吸再生饱和吸附的Mg-HAP-HA14复合吸附剂。
在250 mL 具塞锥形瓶中,加入50 mL 浓度为1 200 mg/L 的Pb(Ⅱ)离子溶液,再加入0.06 g Mg-HAPHA14复合吸附剂,温度为35 ℃,pH 值为值6,振荡吸附60 min 后测定吸光度,计算溶液中Pb(Ⅱ)离子剩余浓度。 将饱和吸附后的Mg-HAP-HA14复合吸附剂干燥后,分别加入到4 种脱附剂溶液[100 mL 0.5 mol/L 的盐酸、硫酸、硝酸钙溶液和甲醇与乙醇(9 ∶1)的混合溶液]中,确定脱附效果最佳的洗脱剂。 再将饱和吸附后的Mg-HAP-HA14复合吸附剂加入到优选后的脱附剂溶液中,在35 ℃振荡脱附至脱附平衡,脱附后的复合吸附剂经离心后,测定其吸光度,计算其脱附率,重复解吸-再生实验。
1.6 吸附Pb(Ⅱ)离子的动力学实验
准确称取10 组质量为0.06 g 的Mg-HAP-HA14复合吸附剂,放置于250 mL 具塞锥形瓶中,分别加入50 mL 浓度为1 200 mg/L 的Pb(Ⅱ)离子溶液,pH 值为6,在35 ℃条件下,恒温振荡吸附10,20,30,40,50,60,70,80,90,100 min 后,离心结束取上清液,测定其吸附后的吸光度值,计算吸附量。 然后再以HA 和Mg-HAP为吸附剂,重复上述实验。 再分别用以下3 种模型对所得到的实验数据进行拟合。准一级动力学模型[15]:

式中qe为平衡吸附量,mg/g;qt为t时刻的吸附量,mg/g;k1为一级吸附速率常数,L/min。
准二级动力学模型:

式中:qe为平衡吸附量,mg/g;qt为t时刻的吸附量,mg/g;k2为二级吸附速率常数,g/(mg·min)。
Weber-Morris 内扩散模型:

式中:qt为t时吸附量;C为液膜的厚度;kid为颗粒内扩散速率常数。
以qt为纵坐标、t1/2为横坐标作图,得到线性拟合判定系数R2。 如果拟合结果表现为一条直线,则可以确定内扩散控制整个吸附过程。
2 结果讨论与分析
2.1 吸附剂的形貌及结构表征
2.1.1 SEM 分析
图2 为3 种吸附剂的低倍和高倍SEM 形貌,从图2a 可以看到HA 表面结构不光滑,粗糙,呈现出较大的块状结构。 由图2b 可知,Mg-HAP 吸附剂的SEM 形貌与HA 的有明显差异,表现出较小的颗粒状结构,表面结构更加粗糙,有明显的孔隙结构,比表面积较大。 由图2c 可以看出,Mg-HAP 和HA 复合后的Mg-HAPHA14吸附剂,与HA 和Mg-HAP 相比,表面变得更加粗糙,孔洞数目增多,比表面积增加,可以为污染物提供更多的吸附位点,有利于吸附。

图2 3 种吸附剂的SEM 形貌Fig. 2 SEM image of three adsorbents
2.1.2 FT-IR 分析
图3 为3 种吸附剂的FT-IR 谱。 由于HA 物质中含有丰富的活性基团,这些基团之间会互相影响,使其原本的吸收峰发生了位移或被隐藏,但根据其位置仍可确定部分基团[16]。 在3 400 cm-1附近出现的宽峰是氢键缔合OH 和游离OH 的氢键伸缩振动峰。 HA 的特征吸收峰出现在1 600 cm-1和1 365 cm-1处,1 600 cm-1附近出现的吸收峰为芳香族C =C 拉伸振动以及-COOH中的C =O 伸缩振动[17],1 365 cm-1处出现的一组吸收峰主要包含有COO-对称吸收峰和脂肪末端CH3弯曲振动[18]。 780 cm-1处出现的较弱的吸收峰为苯环中CH 面外弯曲振动吸收峰,在HA、Mg-HAP 和Mg-HAP-HA14的谱图上,可以看到1 050 cm-1和570 cm-1附近出现的2 组峰是PO34-的特征吸收峰[19],表明Mg-HAP 已经与HA 复合成功。

图3 3 种复合吸附剂的FT-IR 谱Fig. 3 The FT-IR images of the HA, Mg-HAP,and Mg-HAP-HA14 composite adsorbent
2.1.3 XRD 分析
图4 为HA、Mg-HAP 和Mg-HAP-HA143 种吸附剂的XRD 谱。 图中可观察到HA、Mg-HAP、Mg-HAP -HA14在2θ为26.20°,Mg-HAP、Mg-HAP-HA14在2θ为32°附近的位置处,出现了相对应HAP 的衍射峰,说明Mg(II)与HAP,Mg-HAP 与HA 已成功复合。 但又表现出衍射峰强度不高,是因为虽然Mg-HAP 已经形成,但是结晶度不高,可能是Mg(II)的掺杂导致其晶格缺陷变大,这种晶格的缺陷会使比表面积进一步增大,使得吸附能力提高[20,21]。 在HA 的XRD 谱上可以看到19.8°~24.8°有一条比较宽的衍射峰,为HA 的晶面衍射峰,但峰强度较弱,可能为HA 在形成过程中,其结构内的芳环发生了有序排列的现象,从而形成某种晶体结构[16]。

图4 HA、Mg-HAP 和Mg-HAP-HA14的XRD 谱Fig. 4 XRD images of HA, Mg-HAP and Mg-HAP-HA14 composite adsorbent
2.2 吸附条件分析
2.2.1 吸附pH 值
3 种吸附剂对Pb(Ⅱ)离子的吸附率随溶液pH 值的变化关系如图5 所示。 pH 值在酸性范围内时,随着酸性的减弱,3 种吸附剂对Pb(Ⅱ)离子的吸附率均缓慢增加,其中,Mg-HAP-HA14对Pb(Ⅱ)离子吸附率在pH 值为6 时达到98.5%。 Mg-HAP 和HA 对Pb(Ⅱ)离子的吸附率分别为90.12%和31.43%。 在吸附开始阶段,pH 值较低时,溶液中的H+会与Pb(Ⅱ)离子产生竞争吸附,与此同时,在酸性环境中,Mg-HAP-HA14复合吸附剂上酸性基团的电离会受到抑制[22],与其Pb(Ⅱ)离子之间的配合作用减弱,吸附率较低。 当pH值较高时,溶液中H+逐渐减少,同时,复合吸附剂表面电负性增大,有利于吸附更多的Pb(Ⅱ)离子。 而Pb(Ⅱ)离子在碱性条件下(pH ≥7)容易水解并形成Pb(OH)2白色沉淀析出[23],影响吸附剂实际吸附能力,且废水的pH 值一般为弱酸性[12],因此,本实验暂不考虑吸附剂在碱性条件下吸附情况。 综上,选择6作为3 种吸附剂吸附Pb(Ⅱ)离子最佳pH 值。
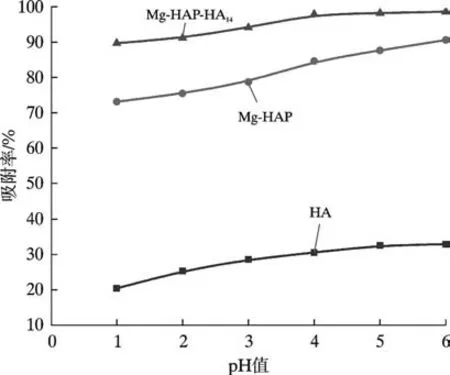
图5 pH 值对Pb(Ⅱ)离子吸附率的影响Fig. 5 Effect of pH value to Pb(II) adsorption rate
2.2.2 吸附质初始浓度
3 种吸附剂对Pb(Ⅱ)离子的吸附率随吸附质初始浓度的变化关系如图6 所示。 在500~2 200 mg/L 之间,随着吸附质初始浓度的增大,3 种吸附剂对Pb(Ⅱ)离子的吸附率总体呈现下降趋势,这是因为随着吸附质初始浓度的增大,溶液中Pb(Ⅱ)离子浓度增大,但是活性位点并未增加,随着反应的进行吸附剂表面剩余未反应的活性位点越来越少,因此吸附率会迅速下降。 其中,Mg-HAP-HA14对Pb(Ⅱ)离子的吸附率在吸附质初始浓度1 200 mg/L 时达到98.51%。 Mg-HAP和HA 对Pb(Ⅱ)离子的吸附率分别为88.5%和32.8%。Mg-HAP 对Pb(Ⅱ)离子的吸附率在吸附质初始浓度500~800 mg/L 时最大。 HA 对Pb(Ⅱ)离子吸附率在吸附质初始浓度500 mg/L 时最大。 综上,选择1 200 mg/L 作为3 种吸附剂吸附Pb(Ⅱ)离子的吸附质最佳初始浓度。
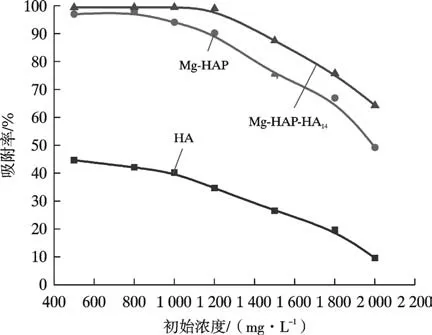
图6 初始浓度对Pb(Ⅱ)离子吸附率的影响Fig. 6 Effect of initial concentration on Pb(Ⅱ) adsorption rate
2.2.3 吸附时间
3 种吸附剂对Pb(Ⅱ)离子的吸附率随时间变化关系如图7 所示,在0~50 min 之间,随着时间的延长,Mg-HAP和Mg-HAP-HA14比HA 吸附率的增加幅度大,其中,Mg-HAP-HA14对Pb(Ⅱ)离子吸附率在吸附时间为60 min 时最大。 在60 min 后,HA、Mg-HAP 和Mg-HAP-HA14吸附率基本保持不变,不随时间而变化。在吸附初始阶段,溶液中Pb(Ⅱ)离子较多,吸附剂有大量的吸附活性位点未被占据,吸附推动力较大,吸附率迅速增大。 当Pb(Ⅱ)离子浓度逐渐降低后,吸附剂的吸附活性位点减少,最终达到吸附平衡。 因此,选择60 min 作为3 种吸附剂吸附Pb(Ⅱ)离子的最佳吸附时间。

图7 时间对Pb(Ⅱ)离子吸附率的影响Fig. 7 Effect of time on Pb(II) adsorption rate
2.2.4 吸附温度
3 种吸附剂对Pb(Ⅱ)离子的吸附率随温度的变化关系如图8 所示。 在25~35 ℃之间,随着温度的升高,3 种吸附剂对Pb(Ⅱ)离子的吸附率增大,其中,Mg-HAP-HA14对Pb(Ⅱ)离子的吸附率在温度为35 ℃时达到98.5%,此时Mg-HAP 和HA 对Pb(Ⅱ)离子的吸附率分别为90.1%和31.5%。 在35~50 ℃之间,3 种吸附剂对Pb(Ⅱ)离子的吸附率开始减小。 在25~35 ℃之间,吸附率随着温度的升高而增大,升高温度可以促进吸附质分子加速运动,与吸附剂之间碰撞机率增加,在35 ℃时吸附率达到最高,说明适当地提高温度有利于吸附过程的进行。 而在35~50 ℃之间,吸附率随着温度的升高而减小,是因为过高的温度下,分子运动加剧,使部分被吸附的Pb(Ⅱ)离子发生解吸[24]。 因此,选择35 ℃作为3 种吸附剂吸附Pb(Ⅱ)离子的最佳温度。

图8 温度对Pb(Ⅱ)离子吸附率的影响Fig. 8 Effect of temperature on Pb(Ⅱ) adsorption rate
2.2.5 吸附剂投加量
Pb(Ⅱ)离子的吸附率随3 种吸附剂投加量的变化关系如图9 所示。

图9 投加量对Pb(Ⅱ)离子吸附率的影响Fig. 9 Effect of dosage on Pb(Ⅱ) adsorption rate
在0.01 g~0.06 g 之间,随着投加量的升高,3 种吸附剂对Pb(Ⅱ)离子的吸附率增大,其中,Mg-HAP -HA14对Pb(Ⅱ)离子的吸附率在投加量为0.06 g 时达到98.5%,此时Mg-HAP 和HA 对Pb(Ⅱ)离子的吸附率分别为90.1%和31.45%。 在投加量达到0.06 g 后,HA、Mg-HAP 和Mg-HAP-HA14吸附率基本保持不变,不随投加量而变化。 在0.01~0.06 g 之间,吸附率随着投加量的增大而增大,说明在这个投加量区间内,在Pb(Ⅱ)离子浓度相同条件下,吸附剂的投加量增大后,吸附剂活性吸附位数增多,可吸附更多的Pb(Ⅱ)离子,吸附剂对Pb(Ⅱ)离子吸附率增大。 在投加量0.06 g 后,溶液中的Pb(Ⅱ)离子浓度变小,继续增大投加量时,吸附率缓慢减小。 因此,选择0.06 g 作为3 种吸附剂吸附Pb(Ⅱ)离子的最佳投加量。
2.2.6 吸附剂的解吸循环再生实验
图10 为选取的4 种脱附剂对Mg-HAP-HA14复合吸附剂进行脱附实验的结果。
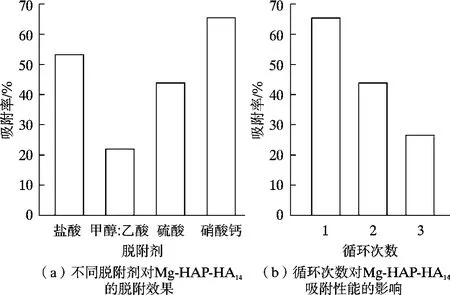
图10 Mg-HAP-HA14循环再生实验Fig. 10 Cyclic regeneration experiment of Mg-HAP-HA14
由图10 可看出,采用硝酸钙的效果最佳,首次脱附后对Pb(Ⅱ)离子的吸附率为65.5%。 选取硝酸钙作为脱附剂对Mg-HAP-HA14复合吸附剂进行脱附再生实验,结果如图10b 所示,可以看出,Mg-HAP-HA14的脱附再生性能较差,经过3 次脱附循环后,对Pb(Ⅱ)离子的吸附率仅有26.45%。 本研究制备的Mg-HAPHA14复合吸附剂的脱附再生有效循环为2 次。 综合实验操作损耗和经济性考虑,Mg-HAP-HA14复合吸附剂在本团队研究的系列吸附剂中,属较为高效、低耗的吸附材料。 在吸附饱和后的Mg-HAP-HA14复合吸附剂表面及层间存在多种重金属污染物,因此属于危险废物,必须经过固化稳定化处置,如玻璃化固化或者水泥固化。 由于固化成本高,因此减少废弃物体积和质量有利于降低处置的成本。 在高温焙烧能氧化燃烧有机物的同时,也可将吸附的Pb(Ⅱ)离子以及复合吸附剂中的Mg-HAP部分转变成氧化物形式,从而降低毒性并减少体积和质量,有利于后续固化处理或者资源化回收。
胡一敏等[25]以壳聚糖(CS)和羟基磷灰石(HAP)为原料,采用冷冻干燥法制备了壳聚糖/羟基磷灰石(CS/HAP)复合海绵,结果表明,CS/HAP 加量2 g,pH值5.5,Pb(Ⅱ)离子的初始质量浓度200 mg/L 时,CS/HAP复合海绵对Pb(Ⅱ)离子的饱和吸附容量达95.20 mg/g,虽可多次循环使用但总体饱和吸附容量低于本研究制备的Mg-HAP-HA14复合吸附剂。 本研究以高浓度1 200 mg/L 的Pb(Ⅱ)离子为吸附质,在经过2 次循环再生吸附后,剩余Pb(Ⅱ)离子浓度在15 mg/L左右,结合文献发现,若应用于一般的工业废水,即Pb(Ⅱ)离子浓度在15 mg/L 左右,以Mg-HAP-HA14复合吸附剂经2 次循环吸附Pb(Ⅱ)离子废水后,仍足以达到排放要求。
2.3 吸附动力学结果
3 种吸附剂对Pb(Ⅱ)离子的吸附量随时间的变化关系如图11 所示。 可以看出,Mg-HAP 和Mg-HAPHA14对Pb(Ⅱ)离子的吸附量明显比HA 大,两者吸附量在前50 min 内增加较快,而在60 min 后,吸附量基本 保 持 不 变, 达 到 吸 附 平 衡。 HA、 Mg - HAP 和Mg-HAP-HA143 种吸附剂对Pb(Ⅱ)离子的吸附量分别为314.5,901.4,985.1 mg/g。

图11 吸附时间与Pb(Ⅱ)离子吸附量关系图Fig. 11 The influence of time on Pb(Ⅱ) adsorption capacity
Guo 等[26]通过控制单十二烷基磷酸钾(MDP-K)的加入,成功合成了不同形貌的纳米HAP。 研究表明,随着MDP-K 添加量的增加,制备的HAP 粉体的粒径、比表面积和孔体积均有增大的趋势,该吸附剂对Pb(Ⅱ)离子、Cd(Ⅱ)离子、Cr(Ⅲ)离子的吸附量分别是 586. 2, 165. 7, 103. 6 mg/g。 李 辉 等[27]采 用Fe(NO3)2/Ca(NO3)2/KH2PO4混合溶液在碱性条件下通过水合法制备掺Fe(Ⅱ)羟基磷灰石(Fe-HAP),Fe-HAP对Pb(Ⅱ)离子的最大吸附容量(Qm)达224 mg/g。 对此可知,本实验制得的Mg-HAP-HA14吸附剂是一种良好的复合吸附剂,可作为水体污染治理的备选方案。
将所得吸附实验数据分别用准一级和准二级动力学方程进行拟合,拟合结果如图12 所示,相关参数见表5。 从表5 可以看出,3 种吸附剂对Pb(Ⅱ)离子的吸附数据由准二级吸附速率方程拟合所得到的R2分别为0.993 5,0.973 2,0.995 9,准一级速率方程拟合的R2分别为0.965 5、0.926 9、0.966 0,高于准一级动力学方程的R2,说明HA、Mg-HAP 和Mg-HAP-HA14对Pb(Ⅱ)离子的吸附符合准二级动力学模型。

图12 吸附Pb(Ⅱ)离子的动力学方程回归图Fig. 12 Regression of order kinetic equations for adsorption of Pb(Ⅱ)

表5 吸附Pb(Ⅱ)离子的动力学方程回归参数表Table 5 Table of regression parameters of kinetic equation for adsorption of Pb(Ⅱ)
将上述实验数据用Weber-Morris 方程进行拟合,如图13 所示。

图13 吸附Pb(Ⅱ)离子的Weber-Morris 内扩散模型Fig. 13 Regression of order kinetic equations for adsorption of Pb(Ⅱ)
从图13 可看到线性拟合判定系数R2拟合得到的2段直线都不过原点,说明吸附速率并不完全由颗粒内扩散步骤所控制。 图中第一段直线表示Pb(Ⅱ)离子从溶液当中向吸附剂表面扩散的过程,第二段直线表示Pb(Ⅱ)离子从吸附剂外表面向吸附剂内部的扩散过程[28,29]。 从表6 可以看出第一阶段的颗粒内扩散速率常数kid明显大于第二阶段的,这是因为在反应开始进行时,吸附剂外表面有大量的活性位点,溶液中Pb(Ⅱ)离子浓度较高,吸附推动力较大,Pb(Ⅱ)离子可以很快地到达吸附剂表面,这一阶段吸附速率较快。 而当吸附剂表面接近吸附饱和后,Pb(Ⅱ)离子开始向吸附剂内部扩散,此时液膜的厚度C值增大,即液膜厚度增加,扩散阻力增大,吸附速率由内扩散步骤所控制。

表6 吸附Pb(Ⅱ)离子的Weber-Morris 内扩散模型参数表Table 6 Parameters of Weber-Morris internal diffusion model for adsorbing Pb(Ⅱ)
2.4 吸附Pb(Ⅱ)离子机理分析
2.4.1 XRD 分析
图14 为Mg-HAP-HA14吸附Pb(Ⅱ)离子前后的XRD 谱,从图14 可以看出,吸附前仅在26.2°和32°出现2 个特征峰,而吸附后30.3°处出现了1 个极强的衍射峰,其它位置也出现多组新的衍射峰,说明Pb(Ⅱ)离子与HAP 反应生成了新的物相。 通过对比标准卡片84-0814 和97-2477 可以发现,反应主要生成了Ca2.5Pb7.5(OH)2(PO4)6和Pb10(PO4)6(OH)2,表 明Mg-HAP-HA14对Pb(Ⅱ)离子的吸附机理主要包含有溶解沉淀和离子交换,以化学吸附为主[30,31]。复合吸附剂对Pb(Ⅱ)离子的吸附较为复杂,可能存在表面吸附、离子交换和配合作用。
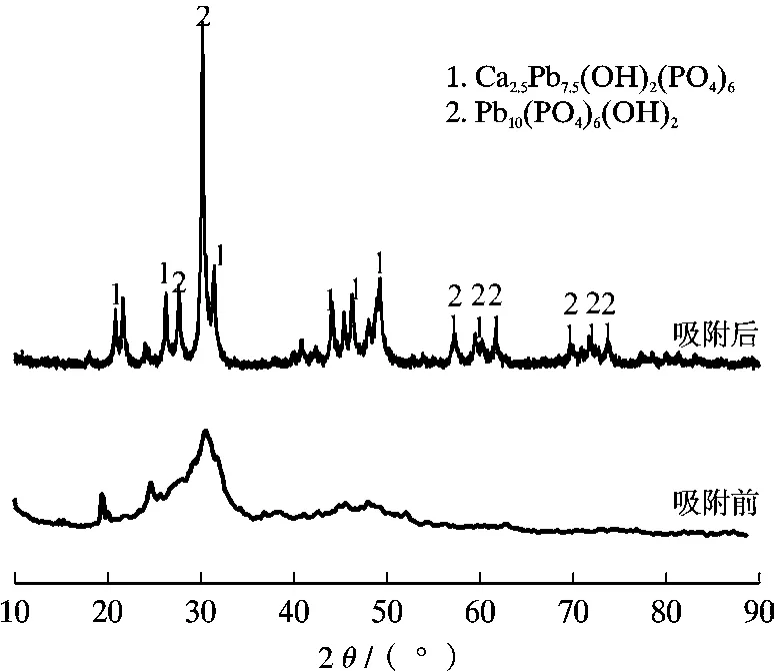
图14 Mg-HAP-HA14吸附Pb(Ⅱ)离子前后的XRD 谱Fig. 14 XRD images before and after Pb(Ⅱ)adsorption by Mg-HAP-HA14


图15 Mg-HAP-HA14吸附Pb(Ⅱ)离子前后的FT-IR 谱Fig. 15 FT-IR images before and after Pb(Ⅱ)adsorption by Mg-HAP-HA14
3 结 论
(1)由单因素实验结果得到Mg-HAP-HA14复合吸附剂对Pb(Ⅱ)离子在60 min 时达到吸附平衡,实验表明在Pb(Ⅱ)离子浓度为1 200 mg/L 时,当吸附剂使用量为0.06 g,温度为35 ℃,pH 值为6 时吸附效果最好,吸附率为98.51%,吸附量最高可达到985.1 mg/g。
(2)吸附脱附循环再生实验中选用4 种脱附剂对Mg-HAP-HA14复合吸附剂进行脱附,其中硝酸钙脱附效果最佳,可有效循环吸附2 次,吸附率为43.97%。
(3)对Mg-HAP-HA14吸附Pb(Ⅱ)离子的过程进行了动力学分析,Mg-HAP-HA14对Pb(Ⅱ)离子的吸附符合准二级动力模型。
(4)对吸附Pb(Ⅱ)离子后的Mg-HAP-HA14进行了SEM、XRD 以及FT-IR 表征,结果表明,Mg-HAPHA14复合吸附剂对Pb(Ⅱ)离子吸附后,生成了新的产物Ca2.5Pb7.5(OH)2(PO4)6和Pb10(PO4)6(OH)2,吸附过程主要以化学吸附为主,伴随有物理吸附,吸附机理主包括溶解沉淀、离子交换和配合作用。
