PI3K/SGK1信号通路上调小鼠肺上皮钠通道表达的研究*
2022-02-16李长毅王导新
马 青, 李长毅, 王导新, 邓 旺
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
上皮钠通道(epithelial sodium channel,ENaC)是肺泡腔内钠水转运的重要环节,能有效地清除聚集的水肿液,对维持气体交换和改善氧合至关重要,可明显降低急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者的病死率[1]。磷酯酰肌醇3-激酶(phos‑phatidylinositol 3-kinase,PI3K)是参与调节ALI 肺泡液体清除(alveolar fluid clearance,AFC)的重要信号通路,但其下游的作用靶点及与ENaC 的关系仍未完全阐明清楚[2]。血清-糖皮质激素调节激酶1(serumglucocorticoid regulated kinase 1,SGK1)是胰岛素激活PI3K 通路发挥效应的下游重要靶点,也是调节ENaC 表达的关键因子[3]。本研究通过建立小鼠ALI模型,观察PI3K/SGK1信号通路对AFC 及ENaC 表达的影响,探讨PI3K/SGK1信号通路在ALI中的作用。
材料和方法
1 实验材料
SPF 级雄性C3H/HeN 小鼠24 只(7~9 周,体重为20~24 g)购自重庆医科大学动物实验中心[生产许可证号为SCXK(渝)2007-0001]。脂多糖(lipopolysac‑charide,LPS;O111:B4)和伊文思蓝(Evans blue)购自Sigma;重组人胰岛素购自EliLilly;PI3K p85α小干扰RNA(small interfering RNA,siRNA)购自Santa Cruz;SGK1siRNA 由Gene Pharma 设计并合成;ENaC α亚基(α-ENaC)、ENaC β亚基(β-ENaC)、ENaC γ亚基(γ-ENaC)、PI3K p85α、SGK1、磷酸化SGK1(Ser422)及β-actin 单克隆抗体购自Santa Cruz;RNA 提取试剂盒和RT-PCR 试剂盒购自TaKaRa;Lipofectamine®2000转染试剂购自Invitrogen。
2 实验方法
2.1 动物模型与分组小鼠给予巴比妥50 mg/kg腹腔注射麻醉后,分离暴露颈静脉,留置静脉导管,气道内滴入LPS(5 mg/kg)建立ALI 模型[4]。24 只小鼠随机分为对照组、ALI 组、胰岛素组和PI3KsiRNA组,每组6 只小鼠。对照组:经颈静脉泵入等体积的生理盐水;ALI 组:给予LPS 建立ALI 模型后,持续泵入等体积的生理盐水;胰岛素组:给予LPS 建立ALI模型后,持续经颈静脉泵入胰岛素(0.1 U·kg−1·h−1)[5];PI3KsiRNA 组:建立ALI 模型,持续泵入胰岛素(0.1 U·kg−1·h−1)的同时,100 μgPI3K p85αsiRNA稀释于100 μL生理盐水中通过移液管直接导入小鼠喉咙,立即闭合小鼠气道[6]。对照组、ALI 组和胰岛素组中以同样方式给予等量的空白siRNA 作为参照。8 h后处死小鼠,收集肺组织标本。
2.2 细胞培养与转染小鼠原代肺泡上皮II 型细胞的分离培养参照文献[7]进行。 依据Lipo‑fectamine®2000 转染的要求,细胞分别转染PI3KsiRNA 和SGK1siRNA。转染72 h 后,细胞于含或不含200 mU/L 胰岛素的培养液中培养2 h。细胞分组:对照组(无胰岛素)、胰岛素组、PI3KsiRNA(胰岛素+PI3K p85αsiRNA)组和SGK1siRNA(胰岛素+SGK1siRNA)组。
2.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)收集小鼠麻醉后,打开胸腔,用腰麻导管做气管置管,用1 mL 生理盐水行支气管肺泡灌洗,共3次,回收率达80%~90%。将收集的BALF 取少许置于白细胞计算盘进行细胞计数,在高倍镜下计数除上皮细胞及红细胞外的所有细胞。BALF以14 000×g离心10 min后沉淀的细胞再加1 mL RPMI-1640细胞培养液,摇匀后取20 μL做细胞计数,最终取4×104个细胞用Diff-Quik染色,观察总细胞数和中性粒细胞数。
2.4 AFC 测定游离右肺组织并行气管插管,注入100% 氮气后,将含0.15 g/L Evans blue 标记的5% 白蛋白等渗生理盐水(5 mL/kg)经导管灌入小鼠肺组织,机械通气1 h 后测定肺泡腔内Evans blue 标记的白蛋白浓度,根据公式计算:AFC(%)=(Vi−Vf)/Vi×100%,Vf=Vi×Pi/Pf[8]。Vi:起始注入肺泡内液体量;Vf:最后肺泡内液体量;Pi:起始注入的Evans blue 标记的白蛋白浓度;Pf:最后Evans blue 标记的白蛋白浓度。
2.5 免疫荧光实验小鼠肺组织10% 福尔马林固定,石蜡包埋切片,厚度5 μm。10% 胎牛血清水浴箱封闭1 h 后,PBS 洗净3次后,分别与α-ENaC、β‑ENaC 和γ-ENaC Ⅰ抗4 ℃冰箱孵育过夜。PBS 冲洗3 次,再与荧光标记Ⅱ抗(Alexa Fluor 594 goat anti‑rabbit IgG)37 ℃水浴箱孵育1 h,PBS 冲洗3次。加DAPI 染核,PBS 冲洗3 次,甘油封片,荧光显微镜下观察拍照。
2.6 RT-PCR 实验提取细胞总RNA,根据RT-PCR试剂盒要求,进行逆转录合成cDNA。PCR 条件:预变性94 ℃1 min;变性94 ℃30 s,退火53 ℃(α -ENaC)、53 ℃(β-ENaC)、55 ℃(γ-ENaC)和55 ℃(βactin)30 s,72 ℃1 min,30 个循环。PCR 引物序列如下:α-ENaC 的上游引物为5'-TACCCTTCCAAG‑TATACACAGC-3',下游引物为5'-CAGAAGGAGA‑CTCCGAATTAGT-3',产物509 bp;β-ENaC 的上游引物为5'-GCTAAAGAGCTAGCAGTAATGG-3',下游引物为5'-CTGGTGTTTGTTATGCCTAGAG-3',产物406 bp;γ-ENaC 的上游引物为5'-GGATCCTGAGAGAGA‑ATCATGC-3',下游引物为5'-GTGTCCAGCTAT‑GCCCTTTAAC-3',产物363 bp;β-actin的上游引物为5'-GTACAACCTTCTTGCAGCTCCT-3',下游引物为5'-ACAGGATTCCATACCCAGGAAG-3',产物871 bp。PCR 产物在1.0% 琼脂糖上进行凝胶电泳。Quantity One 软件分析目的条带密度,以目的条带与β-actin比值作为结果进行比较。
2.7 Western blot 实验提取细胞膜蛋白,经10%SDS-PAGE 分离后,转移至硝酸纤维素膜上。5% 脱脂奶粉封闭1 h 后,分别与抗体(α-ENaC 和γ-ENaC,1∶300;β‑ENaC、SGK1 和磷酸化SGK1,1∶500;PI3K p85α,1∶1 000;β-actin,1∶2 500)4 ℃孵育过夜。用Tris 缓冲液+Tween 20(TBST)洗膜3 遍,然后加入辣根过氧化物酶标记的Ⅱ抗室温孵育1.5 h,ECL 显色。凝胶成像系统扫描,Quantity One 软件分析目的条带吸光度(A)值,以目的条带与β-actin比值作为结果进行分析。
3 统计学处理
用SPSS 16.0 统计软件分析处理结果。所有计量数据均以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 BALF中细胞总数和中性粒细胞数变化
与对照组比较,ALI 组BALF 中细胞总数和中性粒细胞数显著增加(P<0.05);与ALI 组比较,胰岛素组BALF 中细胞总数和中性粒细胞数显著降低(P<0.05);与胰岛素组比较,PI3KsiRNA干预后BALF中细胞总数和中性粒细胞数显著升高(P<0.05),见表1。
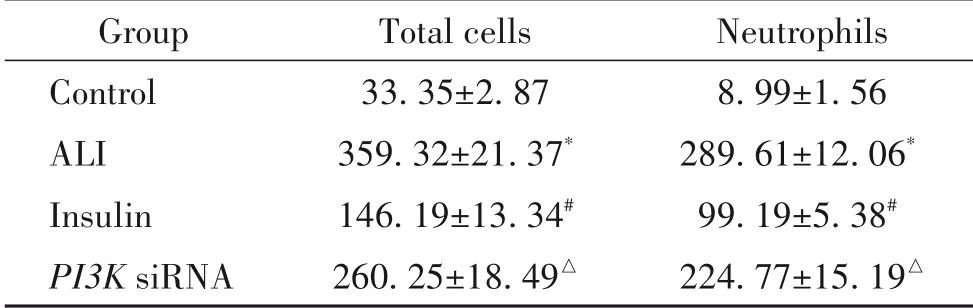
表1 BALF中细胞总数和中性粒细胞数变化Table 1.Numbers of total cells and neutrophils in BALF(×104 L−1.Mean±SD. n=6)
2 AFC情况
与对照组比较,模型组AFC显著降低(P<0.05);胰岛素治疗后,AFC 显著提高(P<0.05);PI3KsiRNA干预后,AFC 较胰岛素组显著降低(P<0.05),见图1。

Figure 1.Changes of alveolar fluid clearance in each group.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs ALI group;△P<0.05 vs insulin group.图1 各组肺泡液体清除率变化情况
3 免疫荧光染色检测肺组织ENaC蛋白表达
与对照组比较,ALI 组α-ENaC、β-ENaC 和γ-ENaC 的表达减少;胰岛素组α-ENaC、β-ENaC 和γ-ENaC 的表达增加;PI3KsiRNA 干预后α-ENaC、β-ENaC和γ-ENaC的表达减少,见图2。
4 肺泡上皮细胞ENaC mRNA表达
与胰岛素组比较,PI3KsiRNA 组中α-ENaC、β-ENaC 和γ-ENaC 的mRNA 表达显著降低(P<0.05);与胰岛素组比较,SGK1siRNA 组中α-ENaC、β-ENaC和γ-ENaC 的mRNA 表达显著降低(P<0.05),见图3及表2。
5 肺泡上皮细胞ENaC蛋白表达
与胰岛素组比较,PI3KsiRNA 组中α-ENaC、β-ENaC 和γ-ENaC 的蛋白表达显著降低(P<0.05);与胰岛素组比较,SGK1siRNA 组中α-ENaC、β-ENaC 和γ -ENaC 的蛋白表达显著降低(P<0.05),见图4及表2。

表2 各组肺泡上皮钠通道的表达Table 2.Expression of ENaC in each group(Mean±SD. n=6)
6 肺泡上皮细胞SGK1磷酸化水平
与对照组比较,胰岛素组SGK1磷酸化水平显著升高(P<0.05);与胰岛素组比较,PI3KsiRNA 干预后SGK1磷酸化水平显著降低(P<0.05);与胰岛素组比较,SGK1siRNA 干预后SGK1 磷酸化水平显著降低(P<0.05),见图5。
讨 论

Figure 2.The expression of ENaC in lung tissues of each group detected by immunofluorescence staining.The scale bar=50 μm.图2 免疫荧光染色检测各组肺组织ENaC表达

Figure 3.The mRNA levels of α-,β- and γ-ENaC in alveolar epithelial cells of each group detected by RT-PCR.图3 RT-PCR 检测各组肺泡上皮细胞中ENaC 的mRNA 表达水平

Figure 4.The protein levels of α-,β- and γ-ENaC in alveolar epithelial cells of each group detected by Western blot.图4 Western blot 检测各组肺泡上皮细胞中ENaC 的蛋白表达水平
ALI/ARDS 由于多种肺内外病因导致肺泡-微血管屏障结构破坏,肺微血管通透性增高,从而肺泡腔内富含蛋白质的大量水肿液聚集及透明膜形成,导致呼吸窘迫及顽固性低氧血症,近10 年住院死亡率达45%[9-10]。LPS 通过激活大量的促炎症因子启动NF-κB 转录因子,释放炎症介质,大量中性粒细胞聚集,释放活性氧,引起肺泡上皮-毛细血管屏障损伤和渗漏,引起肺水肿,是模拟ALI/ARDS 的常用方法[11]。本研究中通过LPS 建立小鼠ALI 模型,ALI 模型组中BALF 的总粒细胞数和中细胞数显著增加,AFC 降低,提示肺泡-微血管屏障破坏及炎症因子聚集,与人的ALI/ARDS病理生理表现相似。

Figure 5.The phosphorylation of SGK1 in alveolar epithelial cells detected by Western blot.Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs insulin group.图5 肺泡上皮细胞SGK1磷酸化水平
SGK1是一种丝氨酸/苏氨酸蛋白激酶,其激活依赖于羧基末端疏水基序中Ser422 通过胰岛素作用PI3K信号通路的磷酸化实现[12]。本实验中胰岛素作为激活PI3K/SGK1 通路的有效途径,同时还具有抗炎作用[13]。本实验中胰岛素的剂量不会引起血糖的较大差异的变化,这在前期研究中已经得到证实[5]。在胰岛素作用后,炎症细胞的渗出减少,AFC 增加,肺组织损伤减少。PI3KsiRNA 干预后,明显抑制了胰岛素引起的保护效应,炎症细胞渗出显著增加,说明胰岛素激活的PI3K信号通路减轻LPS诱导的肺损伤,保护了小鼠肺组织。
AFC 被认为是排除肺泡腔内过多水肿液的有效途径[14-15]。本研究中PI3KsiRNA 干预后,AFC 也较胰岛素组显著降低,提示PI3K 信号通路能有效促进AFC,减轻肺水肿。肺泡ENaC 是肺泡腔内钠离子跨膜转运,完成钠水转运过程的限速步骤,为排除肺泡腔内过多的水肿液提供源动力,是调节AFC 的最重要途径和治疗肺水肿的一个靶点[16-17]。ENaC 由α、β和γ 3 个亚基组成,主要表达于肺泡上皮II 型细胞。研究表明,α-ENaC、β-ENaC和γ-ENaC是AFC中必不可少的通道蛋白[18-19]。本研究结果显示LPS 诱导的ALI 模型组中,α-、β-和γ-ENaC 蛋白的表达显著下降,而胰岛素治疗后能显著上调α-、β-和γ-ENaC 的蛋白表达,同时PI3K siRNA 干预后,α-、β-和γ-ENaC蛋白的表达显著下降,其变化与AFC 一致,提示胰岛素激活PI3K 信号通路与ENaC 介导的AFC 存在联系。为进一步探讨参与AFC 调节的PI3K 信号通路下游的作用靶点,我们进行了体外实验,结果显示,胰岛素干预后,α-、β-和γ-ENaC mRNA 和蛋白表达显著增加,其变化与胰岛素诱导的SGK1磷酸化水平升高一致。PI3KsiRNA 和SGK1siRNA 分别干预后,α-、β-和γ-ENaC 的mRNA 和蛋白表达显著降低,其变化与SGK1 磷酸化水平降低一致,说明α-、β-和γ-ENaC 表达的变化是通过PI3K/SGK1 信号通路实现的,与AFC 变化趋势一致。 这证明了激活PI3K/SGK1 信号通路通过上调ENaC 各亚基的表达,从而促进AFC,减轻肺水肿,保护小鼠肺组织。本研究结果揭示PI3K 信号通路的下游靶点SGK1 与ENaC 的关系及在ALI/ARDS中调控AFC的分子基础,是在我们前期研究基础上的深入和完善[2,5],这对明确疾病的发病机制具有实际价值。
ALI/ARDS近10年病死率居高不下,目前仍然缺乏相对有效的治疗措施。本研究的结果提示激活PI3K/SGK1 信号通路通过上调ENaC 各亚基的表达,增强AFC,减轻肺组织损伤,可作为治疗ALI/ARDS的潜在有效靶点,对疾病治疗提供了参考资料。
