血尿素氮、D-二聚体联合胆固醇测定对重度子痫前期的辅助诊断价值
2022-02-16刘倩梁婵玉朱燕莉黄晓燕孙波赵卫华
刘倩,梁婵玉,朱燕莉,黄晓燕,孙波,3,赵卫华
1.深圳市第二人民医院产科,广东 深圳 518035;2.河池市人民医院产科,广西 河池 547000;3.暨南大学附属深圳市宝安区妇幼保健院产科,广东 深圳 518035
子痫前期是妊娠特有疾病,其特征是新发高血压和器官功能障碍或新陈代谢异常[1],严重威胁母儿健康和安全。相关学者们一直致力于探索并阐明子痫前期的发病机制,旨在发现高质量的预测和预防手段,但由于子痫前期具有多因素、多机制、多通路发病的性质,迄今为止,仍缺乏治疗的可靠手段。如何运用在临床实践中可轻易获得的实验室指标对子痫前期进行预测及病情严重程度评估仍有待研究。本研究通过分析广西壮族自治区河池市人民医院分娩的子痫前期患者的资料,探讨血尿素氮、D-二聚体联合胆固醇测定对评估子痫前期病情严重程度的辅助诊断价值。
1 资料与方法
1.1 一般资料 选取2016年1月至2020年9月在广西壮族自治区河池市人民医院住院分娩的393例孕妇为研究对象,根据中国妊娠期高血压疾病诊治指南(2020版)[2]子痫前期诊断标准分为子痫前期组185例和重度子痫前期组208例。纳入标准:(1)单胎妊娠;(2)诊断明确、临床资料完整且随访可靠者。排除标准:(1)年龄≤15岁;(2)慢性高血压合并妊娠;(3)慢性肾炎合并妊娠;(4)妊娠合并其他严重内科疾病;(5)产后失访、临床资料不完整者。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求并获得河池市人民医院伦理委员会批准。
1.2 方法
1.2.1 一般临床资料收集 查阅病历,收集孕妇年龄、民族、孕产次、入院时体质量指数(BMI)、收缩压、舒张压、终止妊娠孕周等资料。
1.2.2 实验室检测指标收集 收集两组孕妇入院当天(药物治疗前)外周静脉血的实验室检测(血常规、肝肾功能、凝血功能及血脂检测)参数,主要包括白细胞(WBC)、血红蛋白(HGB)、血小板计数(PLT)、总蛋白(TP)、白蛋白(ALB)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、血尿素氮(BUN)、血肌酐(CREA)、尿酸(UA)、估算的肾小球滤过率(eGFR)、乳酸脱氢酶(LDH)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、D-二聚体(D-D)、甘油三酯(TG)、胆固醇(CHOL)、血钙(Ca)等指标。
1.3 统计学方法 采用SPSS23.0统计学软件及易侕软件2.2版(www.empowerstats.com)进行统计学数据分析。服从正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用t检验;不服从正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验。采用Logistic回归及受试者工作特征曲线(ROC)分析相关实验室指标的诊断价值。所有检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组孕妇的一般临床资料比较 两组孕妇的民族、孕产次、入院时BMI比较差异均无统计学意义(P>0.05);重度子痫前期组孕妇的平均年龄、终止妊娠孕周小于子痫前期组,收缩压、舒张压高于子痫前期组,差异均有统计学意义(P<0.05),见表1。
表1 两组孕妇的一般临床资料比较[±s,例(%)]
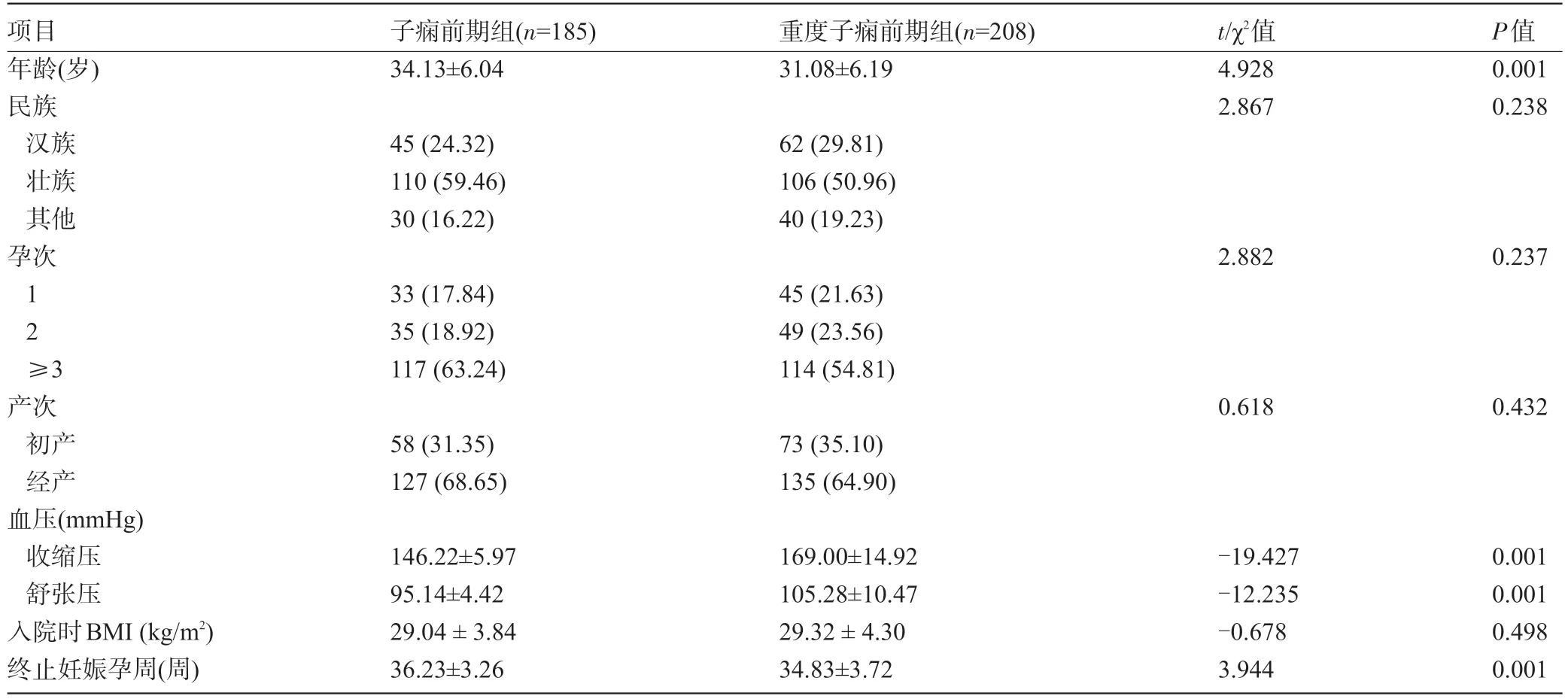
表1 两组孕妇的一般临床资料比较[±s,例(%)]
注:1 mmHg=0.133 kPa。
项目年龄(岁)民族汉族壮族其他孕次1 2≥3产次初产经产血压(mmHg)收缩压舒张压入院时BMI(kg/m2)终止妊娠孕周(周)子痫前期组(n=185)34.13±6.04 45(24.32)110(59.46)30(16.22)33(17.84)35(18.92)117(63.24)58(31.35)127(68.65)146.22±5.97 95.14±4.42 29.04±3.84 36.23±3.26重度子痫前期组(n=208)31.08±6.19 62(29.81)106(50.96)40(19.23)45(21.63)49(23.56)114(54.81)73(35.10)135(64.90)169.00±14.92 105.28±10.47 29.32±4.30 34.83±3.72 t/χ2值4.928 2.867 2.882 0.618-19.427-12.235-0.678 3.944 P值0.001 0.238 0.237 0.432 0.001 0.001 0.498 0.001
2.2 两组孕妇的实验室指标比较 两组孕妇的外周静脉血HGB、ALP、FIB、APTT比较差异均无统计学意义(P>0.05),重度子痫前期组孕妇的PLT、TP、ALB、eGFR、Ca低于子痫前期组,而WBC、ALT、AST、BUN、CREA、UA、LDH、D-D、TG、CHOL高于子痫前期组,差异均有统计学意义(P<0.05),见表2。
2.3 重度子痫前期影响因素的Logistic回归分析 以是否重度子痫前期为结局变量,表2中两组比较差异有统计学意义的实验室指标为暴露变量进行多因素Logistic回归分析,结果显示,外周血BUN、D-D及CHOL是重度子痫前期的独立影响因素(P<0.05),见表3。
表2 两组孕妇的实验室指标比较[±s,M(Q1,Q3)]
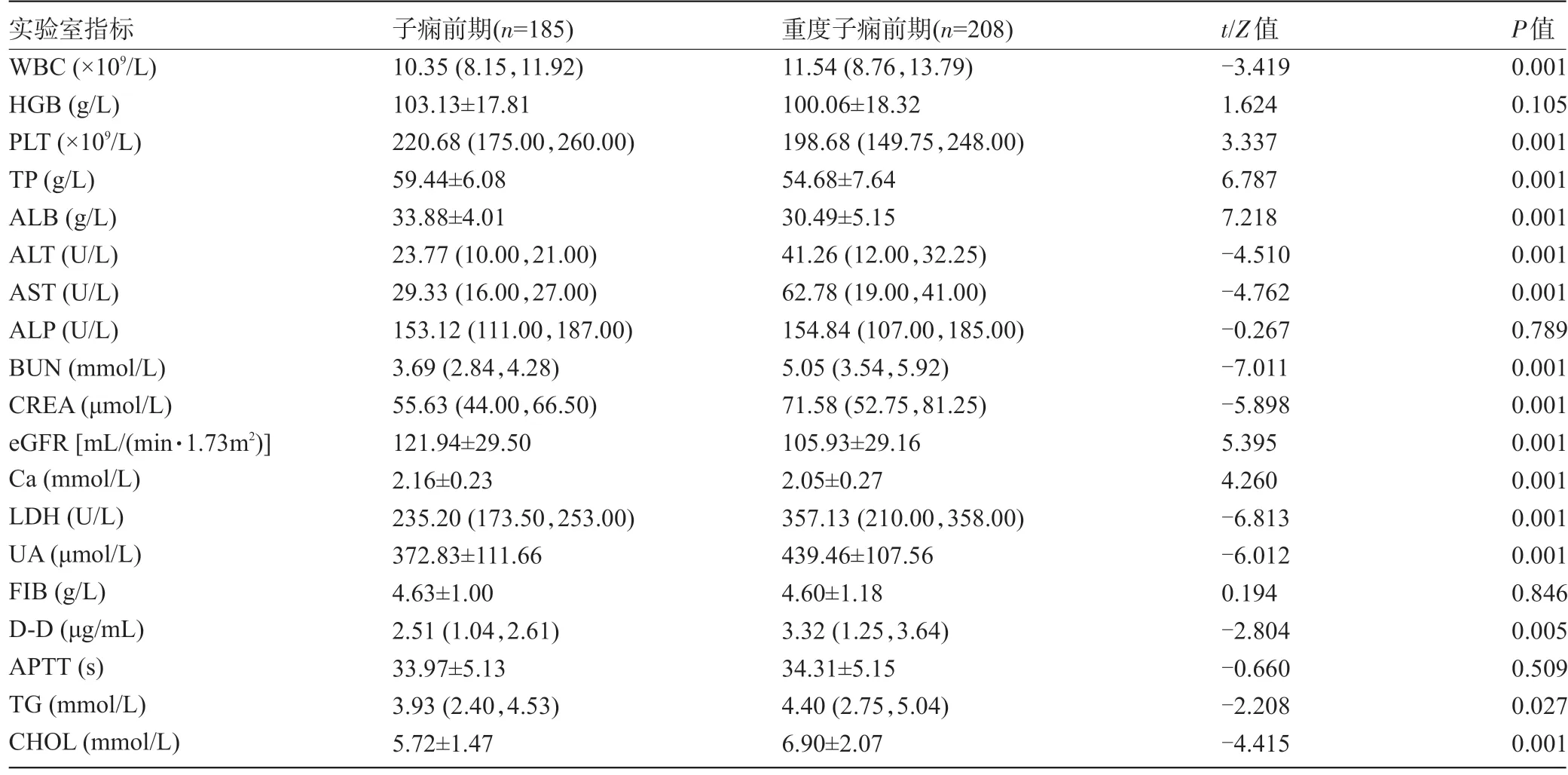
表2 两组孕妇的实验室指标比较[±s,M(Q1,Q3)]
实验室指标WBC(×109/L)HGB(g/L)PLT(×109/L)TP(g/L)ALB(g/L)ALT(U/L)AST(U/L)ALP(U/L)BUN(mmol/L)CREA(μmol/L)eGFR[mL/(min·1.73m2)]Ca(mmol/L)LDH(U/L)UA(μmol/L)FIB(g/L)D-D(μg/mL)APTT(s)TG(mmol/L)CHOL(mmol/L)子痫前期(n=185)10.35(8.15,11.92)103.13±17.81 220.68(175.00,260.00)59.44±6.08 33.88±4.01 23.77(10.00,21.00)29.33(16.00,27.00)153.12(111.00,187.00)3.69(2.84,4.28)55.63(44.00,66.50)121.94±29.50 2.16±0.23 235.20(173.50,253.00)372.83±111.66 4.63±1.00 2.51(1.04,2.61)33.97±5.13 3.93(2.40,4.53)5.72±1.47重度子痫前期(n=208)11.54(8.76,13.79)100.06±18.32 198.68(149.75,248.00)54.68±7.64 30.49±5.15 41.26(12.00,32.25)62.78(19.00,41.00)154.84(107.00,185.00)5.05(3.54,5.92)71.58(52.75,81.25)105.93±29.16 2.05±0.27 357.13(210.00,358.00)439.46±107.56 4.60±1.18 3.32(1.25,3.64)34.31±5.15 4.40(2.75,5.04)6.90±2.07 t/Z值-3.419 1.624 3.337 6.787 7.218-4.510-4.762-0.267-7.011-5.898 5.395 4.260-6.813-6.012 0.194-2.804-0.660-2.208-4.415 P值0.001 0.105 0.001 0.001 0.001 0.001 0.001 0.789 0.001 0.001 0.001 0.001 0.001 0.001 0.846 0.005 0.509 0.027 0.001
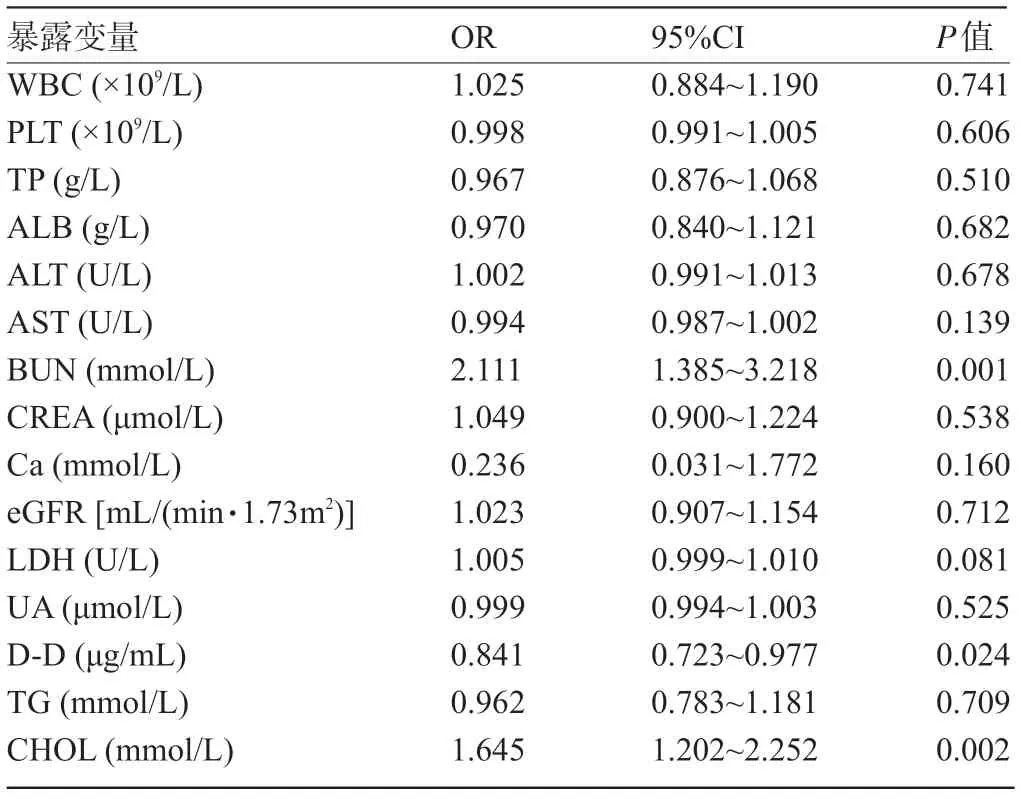
表3 重度子痫前期影响因素的Logistic回归模型分析
2.4 外周血BUN、D-D及CHOL检测对重度子痫前期的辅助诊断价值 外周血BUN、D-D及CHOL单独检测诊断重度子痫前期的AUC分别为0.705、0.583、0.673,三者联合检测诊断重度子痫前期的AUC为0.811,见表4和图1。

表4 BUN、D-D、CHOL单独及联合检测对重度子痫前期的诊断价值
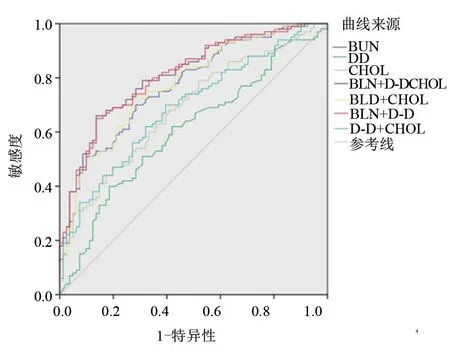
图1 BUN、D-D、CHOL单独及联合诊断重度子痫前期的ROC曲线
3 讨论
子痫前期是导致孕产妇和围产儿发病率及死亡率增高的主要原因之一,从子痫前期进展至重度子痫前期往往缺乏特异性预测及筛查指标。当孕妇出现器官功能受累或胎盘-胎儿并发症时临床已错过最佳干预时机。如何准确评估已患子痫前期孕妇的病情严重程度并进行精准的早期干预治疗对改善母婴预后非常重要。研究表明,器官功能障碍和新陈代谢异常往往先于临床症状出现,这无疑对重度子痫前期的预测和筛查提供了一条新思路[1]。本研究通过回顾性分析重度子痫前期和子痫前期孕妇的多个实验室指标,以筛选重度子痫前期的独立影响因素,有助于在子痫前期进展到重度子痫前期之前进行干预处理,进而改善妊娠结局。
3.1 BUN与重度子痫前期 BUN是蛋白质代谢的主要最终产物,BUN的浓度取决于摄入食物的蛋白质含量、体内蛋白质的分解代谢以及肾脏的排泄能力。当食物摄入和体内分解代谢相对稳定时,BUN浓度取决于肾脏的排泄能力。子痫前期的病理生理改变是全身小动脉痉挛,肾小动脉痉挛会诱发肾小球肿胀、肾血流量减少、肾小球滤过率下降,这些都可能导致肾脏排泄功能障碍,肾脏代谢产物如BUN、UA、CREA清除受阻,表现为BUN、UA、CREA水平升高[3],可用作子痫前期发病的预测指标[4-5]。本研究数据分析结果显示,重度子痫前期组患者BUN、UA、CREA水平分别为5.05(3.54,5.92)mmol/L、(439.46±107.56)μmol/L、71.58(52.75,81.25)μmol/L,子痫前期组分别为3.69(2.84,4.28)mmol/L、(372.83±111.66)μmol/L、55.63(44.00,66.50)μmol/L,重度子痫前期组的BUN、UA、CREA水平高于子痫前期组,差异均有统计学意义(P<0.05),但进行Logistic回归分析仅发现BUN水平升高是重度子痫前期的独立危险因素(OR=2.111,95%CI:1.385~3.218,P<0.001)。诊断实验显示单独BUN测定对重度子痫前期的辅助诊断价值中等(AUC 0.705,敏感度80.98%,特异度53.37%),最佳诊断阈值为4.450 mmol/L。
3.2 D-D与重度子痫前期 纤维蛋白溶解和凝血系统的激活是子痫前期疾病的生理病理基础之一[6]。D-D是最简单的纤维蛋白降解产物,主要反映纤维蛋白溶解功能,D-D升高说明机体处于高凝状态和/或继发性纤维蛋白溶解亢进。99%~100%的孕妇孕中晚期血浆DD水平高于正常参考值[7],这使得它成为怀孕期间的非特异性检测指标。由于D-D水平随着妊娠的进展呈现不断升高的趋势,因而很难界定不同孕期血浆D-D正常参考值范围,故既往对D-D的研究多聚焦在确定不同妊娠时期D-D的参考区间[8-9]。近年来,随着对子痫前期研究的不断深入,血浆D-D水平与子痫前期乃至其他病理妊娠的关系被全方面的挖掘与剖析。LUCENA等[10]探讨了血浆D-D水平用于预测及甄别子痫前期的价值,研究发现,子痫前期患者孕晚期血浆D-D水平高于正常妊娠者,且子痫前期患者血浆D-D峰值出现得更早(30~34周),而正常妊娠者多于孕35~40周出现D-D峰值,认为借此现象可一定程度区分子痫前期和正常妊娠。BABOOLALL等[11]则进一步对子痫前期进行了病情严重程度分层,测定了重度子痫前期与子痫前期患者早、中、晚孕期血浆D-D水平,结果显示晚孕期重度子痫前期患者血浆D-D水平为2.02(1.67,2.46)μg/mL,高于子痫前期患者的1.16(1.00,1.35)μg/mL,P<0.001。ROC分析显示D-D预测重度子痫前期发生的AUC为0.828,敏感度为94%,特异度为67%,切割值为1.65μg/mL。推测可能是由于重度子痫前期患者血管内皮功能障碍,较低浓度的纤溶酶原激活剂抑制物2型(plasminogen activator inhibitor type 2,PAI-2)上调了纤溶系统,导致循环中D-D浓度上升,并认为D-D水平检测对重度子痫前期具有诊断价值。本研究结果显示重度子痫前期组的血浆D-D水平为3.32(1.25,3.64)μg/mL,高于子痫前期组的2.51(1.04,2.61)μg/mL,差异有统计学意义(P=0.005)。进行Logistic回归分析发现血浆D-D水平升高是重度子痫前期的保护因素,但其具体保护机制尚需要更多的综合研究来阐明。诊断实验发现单独D-D测定对重度子痫前期的辅助诊断价值不高,AUC为0.583,敏感度为51.93%,特异度为62.69%,最佳诊断阈值为1.605μg/mL。
3.3 CHOL与重度子痫前期 妊娠的典型表现是血清中CHOL和TG的升高,而雌激素、孕激素和催乳素水平的升高则推动了这一水平的升高[12]。这种脂质的生理性增加在妊娠期间起着至关重要的作用,可为胎儿生长和胎盘组织类固醇合成提供脂肪酸库。然而,研究表明,血脂异常不仅会增加心血管疾病的风险,而且还会导致不良妊娠结局并诱发子痫前期,是妊娠期高血压和重度子痫前期的危险因素[13-14]。WANG等[15]检测到血CHOL水平重度子痫前期孕妇>轻度子痫前期孕妇>妊娠期高血压孕妇,与正常孕妇相比,差异均有统计学意义(P<0.01,P<0.01,P<0.05),其认为脂质代谢水平可用于评估妊娠期高血压疾病的严重程度。本研究结果显示重度子痫前期组的血CHOL水平为(6.90±2.07)mmol/L,高于子痫前期组的(5.72±1.47)mmol/L,差异有统计学意义(P<0.001),进行Logistic回归分析发现外周血CHOL水平升高是重度子痫前期的危险因素,与既往学者们[13,15]的研究结论一致。诊断实验发现单独CHOL测定对重度子痫前期的辅助诊断价值中等(AUC=0.673,敏感度59.52%,特异度66.67%),最佳诊断阈值为5.945 mmol/L。
3.4 BUN、D-D、CHOL联合检测对重度子痫前期的辅助诊断价值 本研究显示,重度子痫前期组的BUN、D-D和CHOL水平与子痫前期组显著不同,在区分子痫前期和重度子痫前期患者方面具有潜在的辅助诊断价值,但单一指标检测价值不高。联合检测对重度子痫前期的辅助诊断价值优于单一指标检测,联合BUN、D-D和CHOL检测对子痫前期病情严重程度的辅助诊断价值最高(AUC=0.811,95%CI:0.749~0.873),特异度为86.42%,敏感度为66.00%;其次为联合BUN及CHOL检测(AUC=0.802,95%CI:0.740~0.864),特异度为85.71%,敏感度为64.76%。
综上所述,对广西壮族自治区孕妇群体进行外周血BUN、D-D和CHOL联合测定对子痫前期疾病严重程度的判断有一定的辅助诊断价值,且成本低、测量简单、数据易得,方便在医疗资源匮乏的地区推广应用。在临床实践中对子痫前期孕妇进行期待治疗时,一旦监测到这3个指标异常需再次全面评估病情,警惕疾病进展。本研究不足之处在于:单中心、回顾性研究,随访时间跨度较大,尚未能完全摒除药物因素的干扰,存在较多的混杂因素。将来可通过多中心联合、扩大样本量,统一随访时间,建立并完善各地区子痫前期孕妇孕产期血检参数变化,为子痫前期的预测、预防、病情严重程度评估及治疗提供有价值的线索。
