绿原酸的提取及其抑菌作用研究进展
2022-02-16张豫丹许自成李俊领段旺军马晓寒
张豫丹,许自成,李俊领,段旺军,马晓寒,贾 玮,*
(1.河南农业大学烟草学院,河南 郑州 450002;2.四川中烟工业有限责任公司,四川 成都 610000)
绿原酸(Chlorogenic acid,CHA)又名咖啡鞣酸、咖啡单宁酸,是由咖啡酸的1位羧基与奎宁酸的3位羟基脱水缩合形成的一种多酚类物质[1-2],结构式如图1所示。CHA广泛存在于自然界中,我国的CHA资源十分丰富,目前已经发现有将近70种植物来源,在金银花、杜仲、烟草中含量较高,是一种极性有机物[3-7]。
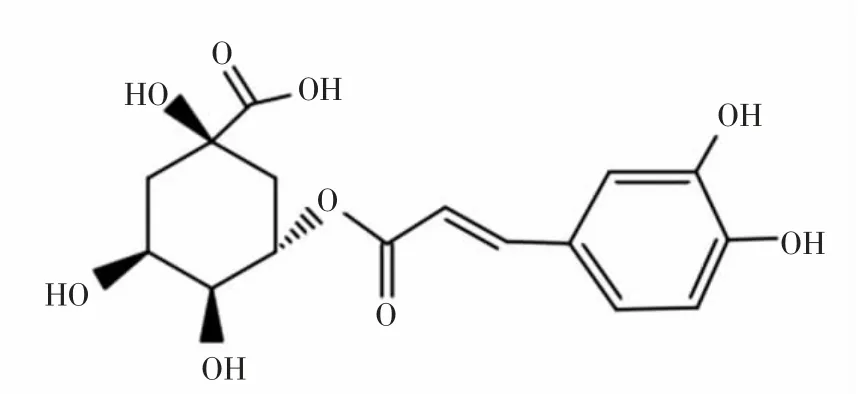
图1 绿原酸化学结构Fig.1 Chemical structure of cholorogenic acid
现阶段,国内外有关CHA的研究主要集中在提取方法和药理作用两方面。本文概述了CHA的生物活性和国内外植物源CHA的主要提取方法,以及CHA在抑菌方面的作用和机理,以期拓展植物源CHA在果蔬保鲜和植物抑菌方面的应用。
1 绿原酸的生物活性
CHA有“植物黄金”之美誉[8],具有抗氧化、抗肿瘤、降血压、降血糖、护肝等多种生物活性[9-14]以及天然提取的安全性,不仅可作为营养保健品和食品添加剂[10-11],还可用于开发抗癌、抗艾滋病等药物[15]。基于其广阔的市场前景和经济价值,CHA受到诸多研究者的关注,其生物学功能也不断被挖掘。
1.1 抗氧化作用
CHA具有很强的自由基清除能力,能有效清除二苯基苦基肼(DPPH)自由基,因此可作为抗氧化剂被广泛用于日用化工和生物制药领域。贺金娜[16]研究发现,40.09μg/mL的苹果源CHA可清除50%的DPPH自由基,并且显著提高大豆油的氧化稳定性,其抗氧化效果与人工合成抗氧化剂特丁基对苯二酚(TBHQ)相当,且高于VC的抗氧化效果;周丽丽[17]发现,CHA有助于提高大鼠体内肠道的抗氧化能力。Wu[18]采用DPPH自由基清除法和铁离子抗氧化能力法(FRAP)对金银花提取物的抗氧化活性进行表征,结果表明,CHA在抗氧化活性中发挥主要作用,且抗氧化活性与CHA含量呈正相关,可以认为CHA含量越高金银花提取物抗氧化活性也越强。Rui等[19]用CHA和壳聚糖形成的CHA-壳聚糖偶联物在抗氧化、清除超氧阴离子自由基、抑制脂质过氧化等方面表现更为优异,且能有效保护细胞免受H2O2诱导的氧化损伤,这可能是因偶联物在水中或有机溶剂中的溶解度提高所导致。
1.2 抗肿瘤作用
CHA是植物中一种重要的次生代谢产物,可以通过多种途径产生抗肿瘤作用,如调节细胞周期、诱导细胞凋亡、抑制细胞生长等,被认为是有效抗肿瘤的天然提取物。研究表明,CHA能通过降低血管内皮生长因子(VEGF)的表达,下调Notch1的配体Delta的mRNA相对表达量,阻碍Notch1信号通路传导来调控非小细胞肺癌凋亡[20]。周佳彬等[21]发现CHA可诱导胶质瘤细胞上调p53和Bax表达、下调Livin和Bcl-2表达,最终激活Caspase-3蛋白酶活性,从而促进胶质瘤细胞凋亡。此外,鉴于其良好的护肝作用,CHA与抗肿瘤化疗药物联合应用,不仅能够减少化疗药物的肝毒性,还能够发挥协同抗肿瘤作用。日本学者早在1993年就指出,天然存在于植物中的CHA能够抑制4-硝基喹啉-1-氧化物(4-NQO)诱导的舌癌,可用于舌癌的化学预防[22]。张洁琼等[23]采用白介素13体外诱导巨噬细胞M2极化模型,检测M2标记CD206(特异性标志物)的表达时发现,与单独使用拉帕替尼相比,其与CHA联合抑制CD206表达效果更好,证明拉帕替尼与CHA的组合能够抑制巨噬细胞M2极化,抑制乳腺癌的转移。
1.3 抗病毒作用
CHA是我国传统中草药中具有抗病毒活性的重要成分之一。清热解毒药材金银花,一般以CHA含量作为其品质控制标准[24]。邢娜[25]的研究表明,天然化合物CHA体外抗猪繁殖与呼吸综合征病毒(PRRSV)的作用较强,可能是通过直接灭活PRRSV并抑制PRRSV引起的细胞凋亡来实现的。CHA体外抑制肠道病毒71型(EV71)的效果也十分显著,主要是通过干扰EV71复制早期2AmRNA的表达和蛋白翻译进而实现抗病毒作用[26]。此外,CHA还可通过抑制乙型肝炎病毒(HBV)的DNA复制来抵抗HBV[27]。
1.4 降血压、降血糖作用
CHA除了具有抗氧化、抗肿瘤、抗病毒的作用外,还具有降血压、降血糖的作用[28-29]。李旭等[30]的研究表明,从杜仲叶中提取的CHA对原发性高血压大鼠具有较强的降压作用,其降压效果明显而稳定,因此CHA作为有降压效果的保健品成分具有广阔的应用前景。宋越冬等[31]采用响应面法提取荞麦叶中的CHA进行体外降糖试验,结果表明其对α-葡萄糖苷酶的活性有抑制作用,其半抑制浓度(IC50)为0.161 4 mg/mL,体外降糖能力较好,可作为开发降血糖药物的原料。
2 植物绿原酸的提取方法
CHA是植物在有氧呼吸过程中经莽草酸途径形成的一种苯丙素类物质[32],具有多种植物来源,主要存在于忍冬科忍冬属(Lonicera)和菊科蒿属(Artemisia)中,尤其在杜仲、金银花、葵粕、咖啡中含量较高。杜仲(Eucommia ulraoides)、牛篣(Arctium lappa)和红花烟草(Nicotiana tobacco)的叶中富含CHA,其中杜仲叶中CHA含量可达2%~5%[33-36]。忍冬(Lonicera japonica)的根、茎、叶、花中均可提取出CHA,且花蕾中的CHA含量最高[37]。目前,国内主要从杜仲、金银花、烟草等植物中提取CHA,而国外则更多地以咖啡作为提取CHA的原料[38-40]。综合国内外绿原酸的提取方法,可大致分为水提法、有机溶剂提取法、微波辅助提取法、超声波辅助提取法等(参见表1)。
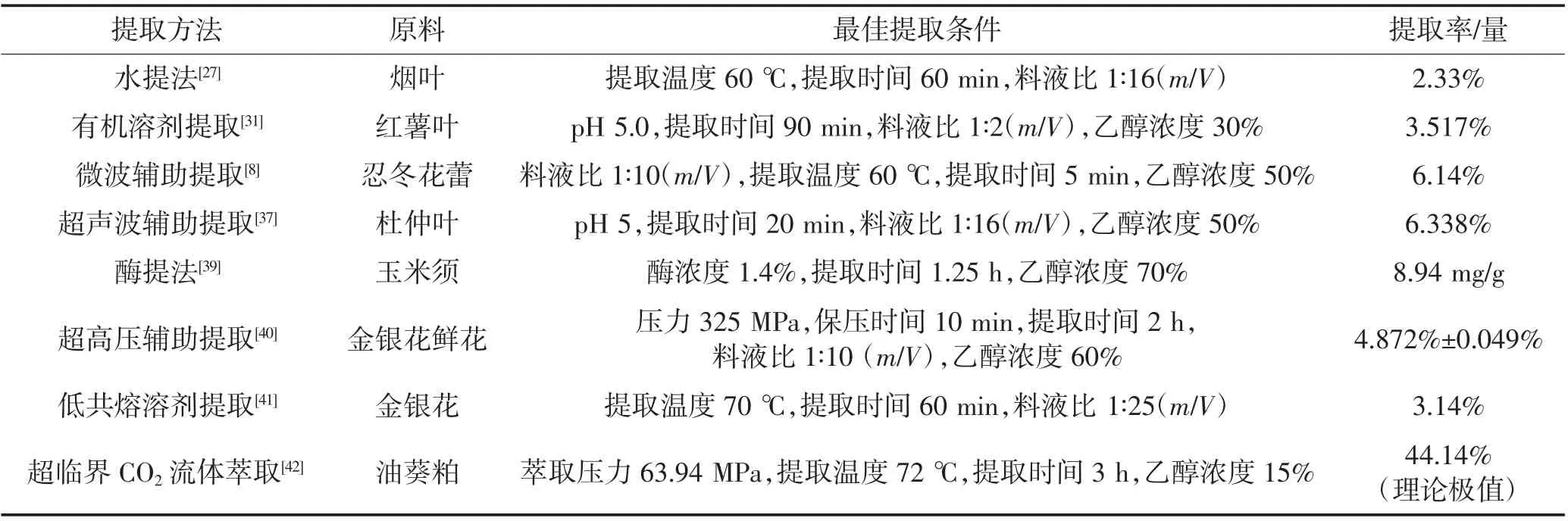
表1 植物绿原酸的提取方法及提取率Table 1 Extraction methods and extraction rates of chlorogenic acid in plants
2.1 水提法
CHA为极性较大的酚酸,依据相似相溶原理,可用水作为溶剂提取CHA。Jokic'等[43]用亚临界水(指将水加热至沸点以上,临界点以下,并控制系统压力使水保持为液态的水)提取烟草中的CHA,发现温度过高、提取时间过长会导致CHA的分解。与此结果相一致,Jeszka-Skowron等[44]的研究表明,温度、时间、料液比等提取条件对植物绿原酸的提取量均有显著的影响,采用响应面(RSM)法优化茶叶CHA的水提法后,CHA含量最高可达(6.84±0.68)μg/mL。以蒸馏水为溶剂从烟叶中提取CHA的最佳优化方案为:提取温度60℃,料液比1∶16(g/mL),提取时间60 min,此条件下的得率可达2.33%[45]。从经济效益和环境安全方面考虑,水是最理想的溶剂。Lekar等[38]也认为,相较于有机溶剂,使用亚临界水从生咖啡豆中提取CHA的方法更为经济安全。但值得注意的是,水的高沸点会导致提取物中杂质过多,造成CHA分离困难。
2.2 有机溶剂提取法
有机溶剂提取法是利用CHA易溶于有机溶剂的特性,采用甲醇、乙醇等有机溶剂进行提取的方法。研究表明,以甲醇作为溶剂可从废咖啡渣中提取出抗氧化剂酚类化合物CHA[39];采用30%乙醇提取4次姜科叶片后,CHA产量为(234±25)mg/100 g[42];用乙酸乙酯萃取发酵植物提取物(FPE)也可获得CHA[46]。相较于水煎煮法,乙醇回流法可显著提高金银花中CHA的提取率,前者仅为2.6%,而后者高达7.2%[47]。Li等[48]通过正交试验优化红薯叶中CHA的提取方法,当提取工艺为酒精浓度30%,料液比1∶2(m/V),pH 5.0,萃取4次,蒸馏90 min,提取率可达3.517%,且此种提取工艺获得的提取物与天然状态相近,有利于进一步纯化。此外,付饶等[49]研究了不同有机溶剂对废次烟叶CHA提取率的影响,结果表明,乙醇的提取效果优于甲醇,这可能是由于CHA含有羟基和邻二酚基,与乙醇的极性较接近,使得CHA在乙醇中的溶解度更大。
2.3 微波辅助提取法
微波辅助萃取(MAE)主要利用微波的电磁效应和热效应,产生高度局部化的温度和压力,使得目标化合物以更快的速度溶出,进而从各种基质中萃取目标化合物。研究表明,采用MAE法从金银花中提取的CHA产量可高达(32.52±1.31)mg/g[50];使用MAE从忍冬花蕾中回收CHA,产率在5 min内就达到了6.14%[8]。与常规的热回流萃取等单一提取法相比,MAE从植物原料中提取CHA耗时更短,效率更高。Zhao等[51]比较了浸提法、索氏提取法和MAE对红枣果实酚类化合物的提取条件,发现MAE消耗时间更短、所用溶剂更少、提取温度更低,运用高效液相色谱法(HPLC)检测提取物的组分,结果显示CHA含量可达(0.65±0.08)μg/g。通过比较不同溶剂对MAE提取率的影响,发现当溶剂为乙醇、甲醇和水时,CHA的提取率分别为4.95%±0.07%、5.6%±0.14%、8.4%±0.28%[40]。由此可知,水的提取率显著高于乙醇、甲醇,这可能是由于水的介电常数和极性高于乙醇、甲醇,更有助于微波的吸收,使得CHA能够更快更好溶出。
2.4 超声波辅助提取法
超声波辅助提取的原理是利用超声波击碎细胞壁,使细胞内组分渗漏到溶液中,从而更快达到分离目的。Pandey等[52]用RSM对超声辅助提取大黄根茎中酚类化合物的方法进行优化后,仅超声提取30 min CHA的浓度就达到了26.68 mg/g。Chen等[53]也使用RSM优化了超声辅助提取黑枸杞中酚类化合物的方法,在最佳条件下,CHA含量为(6.48±0.16)mg/g。以上研究结果表明,超声波辅助提取法不仅缩短了提取时间,还提高了提取效率。考虑到经济效益和环境安全,使用水取代提取效率更高的甲醇作为萃取溶剂,发现超声辅助萃取获得的产率几乎是热回流萃取方法的两倍,且能减少溶剂消耗,增加CHA在水中的溶解度[54]。超声波辅助水提取过程的优化,解决了大多数文献中提到的常规技术缺点,包括提取过程中萃取时间过长导致的CHA降解,提取温度过高造成的能源浪费,CHA纯度偏低引起的回收率低等问题,因此,超声波辅助水提工艺可以作为传统提取工艺的环保安全经济替代方案。
2.5 其他提取方法
除上述提取方法外,绿原酸的提取还涉及到索氏提取法、超高压提取法、热回流提取法、酶提取法、超临界CO2提取等方法。Liu等[55]探索了一种基于离子液体的酶辅助提取CHA的方法,这种方法主要通过纤维素酶分解细胞壁来减少传质壁垒进而获得高提取率,相较于其他常规提取技术,这种新颖的提取方法在产率和效率方面更具优势。金银花经超高压处理后用乙醇提取,最佳提取条件下的CHA提取率可达4.872%±0.049%[56],优于超声提取法和热回流提取法,且能耗低,耗时短。分子印迹技术是一种可以在形状、大小和化学功能上创建与模板分子互补的特定空腔从而达到吸附作用的一种技术。有学者基于此技术开发了一种新型亲水磁性分子印迹纳米粒子进行选择分离和测定水溶性CHA,这种方法更为有效地从具有相似官能团的共存化合物(咖啡酸、没食子酸等)中分离出CHA[57]。此外,低共熔溶剂提取、中空纤维固相微萃取和超临界CO2流体萃取法也可用于植物CHA的提取[41,58-60]。目前低共熔溶剂提取尚未大面积开展应用,中空纤维固相微萃取也仍在起步阶段,超临界CO2流体萃取得率虽高,但技术工业化研究较为薄弱且设备昂贵,发展较为缓慢[61]。
3 植物绿原酸的抑菌作用
3.1 植物绿原酸的抑菌效果
CHA是一种对病原菌有抑制作用的次生代谢物质,对多种病原菌表现出不同的抑制效果(表2)。Lou等[62]研究结果表明,从牛篣叶中提取的CHA对痢疾志贺氏菌、肺炎链球菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌均有一定的抑制作用,且对痢疾志贺氏菌和肺炎链球菌的抑菌效果最明显。李瑞国等[63]提取了甘薯不同器官的CHA,对金黄色葡萄球菌和大肠杆菌进行抑菌试验,发现甘薯各器官CHA提取液对金黄色葡萄球菌的抑菌效果优于大肠杆菌,并进一步确定2.4×106mg/L的甘薯叶提取物的抑菌效果等同于2.5%的庆大霉素(是一种氨基糖苷类药物,主要用于治疗细菌感染)。CHA对病原菌的抑制作用受浓度限制,低浓度的CHA抑菌效果不明显,而在高浓度下,CHA可完全抑制病原菌的孢子萌发和菌丝生长[64]。Cai等[65]的研究表明,CHA对苹果果汁中的酸酯环酸杆菌的最低抑菌和最低杀菌浓度分别为2 000 mg/L和4 000 mg/L。此外,CHA与抗菌剂联用能有效提高抑菌效果,如3 000 mg/L的CHA与痢菌净、阿米卡星粘菌素等抗菌药联用能增强抗菌药对鱼源链球菌的抑菌作用[66]。
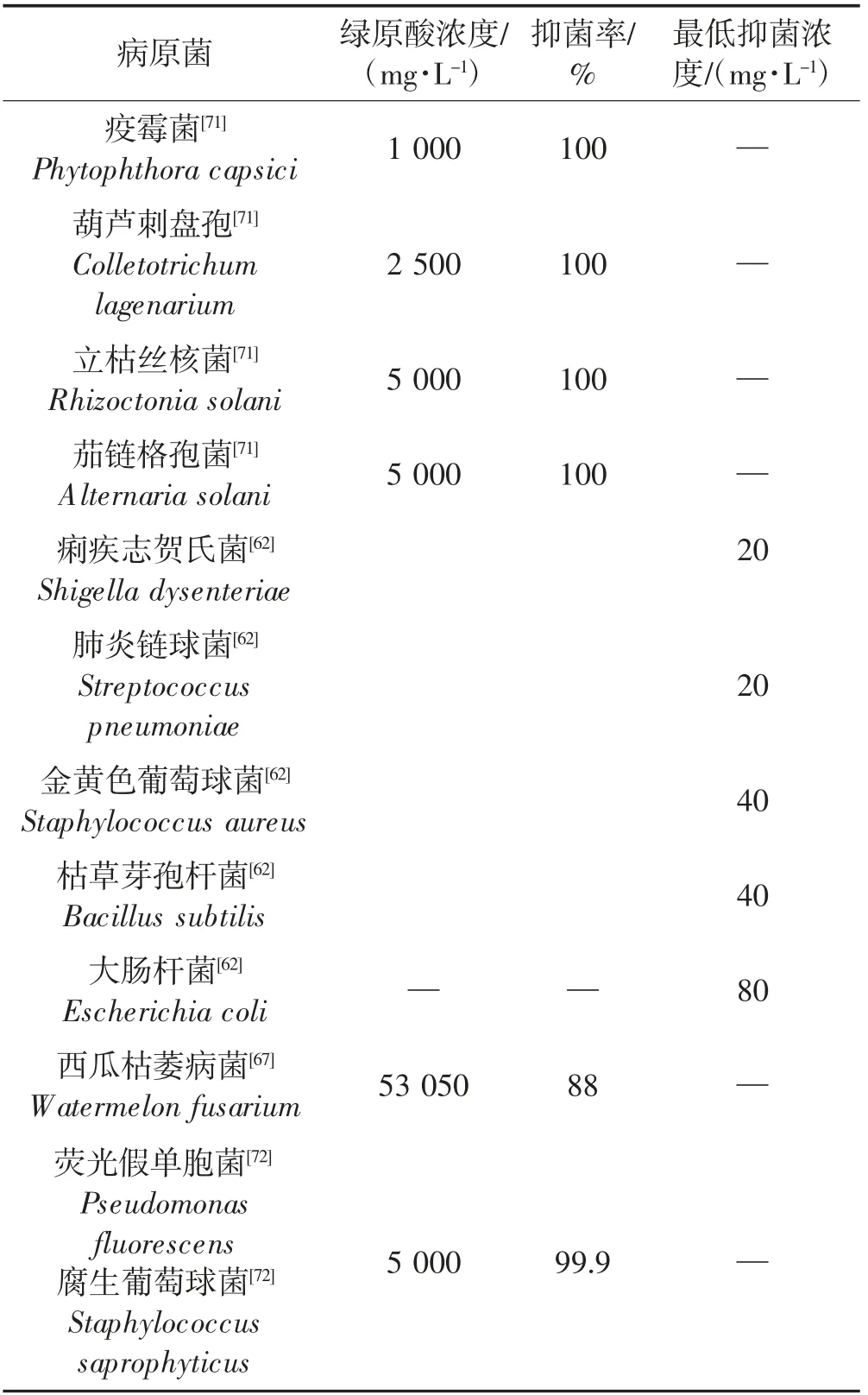
表2 植物绿原酸的抑菌效果Table 2 Antibacterial effects of chlorogenic acid in palnts
CHA除了对金黄色葡萄球菌、大肠杆菌等细菌发挥抑菌活性外,对一些果实真菌也表现出良好的抑菌效果。Terry等[67]的研究表明,随着CHA浓度的升高,草莓更不容易受到灰葡萄孢菌的感染。CHA在果实采后病害防控方面也表现出积极作用,150 mg/L的CHA可有效降低梨黑斑病、水蜜桃青霉病、油桃绿霉病、樱桃以及番茄灰霉病的病情指数[68]。Jiao等[69]研究表明,25~150 mg/L的CHA能显著降低桃果实对青霉菌的感病率,同时遭受病原菌侵袭的苹果果实CHA含量也比健康果实高出5倍,这意味着CHA在抵御病原菌入侵的过程中发挥着重要作用。此外,从茼蒿中提取的CHA能显著降低西瓜枯萎病菌菌丝的干重和鲜重,且该抑制作用与CHA浓度呈正相关[70]。
3.2 绿原酸抑菌机理
众多研究均表明,CHA在生物学抑菌功能方面表现出明显的优势。近年来,有关CHA抑菌机理的研究也有了一定的进展,大致可分为两个方面(图2)。一方面,CHA直接抑制病原菌生长。CHA可通过破坏病原菌细胞膜结构发挥抗菌活性[62,73],如诱导铜绿假单胞菌(P.aeruginosa)细胞表面凹陷和外膜成分脱落,增加细胞内膜通透性,导致胞内蛋白泄漏[74]。与常见的由活性氧(ROS)积累引起细菌凋亡的机制相反,CHA通过消耗细菌细胞内的ROS,影响信号传导通路,进而导致细菌凋亡[75]。另有研究表明,牛篣CHA在进入细菌细胞后直接作用于DNA,导致双螺旋结构被破坏,改变细菌DNA构象,影响细菌生理功能,最终导致细菌死亡[76]。
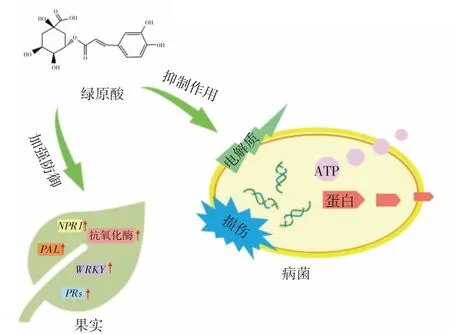
图2 绿原酸抑菌机理Fig.2 Antibacterial mechanism of cholorogenic acid
另一方面,CHA通过提高果实的抗病性抵御病原菌的侵袭。CHA可充当信号分子,通过提高果实的抗氧化酶活性、降低氧化酶活性,来抑制病原菌的入侵和扩展。CHA能够激活水杨酸的信号通路,诱导桃果实对青霉菌的抗性[69]。焦文晓[68]认为CHA可调控PAL基因在桃果实中的表达,诱导NPR1和WRKY相关转录因子的激活以及促进下游PRs蛋白相关基因转录水平的上调,进而激发桃果实对病原体的防御反应。此外,CHA还可以通过抑制交替糖的生物合成来抑制交替链霉菌在番茄果实中定殖,从而提高番茄的抗病性[77]。综上所述,CHA不仅可通过破坏细胞膜结构、改变DNA构象直接影响病原菌正常生理代谢,还可以通过调节代谢途径、基因表达、信号通路等诱导果实对病原菌产生防御反应。
4 结论与展望
CHA作为一种水溶性酚类化合物,展现出较强的生物活性和多种药理作用,在食品、化工、医药和营养保健等方面应用十分广泛。近年来,有关CHA的研究已成为天然产物领域的研究热点,研究内容主要涵盖CHA药学功能的开发、天然CHA的提取技术以及CHA对果蔬的保鲜抑菌等方面。鉴于CHA在提取、果蔬抑菌方面的研究进展,今后有关植物源CHA的研究可从以下几方面开展:①以往植物源CHA提取主要采用提取率偏低的单一溶剂浸提法,近年来国内外倾向于采用复合提取方法提高CHA的提取率。尽管近年来发展了微波辅助、超声波辅助等复合提取方法,但对提取率的提高幅度有限,且CHA有多种异构体,还含有不饱和双键等活性基团,传统提取方法易破坏CHA中的活性基团。为高效提取和富集CHA,有学者基于分子模拟技术制备出一种能够特异性识别CHA的分子印迹聚合物,这种分子印迹聚合物有望成为新的研究热点。今后可在前人研究基础上继续探寻更加经济安全、简单高效的植物CHA提取方法,使之能够大规模应用于工业提取分离;②植物源CHA能有效抑制由真菌引起的果实腐败变质,这意味着CHA可有效保鲜,提高采后果蔬的品质,抑制采后病害的发生,有望成为一种新的采后果蔬贮藏方法;③CHA在植物病菌防治方面的研究鲜有报道,鉴于植物源CHA对细菌、果实真菌等良好的抑菌效果,以及茼蒿提取CHA能够抑制西瓜枯萎病菌的佐证,未来可拓展其在更多植物病菌防治上的应用,助力于研发新型植物源杀菌剂,也为发展生态、绿色和环境友好型的病菌防治手段提供理论基础。
