奶嚼克中产脂肪酶微生物的筛选研究
2022-02-16李春冬郭元晟王福超徐伟良苏圣琳郭梁
李春冬郭元晟王福超徐伟良苏圣琳郭梁
(1.锡林郭勒职业学院,内蒙古 锡林浩特 026000;2.锡林郭勒生物工程研究院,内蒙古 锡林浩特 026000; 3.锡林郭勒盟食品科学与检测实验中心/锡林郭勒盟农畜产品检验检测中心,内蒙古 锡林浩特 026000; 4.延边大学农学院食品与生物科学系,吉林 延吉 133002)
蒙古族传统乳制品源远流长,其风味独特且营养丰富,是蒙古族饮食和祭祀中不可缺少的一部分,因此在中国传统乳制品的加工历史上占有重要地位[1]。蒙古族传统奶食品种类繁多,其中以卓禾(俗称嚼克)、浩乳德(俗称奶豆腐)、楚拉(俗称奶渣子)等为代表的锡林郭勒传统奶制品工艺独特、加工方法独具一格,曾是历代皇家奶食的上等贡品[2]。蒙古族传统乳制品含有大量的碳水化合物、蛋白质、脂肪、维生素以及钙、磷、锌等营养成分,而且碳水化合物、蛋白质、脂肪等经自身含有的微生物发酵分解,可产生风味肽、脂肪酸、乙醛、双乙酰、丁二酮等多种风味营养物质,是天然的佳品[3]。其中,双乙酰是构成高脂类乳制品中奶油香味的主要组分,而乙醛、丁二酮、挥发性脂肪酸等则是酸奶中主要呈香物质[4]。在蒙古族传统乳制品中深受大众喜欢的嚼克,也被人称为嚼口,蒙语名字为“卓禾”。嚼克是一种口感略酸的高油脂类乳制品,其独特的食用口感和高营养价值,使其成为蒙古族人民招待宾客的必备食物。蒙古族发酵奶嚼克和下层凝乳是利用环境中的微生物进行低温自然发酵而成,保留了乳品自身风味的同时还可以含有丰富的微生物资源[4]。
脂肪酶(Lipase EC 3.1.1.3),也被称为三酰基甘油水解酶,此物质可以进行直接水解等反应,产生甘油和脂肪酸或者进行催化水解,从而生成甘油一酯,如酯化、酯交换、醇解和酸解反应等[5,6]。在传统生产方法中脂肪酶是从动物或者植物的组织中分离获得,而目前脂肪酶主要通过微生物发酵的方式来生产。由于微生物的种类多且繁殖快,其产生的脂肪酶具有较广的pH适应性、底物特异性以及选择性。微生物脂肪酶一般为胞外酶,适合在工业中生产,因此微生物发酵是工业生产脂肪酶的主要来源[7]。近年来,虽有学者对油脂污染的土壤、饭店下水道、污水和盐湖等环境中分离得到产脂肪酶菌株[8-10],但对蒙古族传统奶嚼克中脂肪酶的分离和酶活测定还未见报道。为加强开发利用本地区微生物资源,本实验通过对蒙古族传统奶嚼克样品中脂肪酶菌株进行分离、筛选、脂肪酶活性检测及鉴定,以期为本地区产脂肪酶微生物更广泛的应用提供一定基础。
1 实验器材与试剂
1.1 材料
对锡林浩特市传统发酵工艺制作的奶嚼克进行采样,共采集5份奶嚼克作为实验样品。
1.2 培养基及乳化液
营养琼脂加罗丹明B培养基:三丁酸甘油酯10mL,蛋白胨(Peptone)10g,牛肉膏(Beef Extract)3g,琼脂(Agar)18g,氯化钠(NaCl)5g,罗丹明B 0.5g,蒸馏水1000mL,121℃灭菌30min。
液体种子培养基:氯化钠(NaCl)5g,蛋白胨(Peptone)10g,牛肉膏(Beef Extract)3g,蒸馏水1000mL,121℃灭菌30min。
摇瓶发酵培养基:酵母膏0.5%,(NH4)2SO40.5%,KH2PO40.2%,NaCl 0.3%,MgSO47H2O 0.05%,橄榄油2%,121℃灭菌30min。
乳化液:将40g聚乙烯醇加入800mL蒸馏水中,置于沸水浴中加热,搅拌至聚乙烯醇全部溶解,溶液自然冷却后定容至1000mL(使用前使用干净双层纱布进行过滤)。取150mL上述聚乙烯醇滤液,加入50mL橄榄油后用匀浆机剪切6min,剪切后乳白色溶液即为聚乙烯醇乳化液。
1.3 试剂
三丁酸甘油酯(C15H26O6),上海阿拉丁生化科技股份有限公司;罗丹明B(C28H31CIN2O3),上海阿拉丁生化科技股份有限公司;橄榄油(甘油三油酸酯),国药集团化学试剂有限公司;TaKaRa快速提取试剂盒(Code No.9164),宝生物工程(大连)有限公司;其余试剂均为国产分析纯。
1.4 仪器与设备
2720 Thermal Cycler PCR扩增仪,美国BIO-RAD公司;Eppendorf 5418R Centrifuge高速台式离心机,德国艾本德股份公司;Nanodrop 2000c核酸蛋白质分析仪,美国Thermo Fisher公司;琼脂糖凝胶电泳系统,北京六一生物科技有限公司。
2 实验方法
2.1 产脂肪酶微生物的分离及初筛
采用罗丹明B法进行产脂肪酶微生物筛选,在无菌条件下称取1g奶嚼克样品,将称取的奶嚼克样品加入生理盐水中进行梯度稀释(10-1、10-2、10-3、10-4、10-5)。使用移液枪分别吸取0.1mL稀释液均匀涂布于营养琼脂培养基。将涂布的筛选营养琼脂培养基平板置于37℃恒温培养箱中培养2~3d。培养完成后观察菌落周围是否有透明光圈出现,由此初步筛选出产脂肪酶菌株,将有透明光圈的菌株进行分离并保存。
2.2 产脂肪酶微生物的复筛
将初筛获得的产脂肪酶菌株接种于液体种子培养基中,37℃摇床培养24h,转速设置为150r·min-1。将培养结束后的菌液移至15mL的离心管中,8000r·min-1,4℃低温离心10min,上清液为粗酶液,取上清液进行酶活力测定。
2.3 脂肪酶活力测定
实验具体步骤参照GB/T 23535-2009的规定对脂肪酶进行酶活测定[11]。每个样品取2个100mL三角瓶,取磷酸缓冲盐溶液5mL与底物溶液4mL,在水浴锅中将反应体系溶液预热5min后立即加入1mL粗酶液混匀,将得到的混匀溶液加入15mL的乙醇溶液进行终止反应。之后利用0.05mol·L-1的NaOH标准溶液分别滴定酶作用后的空白对照和底物溶液,根据消耗的碱溶液体积计算其酶活力,脂肪酶制剂的酶活力计算公式:
式中,X为样品的酶活力,U·mL-1;V1为滴定样品时消耗氢氧化钠标准溶液的体积,mL;V2为滴定空白时消耗氢氧化钠标准溶液的体积,mL;C为氢氧化钠标准溶液浓度,mol·L-1;0.05为氢氧化钠标准溶液浓度换算系数;50为0.05mol·L-1氢氧化钠溶液1mL相当于脂肪酸50μmol;N1为样品的稀释倍数;1/15为反应时间15min,以1min计;所得结果表示至整数。
2.4 产脂肪酶菌株分子鉴定
产脂肪酶菌株DNA提取使用Takara快速提取试剂盒。取5μL菌悬液液于灭菌的PCR管,加入50μL Lysis Buffer for Microorganism to Direct PCR于PCR管中并吸打混匀,将PCR管置于金属浴上80℃加热15min,加热后8000rpm低速离心5min得到上清液,上清液即为产脂肪酶菌株总DNA。
产脂肪酶菌株分子鉴定选用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1495R(5′-CTACGGCTACCTTGTTACGA-3′);反应体系为20μL,模板DNA 1μL、引物各1μL、Easy Taq PCR Super Mix 10μL、无菌ddH2O 7μL;PCR反应条件为94℃预变性5min,94℃变性1min,58℃退火1min,72℃延伸2min,共30循环,72℃末端延伸10min。
扩增产物用1.2%的琼脂糖进行凝胶电泳检测,条带清晰的扩增产物进行测序(北京睿博生物科技有限公司),测序结果经过拼接后,在美国国立生物技术信息中心(National center for biotechnology formation. NCBI)进行BLAST同源比对。
3 结果与分析
3.1 产脂肪酶微生物的分离纯化
经过营养琼脂加罗丹明B培养基上分离的产透明圈菌落,如图1所示,根据菌落颜色、边缘是否整齐、表面是否光滑等筛选菌株,每个样品分离5株菌株,共获得25株产脂肪酶菌株,并命名为J2-1~J6-5。

图1 产脂肪酶菌株菌落形态
3.2 产脂肪酶微生物的复筛
对在蒙古族传统乳制品奶嚼克中筛选的25株产脂肪酶菌株进行复筛,通过测定粗酶液酶活力的大小,进一步检测菌株产脂肪酶活力,测定结果如表1所示。
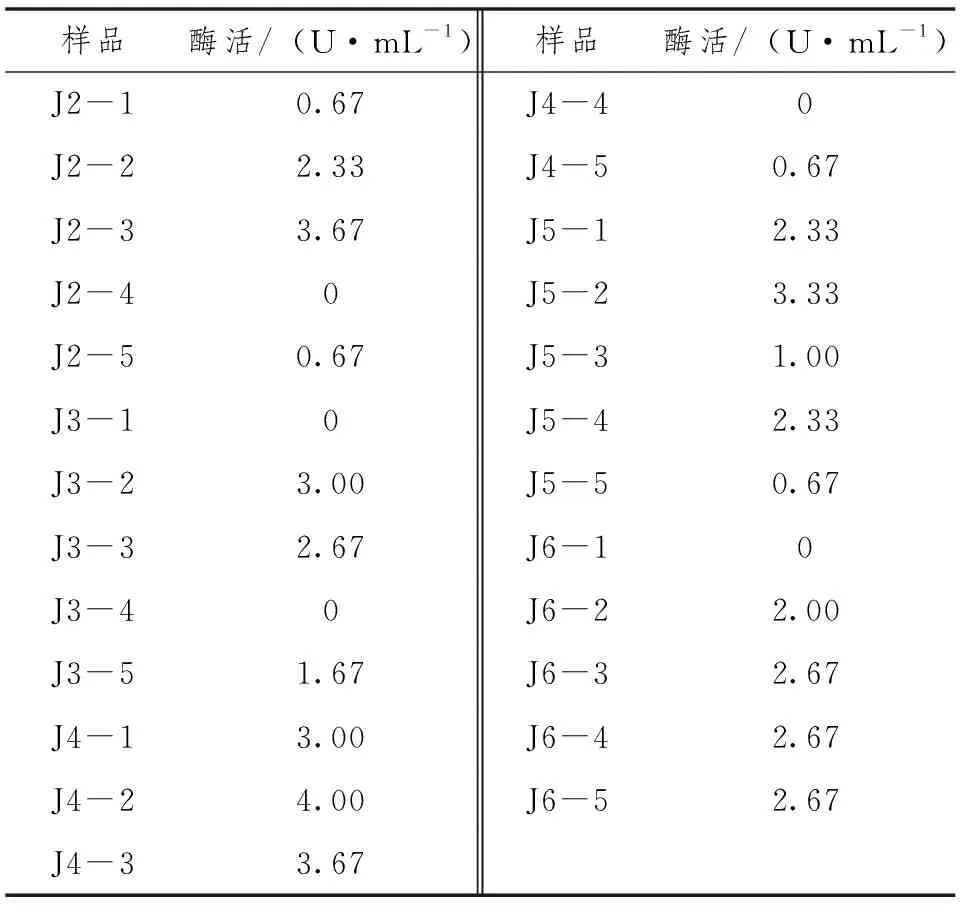
表1 产脂肪酶菌株酶活测定结果
由表1可知,奶嚼克样品中产脂肪酶菌株的脂肪酶活范围在0~4.00U·mL-1,其中菌株J4-2酶活最高为4.00U·mL-1。刘晓丽等[12]在甘肃省兰州市区餐馆周边采集油脂污染土壤样品初筛的1株高产中性脂肪酶枯草芽孢杆菌,其初始酶活最高为3.74U·mL-1,又进行正交试验对菌株产酶条件进行优化,优化后的产脂肪酶酶活可达到7.58U·mL-1,比优化前提高了2.03倍。而本实验菌株酶活普遍偏低,其原因可能为菌株产脂肪酶发酵条件未进行优化。
3.3 产脂肪酶微生物的分子鉴定
将筛选出的25株具有产脂肪酶能力的单菌株(J-2-1~J-6-5)提取基因组DNA,PCR扩增后获得的片段长度为1500bp,如图2所示;16S rDNA共鉴定出17个单菌株,Ident均为100%,但有8株菌未鉴定出,鉴定结果如表1所示。其中,荧光假单胞菌(Pseudomonas fluorescens)6株、粪肠球菌(Enterococcus faecalis)4株、乳酸乳球菌(Lactococcus lactis)2株、隆德假单胞菌(Pseudomonas lundensis)1株、液化沙雷氏菌(Serratia liquefaciens)1株、单不动杆菌(Acinetobacter soli)1株、奥斯陆莫拉菌(Moraxella osloensis)1株、金黄色葡萄球菌(Staphylococcus aureus)1株。其中J-4-2为鲍曼不动杆菌(Acinetobacter baumannii)。
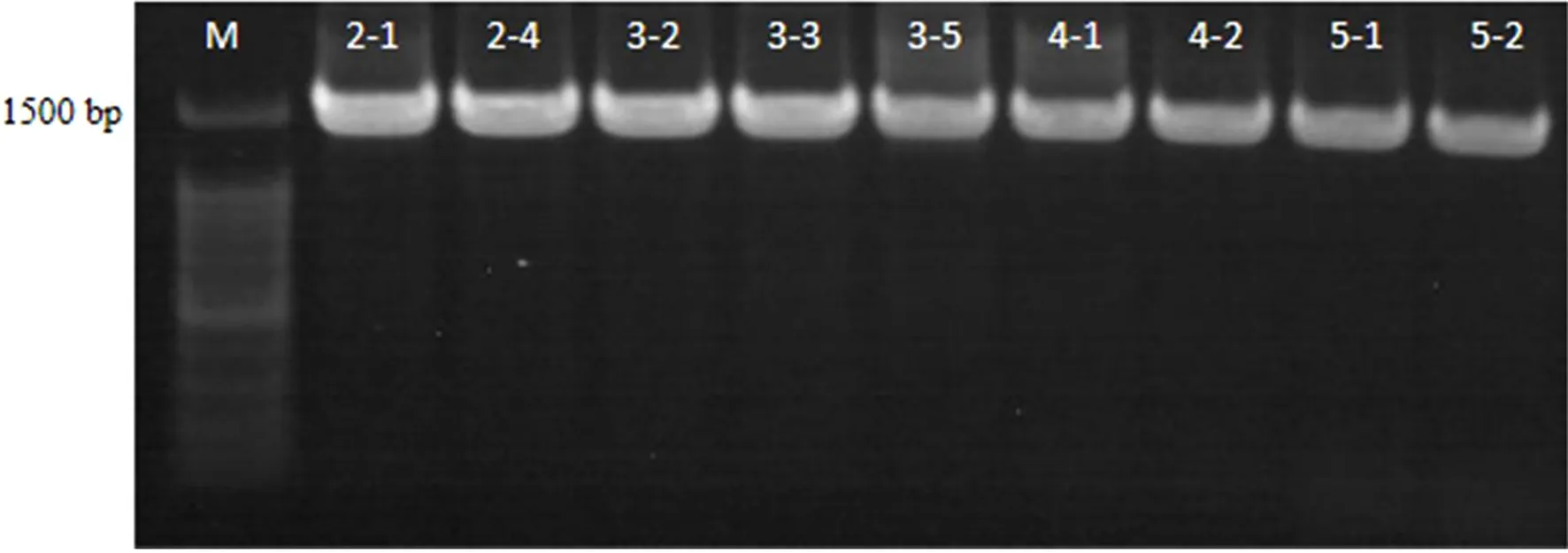
图 2 部分产脂肪酶菌株的电泳结果注:M为Marker。

表2 产脂肪酶细菌分子鉴定结果
荧光假单胞菌(Pseudomonas fluorescens)形状呈杆状且有鞭毛,归属于假单胞菌属,是革兰氏阴性需氧菌。荧光假单胞菌不但能产生抗生素、水解酶等代谢产物而且能分泌出色素,且发出黄绿色荧光。研究表明,假单胞菌属和液化沙雷菌是原料乳中的优势嗜冷菌,其分泌的耐热脂肪酶可分解乳脂中的脂肪,产生游离脂肪酸[13]。逄淑召等[14]利用正交实验法对荧光假单胞菌(Pseudomonas fluorescence 5963)进行了产脂肪酶条件筛选。张维清[15]在原料奶中分离得到1株产耐热脂肪酶的荧光假单胞菌,并研究了其酶学特征,建立了一种高效可行的分离纯化策略。
鲍曼不动杆菌(Acinetobacter baumannii)是一种专性需氧型革兰氏阴性杆菌,其在自然界中分布十分广泛[16]。庞建勋[17]对自然界中多种含油脂植物样本中分离筛选的不动杆菌属菌株进行脂肪酶活的测定和脂肪酶的分离纯化;郑小梅[18]对在冰川土样中分离获得的不动杆菌进行脂肪酶和特异折叠酶的功能以及两者之间的蛋白互作进行研究。
4 结论与讨论
本实验通过罗丹明B平板法和脂肪酶活力测定从5份奶嚼克中筛选出25株产脂肪酶菌株,测得菌株酶活范围在0~4.00U·mL-1,其中J-4-2酶活力最高达到4.00U·mL-1,经序列分析鉴定其为鲍曼不动杆菌。通过序列分析共鉴定出17株菌株,其中荧光假单胞菌(Pseudomonas fluorescens)6株、粪肠球菌(Enterococcus faecalis)4株、乳酸乳球菌(lactococcus lactis)2株、隆德假单胞菌(Pseudomonas lundensis)1株、液化沙雷氏菌(Serratia liquefaciens)1株、单不动杆菌(Acinetobacter soli)1株、奥斯陆莫拉菌(Moraxella osloensis)1株、金黄色葡萄球菌(Staphylococcus aureus)1株,均为报道过的产脂肪酶菌株。因此通过研究表明,蒙古族传统奶嚼克制品不仅含有大量营养成分和特色风味营养物质,更蕴含着能够生产脂肪酶的微生物资源,这为丰富脂肪酶资源库提供了有利条件,不但可以改善传统奶嚼克的口感风味,还可以开发利用至工业方面。脂肪酶作为第3大酶制剂,在工业化应用方面非常广泛。而本研究所筛选的产脂肪酶菌株,可用于生产特色低脂乳制品,为迎合市场趋势和满足消费者喜好及健康要求方面,提供新的开发潜能,同时也可以进一步开发为商业化脂肪酶制剂,具有广泛的工业开发应用前景。
