18个茶树菇菌株的亲缘关系分析及农艺性状评价
2022-02-16王洪秀陈绪涛魏云辉
王洪秀,孙 鹏,安 颖,胡 佳,陈绪涛,李 菁,魏云辉
(1江西省农业科学院农业应用微生物研究所,南昌 330200;2浙江大学生命科学学院生物物理研究所/教育部生物系统稳态与保护重点实验室,杭州 310058)
0 引言
茶树菇(Agrocybe aegerita)属于球盖菇科(Strophariaceae)田头菇属(Agrocybe),分布于中国的江西、福建、云南、浙江及四川等地。因其生长宿主的多样性及形态上的细微差别,又被命名为杨树菇、柳松茸(日本与中国台湾省)、柳环菌(贵州、云南)、柱状田头菇、茶薪菇、油菜菇等[1],是集高蛋白、低脂肪、低糖分的可营养、保健和食疗的珍稀食用菌。江西省茶树菇产量为全国第一[2],种植规模越来越大。食用菌种质资源是选育优良品种的基础,对茶树菇种质资源亲缘关系进行准确分析和评价,可为种植品种选择和育种亲本选配提供科学依据。
DNA分子标记是对DNA水平遗传变异的直接反映,不受环境、组织特异性和发育阶段等因素的影响,具有数量大、多态性高、遗传稳定等优势[3-9]。简单序列重复区间 (inter-simple sequence repeat,ISSR)是在微卫星(simple sequence repeats,SSR)基础上发展起来的分子标记技术[10]。采用分子标记对茶树菇种质资源进行分类、评价,分析亲缘关系和多态性的研究已经有一些报道[11-16]。由于每种方法的原理不同,聚类分析结果通常会存在较大差异。因此,本研究综合采用ISSR分子标记、拮抗试验和同工酶技术相结合的方法,对18株不同来源茶树菇亲缘关系进行分析,评价其农艺性状,以期为茶树菇分类鉴定、遗传育种和商业化栽培菌株筛选提供理论基础。
1 材料与方法
1.1 供试菌株
参与研究的18株茶树菇均保存于江西省农业科学院农业应用微生物研究所食用菌育种室,菌株信息见表1。其中4株是野生菌株(编号Aa1~4)、7株是栽培菌株(编号Aa5~11)、5株是经钴60(剂量为600、700、800 Gy)辐照诱变菌株(编号Aa12~16)、2株为搭载神十的航天诱变菌株(编号Aa17~18)。

表1 茶树菇的18个供试菌株
1.2 培养基
1.2.1 马铃薯综合培养基 200 g马铃薯,1.5 g硫酸镁,20 g琼脂,1.0 g磷酸二氢钾,20 g葡萄糖,水1000 mL[17]。
1.2.2 栽培袋培养基 45%棉籽壳,30%玉米芯,18%麸皮,5%玉米粉,1%石灰,1%石膏,含水量60%左右。
1.3 试剂与仪器
DP305植物基因组DNA提取试剂盒购于TIANGEN生化科技(北京)有限公司,Taq DNA聚合酶、dNTP、琼脂糖、Marker DL2000和 6× Loading Buffer购于宝生物工程(大连)有限公司,PCR引物购于上海立菲生物技术有限公司,核酸染料、溴酚蓝指示剂和RNaseA购于北京索莱宝科技有限公司。
S1000TMThermal Cycler型PCR仪和PowerPacTMBasic型电泳槽购于Bio-Rad公司,G:Box F3型高级凝胶成像系统购于Syngene公司。
1.4 拮抗试验
参照国家行业标准《食用菌菌种区别性鉴定拮抗反应》(NY/T 1845—2010)[18]操作。18株供试菌接种到马铃薯综合培养基中活化,然后用打孔器取直径0.5 cm的10天菌龄的菌块,按“品”字形接种于同一固体平板上,于25℃恒温培养15天,每个处理3次重复,观察菌株间菌落交界处菌丝的拮抗现象[19]。
1.5 酯酶同工酶电泳试验
参照国家行业标准《食用菌菌种真实性鉴定酯酶同工酶电泳法》(NY/T 1097—2006)[20]操作。将保存的试管种接种到150 mL马铃薯液体培养基中180 r/min、25℃避光培养20天。采用3层纱布过滤菌丝球,并用滤纸吸干菌丝球的水分,称取0.5 g菌丝,放于预冷研钵中,加入液氮研磨至乳白色疏松状,加入2倍体积样品缓冲液[称取6.02 g磷酸氢二钠(Na2HPO4·12H2O),0.5 g磷酸二氢钠(NaH2PO4·2H2O),溶于水中,并稀释至100 mL,pH 7.5],4℃、10000 r/min离心10 min。取上清液与蔗糖溶液(称取40 g蔗糖,溶于水中,并稀释至100 mL)、溴酚蓝指示剂混合,比例为8:3:1,混合液即为电泳样品。采用聚丙烯酰胺凝胶双槽垂直平板电泳,浓缩胶浓度为3.0%,分离胶浓度为7.5%,染色液为固蓝RR-乙酸萘酯染色液[21]。电泳开始时电压为80 V,溴酚蓝指示剂进入分离胶以后,将电压升至120 V,指示剂距离凝胶底部约1 cm时,结束电泳。取下胶后,用染色液在37℃培养箱染色,最后用7%醋酸溶液(量取14 mL乙酸,加到适量水中,并稀释至200 mL)固定保存并拍照记录。计算每个菌株条带的相对迁移率Rf,如式(1)[17]。

1.6 供试菌株培养及基因组DNA的提取
接种少量菌丝体于马铃薯综合培养基上,接入前先在平皿培养基上铺一张灭菌的玻璃纸,25℃活化培养至菌丝长满平板,而后刮取少量菌丝作为试验材料,采用TIANGEN DP305植物基因组DNA抽提试剂盒提取基因组DNA,并于-20℃冰箱中保存备用。
1.7 ISSR分子标记的引物筛选
参照国家行业标准《食用菌菌种真实性鉴定ISSR法》(NY/T 1730—2009)[22]操作,选本试验彼此有明显拮抗的5个供试菌株DNA为模板,经过ISSR-PCR扩增,筛选出电泳条带清晰、稳定、多态性高的引物用于下一步的ISSR试验。试验筛选到的引物序列如表2所示。

表2 ISSR分析用引物
1.8 ISSR-PCR扩增
用筛选到的20条多态性引物对所有供试菌株进行ISSR-PCR扩增,ISSR扩增反应20 μL的总体系为2 × PCR Premix 10 μL、Primer 10 μmol/L 1 μL、DNA 1 μL、ddH2O 8 μL。ISSR扩增反应程序为94℃预变性3min,然后94℃变性30 s,55℃退火45 s,72℃延伸2 min,进行35次循环后72℃延伸5 min。反应结束后,取PCR产物于1.8%的琼脂糖凝胶电泳上检测并拍照[23]。
1.9 子实体农艺性状测定
将18株茶树菇分别接种到栽培袋中,每个菌株接种32袋,在相同的培养环境下培养至出菇,待茶树菇子实体生长至七八分熟(菌膜已经被打破,菌褶全部舒展开,但菌盖却没有完全打开,颜色由灰白色变为褐色)为最佳采收时期即进行采收。从产量、生育期、颜色、子实体规格(菌盖直径、菌柄直径、菌柄长度)等商品性状进行农艺性状调查[17],从中筛选出子实体朵型好、产量高、出菇整齐、生育期短的优异菌株。
1.10 数据统计分析
酯酶同工酶使用SPSS软件对茶树菇菌株酶谱进行聚类分析。ISSR分子标记分析通过扩增条带在琼脂糖凝胶上出现与否分别标记为1或0。用SensiAnsys和UPGMA(NTSYS-pc2.1)软件进行聚类分析,构建树状图[24]。使用SPSS软件对子实体农艺性状进行统计分析。
2 结果与分析
2.1 拮抗试验分析
茶树菇供试菌株间的拮抗反应为隆起型(图1),依据拮抗线的有无共分为7组。茶园1号、茶园2号、杨树洞1号、杨树上2号和白茶这5个菌株均与其他17个供试菌株都发生拮抗反应,分别单独为一组。茶3、古1、古2、AS-1、AS-1-700、AS-2、AS-2-600、茶3-800和茶3神这9个菌株里每一个菌株与其他17个菌株的拮抗反应类型一致,聚为一组,茶5、茶5-800、白茶700和AS-1神这4个菌株里每一个菌株与其他17个菌株的拮抗反应类型一致,聚为一组(表3)。菌株间没有拮抗反应或拮抗性反应极不明显,说明其亲缘关系很近。而菌株之间都有着不同程度的拮抗反应,表明菌株之间的亲缘关系较为疏远[4,24]。

图1 茶树菇供试菌株间的拮抗现象

表3 18株供试菌株间的拮抗反应结果
2.2 酯酶同工酶检验
2.2.1 酯酶同工酶电泳图谱分析 图2为18个茶树菇菌株的酯酶同工酶电泳图谱。18个菌株共检测出93条酯酶同工酶谱带,其中迁移率不同的有15条,Rf在0.151~0.636之间。多数菌株酶带数目和迁移率不同,酶带数分别为3~8条,多为6条。18个供试菌株分为5个酶谱类型,大部分菌株间酶带存在一定差异。茶5、茶5-800和白茶700酶带基本相同;杨树洞1号和杨树上2号酶带基本相同;AS-1-700、AS-2-600、茶3-800、茶3、古2、古1、AS-2、AS-1酶带基本相同,表明菌株间遗传差异较小。茶园1号、茶园2号、茶3神、AS-1神和白茶这5个菌株谱带与其他菌株间的酶谱差异显著,说明这5个菌株与其他菌株间遗传差异较大[25-29]。

图2 茶树菇酯酶同工酶电泳条带及对应相对的迁移率
2.2.2 酯酶同工酶聚类分析 由图3可知,在相似水平为50%时可将供试菌株聚合为6类。第1类包括杨树洞1号、杨树上2号2个野生菌株,第2类包括AS-1-700、AS-2-600、茶3-800、茶3、古2、古1、AS-2、AS-1等8个工厂化栽培菌株和辐照诱变菌株,第3类包括茶园2号、AS-1神2个野生菌株和航天诱变菌株,第4类包括茶5、茶5-800、白茶、白茶700等4个工厂化栽培菌株和辐照诱变菌株,第5类为茶园1号野生菌株,第6类为茶3神航天诱变菌株。

图3 茶树菇酯酶同工酶聚类分析树
2.3 ISSR分子标记试验分析
2.3.1 引物筛选结果 以菌株茶园1号、茶园2号、杨树洞1号、杨树上2号和白茶为模板,筛选出20条扩增条带清晰、稳定、多态性高的引物(表2)。
2.3.2 ISSR分析 20条引物共产生164条DNA片段,多态性条带数为133个,平均每个引物产生DNA片段数为8.2个,平均多态性比例为81.1%。引物P1的扩增效果较好,共产生11条DNA片段,每个菌株产生DNA片段数为2~7个,平均为4个(图4)。当相似系数在0.47时,所有菌株聚为一个群。当相似系数达到0.828时,所有菌株聚为6个群(图5)[4,24,30-31]。类群I包括茶园1号和茶园2号,类群II包括杨树洞1号和杨树上2号,白茶单独聚为类群III,AS-1单独聚为类群V,类群IV包括茶5、白茶700、茶5-800和AS-1神,其余 8 株聚为类群 VI。其中,AS-2、古 1、古 2、Cha3和茶3-800相异系数为0,说明各菌株间遗传差异小或为同一菌株。茶3与茶3神,AS-2与AS-2-600,AS-1与AS-1神、AS-1-700分别聚在了不同的遗传分支,说明这7株茶树菇可能在辐照或航天诱变后产生ISSR标记多态性的种内变异[11]。系统发育分析中18个菌株聚为6个分支,应视为6个遗传株系,分支间遗传距离较大,可在遗传分支间挑选亲本菌株进行杂交育种,以充分发挥杂交后代遗传互补优势[32]。

图4 引物P1的ISSR电泳图谱
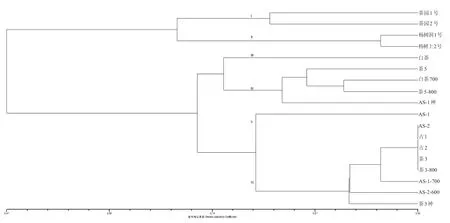
图5 茶树菇供试菌株的ISSR聚类树
2.4 茶树菇菌株的子实体农艺性状
供试菌株子实体阶段性状比较结果见表4。菌盖厚度最厚的是茶5,菌盖直径最大的是AS-1,菌柄长度最长的是AS-2,菌柄直径最大的是茶5;菌株茶5、AS-1、茶3、白茶、茶园1号和杨树洞1号生育期较短;菌株茶3、AS-1、白茶、茶5、茶园1号和杨树洞1号产量较高。综合比较初步筛选出较优菌株茶园1号、杨树洞1号、AS-1、茶3、白茶和茶5,可作为工厂化生产茶树菇菌种,其出菇照片如图6所示。
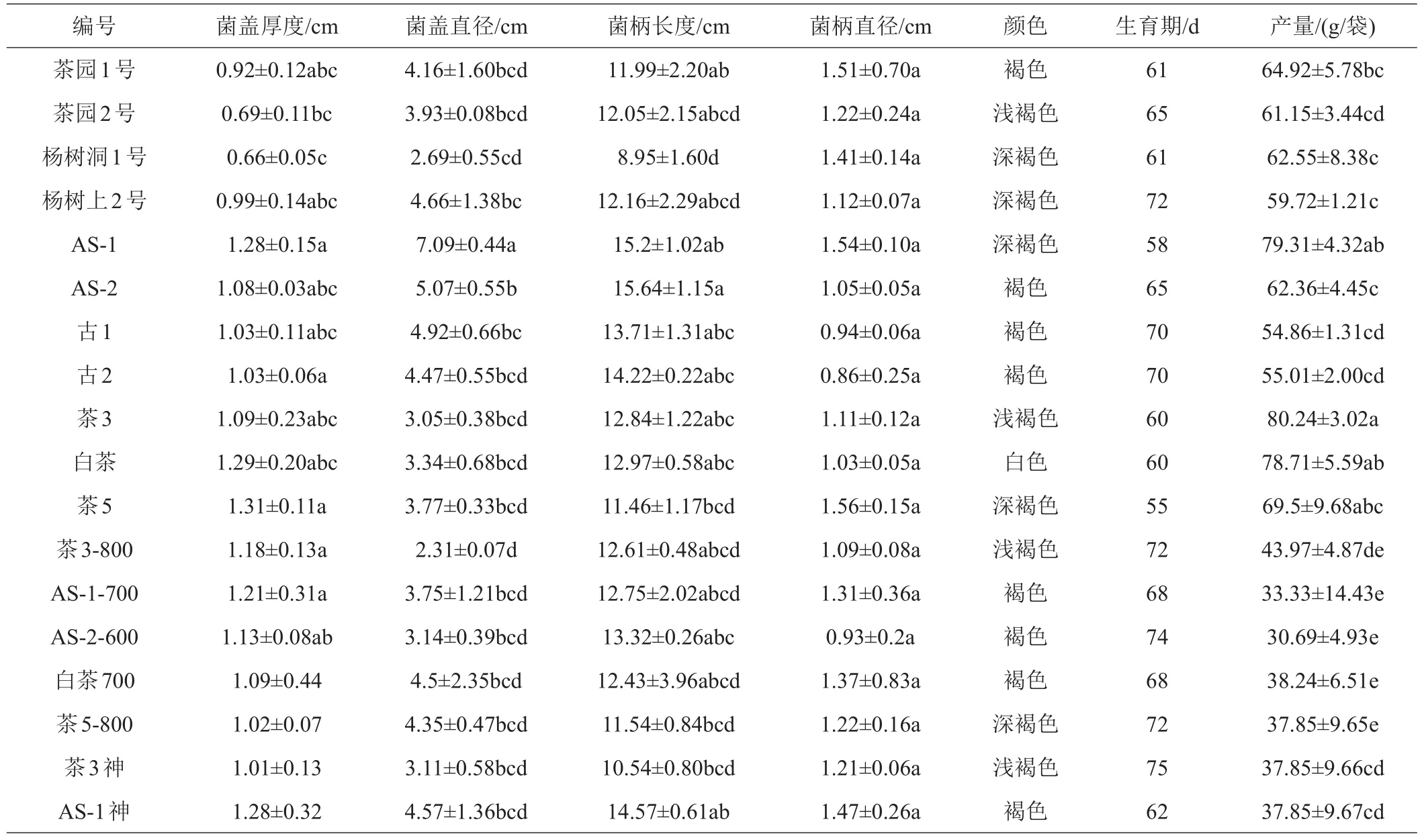
表4 18个茶树菇菌株的子实体农艺性状
3 结论与讨论
茶树菇集食用、保健和药用价值于一身,是目前国内重要的栽培食用菌之一,近年来,茶树菇在国内发展迅速,已成为国内第九大类栽培食用菌类,年产量约为65.6万t,占全国比例达50.36%[33-34]。但因为地域、标准、来源等原因,茶树菇分类及命名混乱。因此,为了保证菌株的可持续栽培,建立一个可靠的茶树菇遗传多样性评价方法显得尤为重要[24]。

图6 茶园1号、杨树洞1号、AS-1、茶3、白茶和茶5的栽培出菇照片
本研究应用拮抗、酯酶同工酶和ISSR技术对18个不同类型的茶树菇进行菌株分型,3种试验方法得出的分型结果大致相同,与笔者曾采用ITS序列对相同供试材料的分型结果基本一致[9]。与单一试验方法的聚类结果相比较,3种试验方法相结合能够更真实准确地显示出菌株之间的亲缘关系。ISSR、ITS和酯酶同工酶3种分析方法在研究茶树菇的亲缘关系方面较其拮抗反应的结果更细致,因此拮抗试验只能作为菌株分型的初步研究,更深一步的研究就需要通过现代分子生物学的方法[24]进行。
AS-1、AS-2、白茶、茶5和茶3是江西茶树菇主产区的主栽品种,在拮抗试验中5株菌聚在3个分支,在酯酶同工酶分析中5株菌聚在2个分支,在ISSR标记分析中5株菌聚在4个分支,在ITS序列分析中5株菌聚在3个分支,不同的遗传分支系统发育关系较远。栽培中可将不同分支菌株搭配种植,以扩大栽培菌株间的遗传背景,利于改良栽培品种结构,提高茶树菇栽培品种对环境、病虫害等因素的适应性[11,32]。
在酯酶同工酶、ISSR和ITS分析中,茶3与茶3神、AS-1与AS-1神分别聚在了不同的分支,说明这4株茶树菇可能由于航天诱变同工酶谱、ISSR标记的多态性及ITS序列发生改变。菌株经航天诱变产生的变异可以改变菌株因长期栽培导致的菌种退化,可以选择产生有利性状的诱变菌株作为父母本进行杂交,增强后代的杂种优势。杨树上2号、杨树洞1号、茶园1号、茶园2号菌株为江西境内野生分离菌株,在拮抗试验和ISSR分析中,4株菌单独分支,在酯酶同工酶和ITS分析中4株菌聚为3支,4株菌与传统栽培菌株亲缘关系较远,又因其采自野生环境,具有特有的环境适应性、抗逆性等优良特性,可以作为优良亲本菌株在育种中应用[11,32]。
工厂化栽培要求菌株具有菌丝生长速度快、生长周期短、产量高、品质优、耐储运的特性[26]。本研究综合比较初步筛选出较优菌株茶园1号、杨树洞1号、AS-1、茶3、白茶和茶5,可作为工厂化生产茶树菇菌种。
基于本实验室正在开展的茶树菇全基因组、转录组和重测序等关联分析技术,下一步将通过覆盖全基因组范围的SSR、SNP和INDEL等分子标记,构建高密度遗传连锁图谱,图位克隆高产、优质、抗逆、抗病虫、耐高温、耐储运等优异性状的基因,实现优异基因资源定向导入茶树菇的目的,提高特色茶树菇精准鉴定和评价,发掘新的茶树菇特色物种和筛选具有重要经济价值的优异菌株,充分发挥江西省茶树菇资源优势和提升茶树菇种质资源创新利用水平。
