不同光强的LED红蓝光对绿萝生长及其甲醛去除效果的影响
2022-02-16张紫研杨青郑紫凌孔令翀张俊文方治国
张紫研 杨青 郑紫凌 孔令翀 张俊文 方治国





摘 要 不同光强会显著影响植物的生长代谢、光合作用及光形态建成,而植物的生长状态与其甲醛去除能力之间有密切关系。以绿萝为研究对象,试验设置光强分别为 25、50、75、100 μmol·m-2·s-1的红蓝光对绿萝(Epipremnum aureum)进行连续光照,研究不同光强的红蓝光对绿萝生长及其甲醛去除效果的影响。结果表明,光强为100 μmol·m-2·s-1条件下的绿萝生长状况最好,其鲜重、茎长、根长和叶面积均为所有处理中的最大值,并且可溶性蛋白和叶绿素含量最高,分别为15.39 mg·g-1和2.54 mg·g-1,抗氧化酶活性最低;绿萝的最大荧光产量(Fm)、最大光合效率(Fv/Fm)、最大光化学量子产量(Fv/F0)在光强为100 μmol·m-2·s-1红蓝光条件下达到最高,分别为0.473、0.710、2.463;不同处理下绿萝对甲醛去除试验发现,经过4 h的熏蒸吸附,光强为100 μmol·m-2·s-1红蓝光条件下种植的绿萝对甲醛去除效果最好,让甲醛浓度从2.5±0.3 mg·m-3降为 0.29 mg·m-3,吸附率高达87.20%。
关键词 绿萝;红蓝光;光合作用;光形态建成;甲醛去除;荧光参数
中图分类号:S682.36 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.01.001
室内环境与人们的健康密切相关,成年人约有80%~90%的时间是在室内度过的,而一些行动不便的老人、婴儿等可能有高达95%的时间生活在室内[1-2]。目前,室内环境质量整体情况不容乐观,世界范围内每年有超过500万人死于室内空气污染[3-6]。室内环境中的污染物主要来源于家具和各种装修材料,长期暴露在高浓度室内污染物的环境下会严重影响人体健康[7]。甲醛在室温下是一种无色有刺激性的气体,为室内主要污染物[8-9],长期处于较高浓度甲醛环境中,会对人眼、鼻、呼吸道产生强烈的刺激作用[10-12]。此外,甲醛已被世界卫生组织国际癌症研究机构列入致癌物清单。如何高效治理室内空气污染物,减少其对人们健康的不良影响已成为科研人员关注的重点方向[13]。
目前,可以使用物理、化学和生物等方法有效去除室内环境中的甲醛,其中植物修复由于成本低廉、对环境友好、不产生二次污染而被广泛关注[14-16]。研究表明,绿色植物可以高效吸收大部分气态有机污染物,如绿萝(Epipremnum aureum)、虎尾兰(Sansevieria trifasciata Prain)等植物對甲醛有很好的去除作用[17-19];白鹤芋(Spathiphyllum kochii Engl. & K. Krause)和鹅掌柴[Schefflera octophylla (Lour.) Harms]可以有效去除室内空气中的苯系污染物[20-21];花叶万年青(Dieffenbachia picta Lodd.)和非洲天门冬[Asparagus densiflorus (Kunth) Jessop]对2-乙基己醇有较好的去除作用[22]。植物去除室内环境污染物的能力与其生长状况密切相关,而光照是影响植物生长发育和光形态建成的主要因子[23-25],不同光强会影响植物的光合作用、光形态建成及相关酶活性[26]。王满莲等发现强光可以显著降低地枫皮(Illicium difengpi K. I. B. et K. I. M.)和块根紫金牛(Ardisia corymbifera Mez var. tuberifera C. Chen)的净光合速率,增大秀丽海桐(Pittosporum pulchrum Gagnep.)的光合速率[27];Anastasia等认为较高或较低的光强会影响叶面厚度、叶肉细胞层、叶绿素含量和叶面气孔结构等[28],不同光强也会导致植物体内总抗氧化性及保护酶活性产生相应变化[29-30];Porter等发现随着光强增加,植物对甲苯的去除效率提高,可能是由于气孔导度增加及植物更活跃的代谢活动导致的[17,31-32]。此外,有研究表明红蓝光对植物的生长发育和光合特性具有积极的作用[26,33-34]。因此,我们可以提出假设,不同光强的红蓝光会显著影响绿萝的生长状态,那么不同光强红蓝光条件下种植的绿萝对甲醛的去除效果是否有显著差异?绿萝对甲醛的去除效果与哪些因素密切相关呢?基于此,选取绿萝为研究对象,研究了不同光强红蓝光对绿萝生长特征及光合作用的影响机制,探究了不同光强红蓝光条件下种植的绿萝的甲醛去除作用差异,揭示绿萝的生长特征、光合作用与绿萝对甲醛去除效果之间的关系,可为植物去除室内污染物提供新的思路,具有重要的实际指导意义。
1 材料与方法
1.1 试验材料
1.1.1 植物来源
试验选用绿萝为供试植物,购买于杭州花鸟市场,从同一批购买的绿萝苗中选取生长状况良好、大小基本一致、株高 15~20 cm 的进行试验,将挑选出的绿萝除去自带的土壤后盆栽种植。
1.1.2 LED光源
试验所用的红蓝光LED灯购自杭州汉徽光电科技有限公司,选用的光强分别为25 μmol·m-2·s-1(RB25)、50 μmol·m-2·s-1(RB50)、75 μmol·m-2·s-1(RB75)和100 μmol·m-2·s-1(RB100),利用这4种光强对绿萝进行光照培养,比较这4种光强下绿萝的生长特征及其对甲醛的去除效果差异。每个光处理组下放置5盆供试植物。培养温度为25 ℃,光周期为12 h/12 h,培养时间为75 d。
1.1.3 甲醛去除熏蒸室
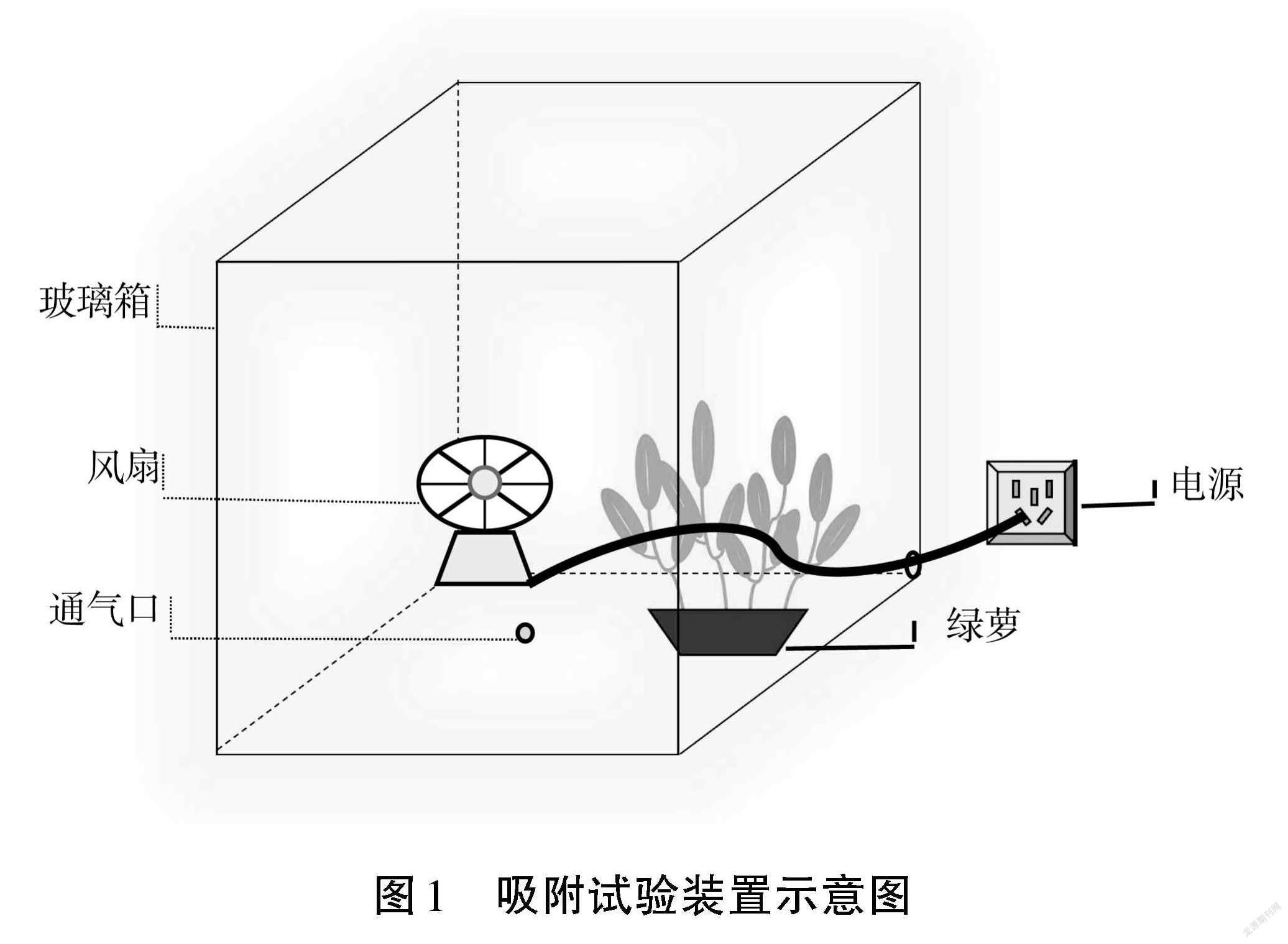
选用规格为 60 cm×60 cm×60 cm 的密封性较好的玻璃箱(见图1),箱子顶部的玻璃盖可以拆卸,能顺利把供试植物放入玻璃箱里,箱子正面和右侧各有1个小圆孔,正面小圆孔用于通入甲醛气体和甲醛浓度测定仪的传感器伸入箱内进行甲醛浓度的测定,右侧小圆孔用于接通小风扇的电源线。在试验之前箱体需要全部密封,以保证甲醛气体不外散。
1.1.4 甲醛浓度测定仪器
甲醛浓度测定选用甲醛检测仪(仪器型号为Interscan-4160-19.99 ppm,美国Interscan公司生产)。
1.2 绿萝相关指标测定
1.2.1 鲜重、叶长、叶宽、茎长、根长、叶离心率和叶面积测定
试验之前和光照培养结束后测定绿萝初始鲜重、叶长、叶宽、茎长、根长、叶离心率和叶面积。用称量法测定鲜重,用量尺测量叶长、叶宽、茎长和根长,叶离心率用以下公式进行计算,叶片离心率=叶长/叶宽,用纸张称重法测定叶面积[35]。
1.2.2 可溶性蛋白、丙二醛(Malondialdehyde, MDA)含量和酶活性测定
可溶性蛋白含量采用考马斯亮蓝染色法进行测定[36];MDA可采用硫代巴比妥酸法进行测定[37];超氧化物歧化酶(Superoxide dismutase, SOD)采用氮蓝四唑法进行测定[38];过氧化氢酶(Catalase, CAT)采用紫外吸收法进行测定[39];甲醛脱氢酶(Formaldehyde dehydrogenase, FADH)利用酶促反应物对应的NADH(烟酰胺腺嘌呤二核苷酸还原态)的产生情况检测相应的酶活性[40]。
1.2.3 叶绿素含量及叶绿素荧光特性测定
叶绿素含量采用丙酮法进行测定[41]。
叶绿素荧光参数采用脉冲幅度调制荧光计(Maxi-version of the Imaging-PAM, Heinz Walz GmbH, Germany)进行测定。在每种光照处理下选取3片绿萝叶片,暗处理 20 min后,利用叶绿素荧光仪测定叶绿素荧光参数。将样品放入样品室,在实时荧光 Ft稳定后,按 “F0(初始荧光)、Fm(最大荧光产量)”按钮,仪器会自动给出荧光基本参数F0、Fm、Fv/Fm,其他荧光参数可根据以下公式计算:
可变荧光(Fv)=Fm-F0 (1)
PSⅡ最大光合效率(Fv/Fm) =(Fm-F0)/Fm (2)
PSⅡ最大光化学量子产量(Fv/F0) =(Fm-F0)/F0 (3)
1.3 绿萝对甲醛的吸附试验
用1.1.3设计的熏蒸室进行甲醛吸附试验,每个处理组选取3株具有代表性的植株,將绿萝根部土壤去除,用聚四氟乙烯薄膜将植株根部密封包裹后放入玻璃箱中。用循环空气泵向熏蒸室中通入甲醛,使其浓度稳定在2.5±0.3 mg·m-3,其中 1 个熏蒸室不放置绿萝作为空白对照,其余3个熏蒸室放入绿萝,当熏蒸室中甲醛气体保持平衡之后(大约10~15 min),开始进行甲醛吸附试验,试验时长为 4 h,每隔 1 h测量1次熏蒸室中的甲醛浓度(绿萝吸附甲醛的试验过程处于室内自然光环境下)。
2 结果与分析
2.1 不同光强红蓝光种植的绿萝对甲醛去除效果的影响
2.1.1 不同光强红蓝光种植的绿萝对甲醛吸附量的影响
试验采用单因素方差分析(One-way ANOVA)检验处理组之间的差异性。图2是不同光强红蓝光条件下种植的绿萝对甲醛吸附量的影响。熏蒸室体积为 0.216 m3,甲醛初始浓度为 2.5±0.3 mg·m-3。由于玻璃箱的密封性和有机气体的不稳定性,经过 4 h放置之后,对照处理组的甲醛浓度降为 2.06 mg·m-3。放置了RB100、RB75、RB50 和 RB25 条件下培养的绿萝的熏蒸室经过 4 h吸附试验,玻璃箱中甲醛浓度分别为 0.29 mg·m-3、0.70 mg·m-3、0.69 mg·m-3、0.75 mg·m-3。从图中可以看出,不同条件下种植的绿萝对甲醛的吸附量影响显著,RB100条件下种植的绿萝对甲醛的吸附效果显著高于RB25、RB50和RB75处理组(P<0.05),而RB25、RB50、RB75处理组之间没有显著差异(P>0.05)。
2.1.2 不同光强红蓝光种植的绿萝对甲醛去除率的影响
图3 是不同光强红蓝光条件下种植的绿萝对甲醛去除率的影响,可以看出,各处理组绿萝的甲醛去除率差异显著。RB100、RB75、RB50、RB25处理组的甲醛去除率分别为87.20%、68.24%、69.40%、65.49%。从图中可以看出,RB100处理组绿萝的甲醛去除率显著高于 RB25、RB50、RB75(P<0.05),而RB25、RB50、RB75处理组之间没有显著差异(P>0.05)。结合2.1.1可知,与较低红蓝光强培养的绿萝相比,较高红蓝光强培养的绿萝对甲醛去除效果较好。
2.2 不同光强红蓝光对绿萝生长特征的影响
2.2.1 不同光强红蓝光对绿萝鲜重、茎长、根长的影响
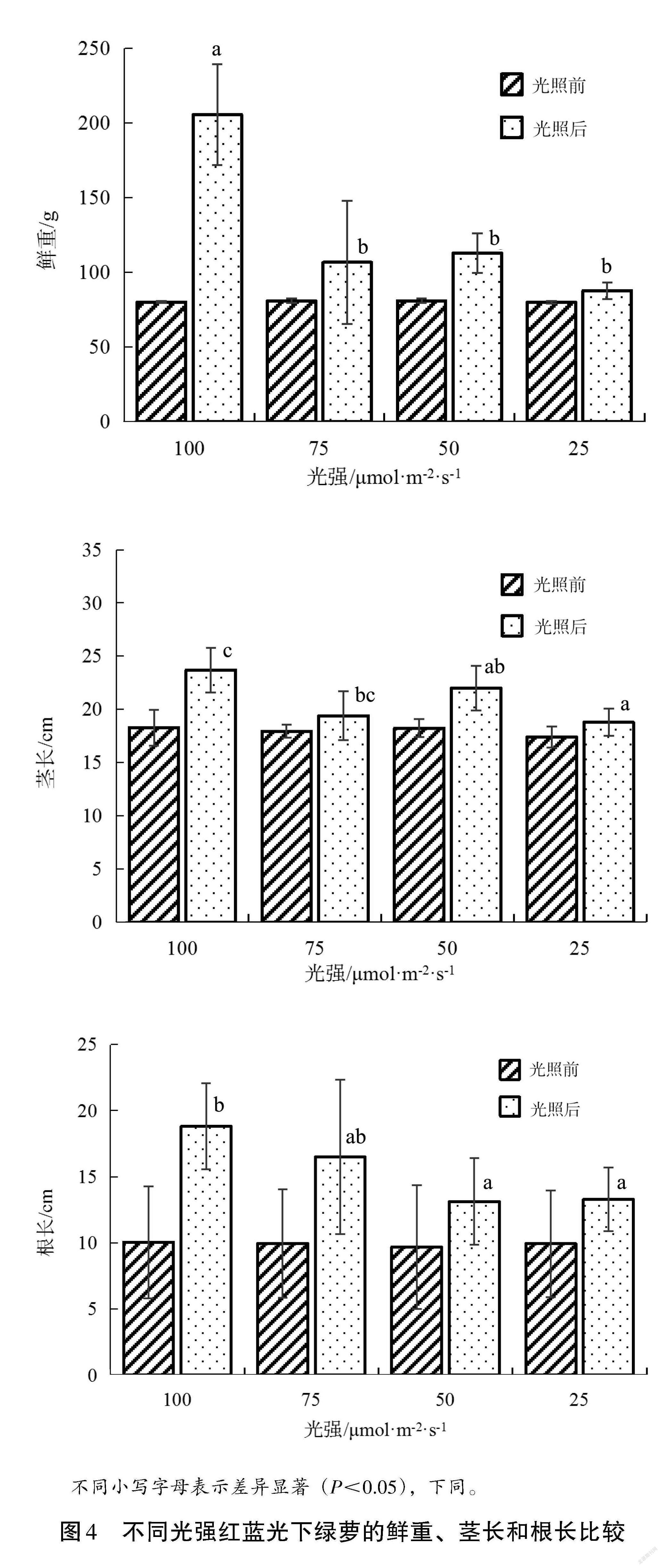
图 4 是不同光强红蓝光对绿萝生长特征的影响,试验前不同光照处理组的绿萝鲜重、茎长、根长基本一致;试验后,不同处理组的绿萝鲜重差异显著。可以看出,RB100 处理组绿萝鲜重为205.6 g,显著高于RB25、RB50、RB75(P<0.05),但RB25、RB50、RB75处理组之间的绿萝鲜重没有显著差异(P>0.05),其鲜重分别为87.8 g、112.8 g、106.6 g;在茎长和根长方面,RB100处理组的绿萝茎长、根长分别为23.7 cm、18.8 cm,显著高于 RB25和RB50处理组(P<0.05),RB25、RB50、RB75处理组绿萝的茎长分别为18.8 cm、22.0 cm、19.4 cm,根长分别为13.3 cm、13.1 cm、16.5 cm。绿萝的鲜重、茎长、根长在较高的红蓝光强条件下表现较好,并随着红蓝光强增大,绿萝的鲜重、茎长、根长也呈增大趋势。
2.2.2 不同光强红蓝光对绿萝叶片特征的影响
图5为不同光强红蓝光对绿萝叶片特征的影响。试验前不同光照处理的绿萝平均叶长、叶宽、叶离心率和叶面积基本一致;试验后,RB100、RB50处理组绿萝的叶长和叶离心率显著高于 BR75、RB25处理组(P<0.05),RB25、RB50、RB75、RB100的叶长分别为8.68 cm、10.37 cm、9.21 cm、10.32 cm,叶离心率分别为1.56、1.72、1.62、1.73。不同处理组的叶宽没有显著差异(P>0.05),RB25、RB50、RB75、RB100处理组绿萝的叶宽分别为5.55 cm、6.02 cm、5.69 cm、5.95 cm。RB100处理组绿萝的叶面积为1 749.13 cm2,显著高于RB25、RB50和RB75(P<0.05),RB25、RB50和RB75的叶面积分别为906.81 cm2、1 267.5 cm2和1 180.14 cm2,且这3组处理之间没有显著差异(P>0.05)。绿萝的叶片特征在较高的红蓝光强条件下表现较好,随着红蓝光强增大,绿萝的叶面积呈增大趋势,叶长、叶宽、叶离心率变化并不显著。
2.3 不同光强红蓝光对绿萝生化特性的影响
2.3.1 不同光强红蓝光对绿萝可溶性蛋白和叶绿素含量的影响
由图6可见,RB25、RB50、RB75、RB100处理组绿萝的可溶性蛋白含量没有显著差异(P>0.05),分别为12.96 mg·g-1、14.78 mg·g-1、14.82 mg·g-1、15.39 mg·g-1。RB100處理组绿萝的叶绿素含量显著高于RB25、RB50、RB75(P<0.05),RB25、RB50、RB75、RB100处理组绿萝的叶绿素含量分别为1.95 mg·g-1、2.07 mg·g-1、2.00 mg·g-1、2.54 mg·g-1,并且随着红蓝光强增大,绿萝叶绿素含量也随之升高。
2.3.2 不同光强红蓝光对绿萝 SOD、MDA、CAT 、FADH的影响
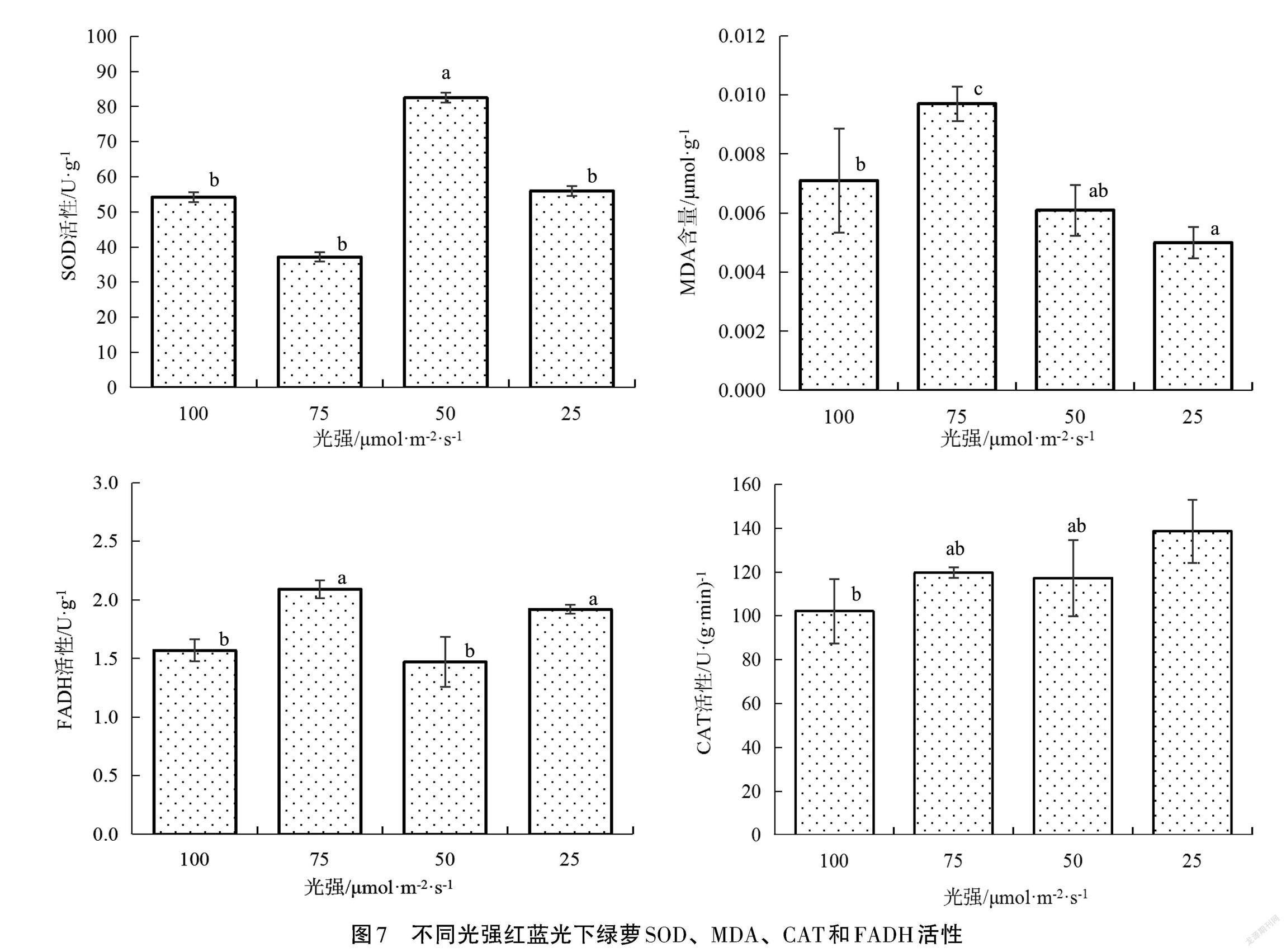
由图7可以看出,绿萝经过RB25、RB50、RB75、RB100光照条件培养后,其SOD酶活性分别为55.96 U·g-1、82.51 U·g-1、37.71 U·g-1、54.22 U·g-1,RB100条件下的绿萝SOD 酶活性显著低于RB50(P<0.05)。RB100光照条件下的绿萝MDA含量为 0.0071 μmol·g-1,显著低于 RB75(P<0.05),RB25、RB50、RB75处理组的绿萝MDA含量分别为0.005 0 μmol·g-1、0.006 1 μmol·g-1、0.009 7 μmol·g-1。
绿萝CAT随红蓝光强增强大致呈下降趋势,RB25、RB50、RB75、RB100条件下的绿萝CAT活性分别为138.59 U·(g·min)-1、117.2 U·(g·min)-1、119.69 U·(g·min)-1、102.09 U·(g·min)-1,RB100光照条件下的绿萝 CAT 活性显著低于 RB25(P<0.05)。随着光强的增加,FADH 活性没有明显的变化规律,RB50、RB100条件下的绿萝FADH活性分别为 1.48 U·g-1、1.55 U·g-1,显著低于 RB25(1.92 U·g-1)、RB75(2.09 U·g-1)。
2.4 不同光强红蓝光对绿萝叶绿素荧光参数的影响
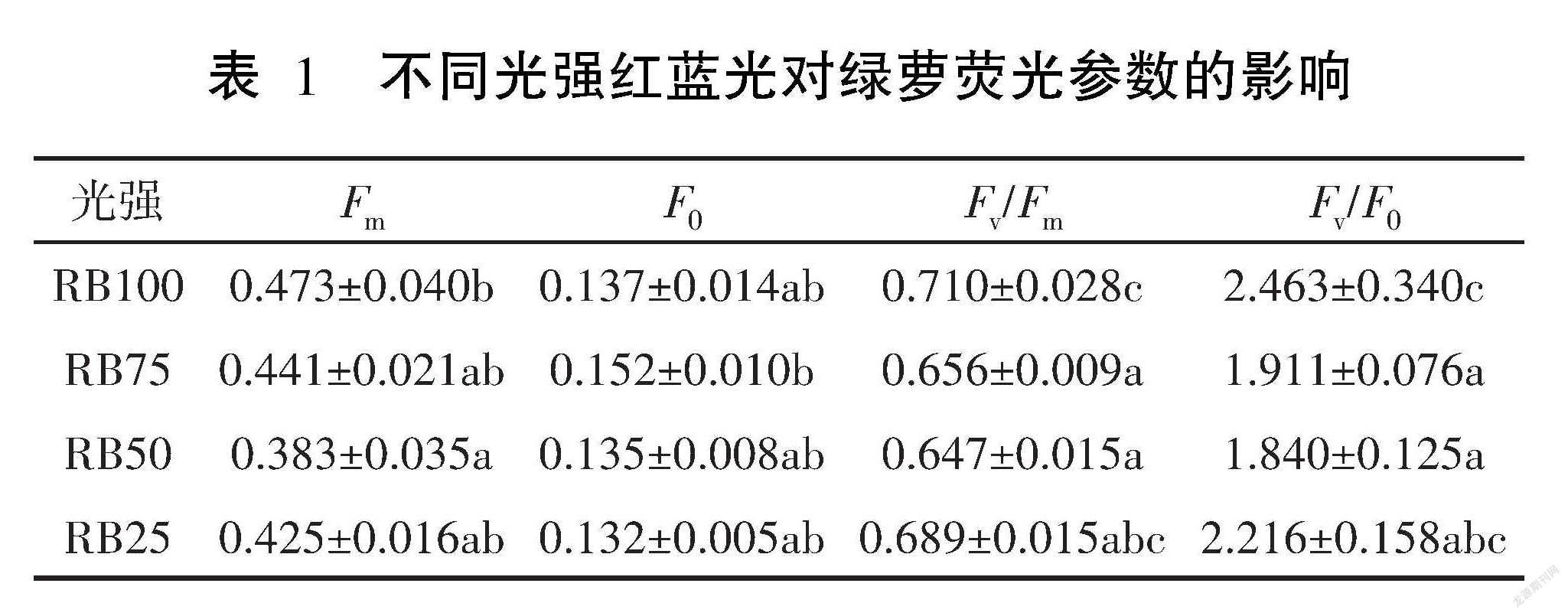
表1是不同光强红蓝光对绿萝荧光参数的影响,4个处理的荧光参数F0 没有显著差异(P>0.05)。在RB100光照条件下,绿萝的Fm、Fv/Fm、Fv/F0分别为0.473、0.710、2.463,均为各处理组中的最大值。RB100条件下的绿萝荧光参数Fm显著高于 RB50(P<0.05),Fv/Fm和Fv/F0显著高于RB50和RB75(P<0.05)。随着红蓝光强增大,绿萝的Fv/Fm、Fv/F0呈现先减小后增大趋势,并且在红蓝光100 μmol·m-2·s-1条件下达到最大值,说明绿萝在较高光强条件下的光合性能比低光强条件下的好。
2.5 不同光强红蓝光种植的绿萝生长特征与其对甲醛去除之间的关系
利用光强原始数据矩阵的主成分分析载荷图考察绿萝的各项生理参数与甲醛去除效率之间的关系。如图8所示,将甲醛去除率表示点与原点连成1条线,其他点与原点的连线与此线成锐角的表示绿萝的该项生理参数与甲醛去除相关性较大,与此线成钝角表示绿萝的该项生理参数与甲醛去除相关性不大。分析发现,不同光强红蓝光种植的绿萝鲜重、叶面积、叶绿素、蛋白质与甲醛去除效率相关性最大,其他Fm、Fv/Fm、Fv/F0、茎长等参数与甲醛去除相关性稍弱,而绿萝的CAT活性与甲醛去除之间相关性不大。此外,绿萝的甲醛脱氢酶与甲醛去除之间相关性也并不显著,这可能是由于吸附试验的时间较短(4 h),而较短时间内绿萝主要通过植物的表皮去除甲醛,酶活性的影响并不显著。
3 小结与讨论
以LED为照明系统,研究了不同光强(25、50、75、100 μmol·m-2·s-1)红蓝光对绿萝生长特征及光合作用的影响机制,探究了不同光强红蓝光条件下种植的绿萝对甲醛去除效果的影响,揭示了绿萝生长特征和光合作用等与甲醛去除之间的关系。结果发现,RB100处理组的绿萝生长情况最好,其鲜重、茎长、根长和叶面积显著高于其他处理组,绿萝的鲜重、茎长、根长随着光照增强呈增大趋势,并且绿萝的可溶性蛋白和叶绿素含量在RB100条件下达到最大,分别为 15.39 mg·g-1和2.54 mg·g-1。此结果与Cheng等研究结果相似,其研究表明,光照增强会促进植物主茎生长和侧枝伸长[42];相比其他3种较低光强,280 μmol·m-2·s-1 红蓝光能提高红苋(Amaranthus mangostanus L.)和多叶蔬菜苋的产量,且其体内叶绿素a、叶绿素b和类胡萝卜素含量增加[43];随着红蓝光照强度的增加,油菜(Brassica napus L.)幼苗的株高、茎粗、根长、叶面积和干重逐渐增加[44]。本研究表明,在光强100 μmol·m-2·s-1 以下的红蓝光条件下,光照增强显著有利于绿萝的生长。
绿萝在较低光强(RB25、RB50)下的SOD酶活性高于较高光强(RB100、RB75)下的SOD。CAT酶活性随光强增大呈下降趋势,在RB25条件下最高,在RB100条件下最低。绿萝的MDA含量排序为RB75>RB100>RB50>RB25。Gong等发现在较低的光照强度下柴胡(Bupleurum chinense)的SOD和CAT活性较高,MDA含量较低,与本结果相似[45],这可能是因为在低光强下,更多的能量被分配给光保护,并且产生了很强的抗氧化性[46]。本研究表明,在100 μmol·m-2·s-1 条件下绿萝的抗氧化能力表现较好。
叶绿素荧光与光合作用密切相关,Fm的降低和F0的升高表明植物受到了环境胁迫[47],Fv/Fm、Fv/F0可以反映植物是否受到光抑制[48]。绿萝的F0随光强增大呈先增加后减小的趋势,在RB75条件下达到最大,其Fm、Fv/Fm、Fv/F0值随光强增大呈先减小后增加的趋势,在RB100达到最大。已有研究表明,西番莲(Passiflora caerulea L.)的Fm、Fv/Fm、Fv/F0值均随光强增大而增加[49];但高粱[Sorghum bicolor (L.) Moench]的Fv/Fm随光照强度增加而降低[50],这与植物适应光环境能力的差异有关。本结果表明,RB25条件下的绿萝受光强胁迫严重,RB100 条件下光合活性最大,利于绿萝进行光合作用。
在试验中RB100的較高光照条件下种植的绿萝的甲醛去除率最大,达到 87.20%,这与Porter等研究结果相似,当光强为 35 μmol·m-2·s-1时,前3 h的大王黛粉叶对甲苯的去除率仅为6.17%,当光强提高到90 μmol·m-2·s-1 时,甲苯去除率增加了5倍,达到33%[32];Schmitz研究发现,光照条件下绿萝和垂叶榕对甲醛的吸收量是黑暗条件下的5倍[51];夹竹桃(Nerium indicum Mill.)对甲醛的吸收速率随光强增大而增加[52]。因此,较适宜的光照条件能够有利于绿萝的生长代谢和光合作用,更加有利于其对室内污染物的有效去除[19,52]。
本试验结果表明,不同光强红蓝光条件下种植的绿萝鲜重、叶面积、叶绿素、蛋白质与甲醛去除效率显著相关。在光强为100 μmol·m-2·s-1的红蓝光条件下,绿萝对甲醛的去除效果最佳,去除率达到87.20%,并且该条件下绿萝的鲜重、根长、茎长、叶面积等达到最佳生长效果,CAT酶活性最低,叶绿素含量及荧光参数Fm、Fv/Fm、Fv/F0值最大,绿萝的光合作用效率最高。
参考文献:
[1] Hoppe P. Different aspects of assessing indoor and outdoor thermal comfort[J]. Energy and Buildings, 2002, 34(6): 661-665.
[2] Mølhave L, Krzyzanowski M. The right to healthy indoor air: status by 2002[J]. Indoor Air, 2003, 13(13): 50-53.
[3] Mahdi J, Rahimi M S, Mansour B, et al. Occupational exposure to formaldehyde, lifetime cancer probability, and hazard quotient in pathology lab employees in Iran: a quantitative risk assessment[J]. Environmental Science and Pollution Research International, 2020, 28: 1878-1888.
[4] Martín J G, Kraakman N J R, Pérez C, et al. A state-of-the-art review on indoor air pollution and strategies for indoor air pollution control[J]. Chemosphere, 2021, 262:128376.
[5] Zhai L, Zhao J, Xu B, et al. Influence of indoor formaldehyde pollution on respiratory system health in the urban area of Shenyang, China[J]. African Health Sciences, 2013, 13(1):137-143.
[6] Chin J Y, Godwin C, Parker E, et al. Levels and sources of volatile organic compounds in homes of children with asthma[J]. Indoor Air, 2014, 24: 403-415.
[7] Nielsen G D, Wolkoff P. Cancer effects of formaldehyde: a proposal for an indoor air guideline value[J]. Archives of Toxicology, 2010, 84: 423-446.
[8] Guimarães J R, Turato Farah C R, Maniero M G, et al. Degradation of formaldehyde by advanced oxidation processes[J]. Journal of Environmental Management, 2012, 107: 96-101.
[9] Duan J, Guo S, Tan J, et al. Characteristics of atmospheric carbonyls during haze days in Beijing, China[J]. Atmospheric Research, 2012, 114-115: 17-27.
[10] Lang I, Bruckner T, Triebig G. Formaldehyde and chemosensory irritation in humans: A controlled human exposure study[J]. Regulatory Toxicology and Pharmacology, 2007, 50(1): 23-36.
[11] Molina Aragonés J M, Bausà Peris R, Carreras Valls R, et al. Scoping review about formaldehyde toxicity on occupationally exposed workers[J]. Archivos de Prevención de Riesgos Laborales, 2018, 21(3):128-157.
[12] Ferreira A, Paixão S, Figueiredo J P, et al. Environment air quality and health[J]. Annals of Medicine, 2019, 51: 70-70.
[13] Wu X M, Apte M G, Maddalena R, et al. Volatile organic compounds in small-and medium-sized commercial buildings in California[J]. Environmental Science & Technology, 2011, 45: 9075-9083.
[14] Saini V K, Pries J. Development of metal organic fromwork-199 immobilizedzeolite foam for adsorption of common indoor VOCs[J]. Journal of Environmental Science, 2017, 5: 321-330.
[15] Ying T, Lei B, Robert J G M, et al. Cryogenic circulation for indoor air pollution control[J]. Science of the Total Environment, 2019, 651(Pt 1): 1451-1456.
[16] Treesubsuntorn C, Thiravetyan P. Botanical biofilter for indoor toluene removal and reduction of carbon dioxide emission under low light intensity by using mixed C3 and CAM plants[J]. Journal of Cleaner Production, 2018, 194: 94-100.
[17] Akira T, Hewitt C N. Uptake of aldehydes and ketones at typical indoor concentrations by houseplants[J]. Environmental Science &Technology, 2009, 43(21): 8338-8343.
[18] Aydogan A, Montoya L D. Formaldehyde removal by common indoor plant species and various growing media[J]. Atmospheric Environment, 2011, 45(16): 2675-2682.
[19] Xu Z J, Wang L, Hou H. Formaldehyde removal by potted plant-soil systems[J]. Journal of Hazardous Materials, 2011, 192(1): 314-318.
[20] Wood R A, Orwell R L, Tarran J, et al. Potted-plant/growth media interactions and capacities for removal of volatiles from indoor air[J]. The Journal of Horticultural Science and Biotechnology, 2002, 77: 120-129.
[21] Sriprapat W, Thiravetyan P. Efficacy of ornamental plants for benzene removal from contaminated[J]. International Biodeterioration & Biodegradation, 2016, 113: 262-268.
[22] Filtration efficiency and physiological responses of selected plant species to indoor air pollutants (toluene and 2-ethylhexanol) under chamber conditions[J]. Environmental Science and Pollution Research, 2018, 25(1): 447-458.
[23] Arena C, Tsonev T, Doneva D, et al. The effect of light quality on growth, photosynthesis, leaf anatomy and volatile isoprenoids of a monoterpene-emitting herbaceous species (Solanum lycopersicum L.) and an isoprene-emitting tree (Platanus orientalis L.)[J]. Environmental and Experimental Botany, 2016, 130: 122-132.
[24] Wu Q, Su N, Shen W, et al. Analyzing photosynthetic activity and growth of Solanum lycopersicum seedlings exposed to different light qualities[J]. Acta Physiologiae Plantarum, 2014, 36(6): 1411-1420.
[25] Hu J, Dai X, Sun G. Morphological and physiological responses of Morus alba seedlings under different light qualities[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2016, 44: 382-392.
[26] 查凌雁,张玉彬,李宗耕,等.LED红蓝光连续光照及其光强对生菜生长及矿质元素吸收的影响[J]. 光谱学与光谱分析, 2019, 39(8): 2474-2480.
[27] 王满莲,韦霄,唐辉,等.光强对三种喀斯特植物幼苗生长和光合特性的影响[J].生态学杂志, 2015, 34(3): 604-610.
[28] Anastasia A, John H G, Costas F, et al. Photoacclimation in spathiphyllum[J]. Journal of Photochemistry and Photobiology B: Biology, 2004, 73(3): 149-158.
[29] Muhetaer G, Asaeda T, Jayasanka S M D H, et al. Effects of light intensity and exposure period on the growth and stress responses of two cyanobacteria species: pseudanabaena galeata and microcystis aeruginosa[J]. Water, 2020, 12(407):1-14.
[30] Wu H, Heng J, Liu C, et al. Growth, pigment composition, chlorophyll fluorescence and antioxidant defenses in the red alga Gracilaria lemaneiformis (Gracilariales, Rhodophyta) under light stress[J]. South African Journal of Botany, 2015, 100: 27-32.
[31] Kim K J, Kil M J, Song J S. Efficiency of volatile formaldehyde removal by indoor plants: contribution of aerial plant parts versus the root zone[J]. Journal of the American Society for Horticultural Science, 2008, 133(4): 521-526.
[32] Porter J R. Toluene removal from air by Dieffenbachia in a closed environment[J]. Advances in Space Research, 1994, 14(11): 99-103.
[33] 陳祥伟,刘世琦,王越,等. 不同LED光源对乌塌菜生长、光合特性及营养品质的影响[J]. 应用生态学报, 2014, 25(7): 1955-1962.
[34] Wang S, Wang X, Shi X, et al. Red and blue lights significantly affect photosynthetic properties and ultrastructure of mesophyll cells in senescing grape leaves[J]. Horticultural Plant Journal, 2016, 2(2): 82-90.
[35] 王希群,马履一,贾忠奎,等.叶面积指数的研究和应用进展[J].生态学杂志,2005(5):537-541.
[36] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976, 72(1-2): 248-254.
[37] Koca K, Yurttas Y, Bilgic S, et al. Effect of preconditioned hyperbaric oxygen and ozone on ischemia-reperfusion induced tourniquet in skeletal bone of rats[J]. Journal of Surgical Research, 2010, 164(1): 83-89.
[38] Giannopolitis C N, Ries S K. Superoxide dismutases: II purification and quantitative relationship with water-soluble protein in seedlings[J].Plant Physiology, 1977, 59(2): 315-318.
[39] Aebi H. Catalase in vitro[J]. Methods Enzymol, 1984, 105: 121-126.
[40] Dı́az M, Achkor H, Titarenko E, et al. The gene encoding glutathione-dependent formaldehyde dehydrogenase/GSNO reductase is responsive to wounding, jasmonic acid and salicylic acid[J]. FEBS Letters, 2003, 543(1): 136-139.
[41] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton[J]. Biochemie Und Physiologie Der Pflanzen, 1975, 167(2): 191-194.
[42] Cheng X P, Wang Y F, Dong L Q, et al. Effects of light intensity and regeneration mode on stem form and growth of cunninghamia lanceolata saplings[J]. Journal of Sustainable Forestry, 2020, 39(6): 563-573.
[43] Meas S, Luengwilai K, Thongket T. Enhancing growth and phytochemicals of two amaranth microgreens by LEDs light irradiation[J]. Scientia Horticulturae, 2020, 265:109204.
[44] Yao X, Liu X, Xu Z, et al. Effects of light intensity on leaf microstructure and growth of rape seedlings cultivated under a combination of red and blue LEDs[J]. Journal of Integrative Agriculture, 2017, 16(1): 97-105.
[45] Gong J, Liu M, Xu S, et al. Effects of light deficiency on the accumulation of saikosaponins and the ecophysiological characteristics of wild Bupleurum chinense DC. in China[J]. Industrial Crops & Products, 2017, 99: 179-188.
[46] Zhang W, Gong J, Zhao J, et al. What degree of light deficiency is suitable for saikosaponin accumulation by Bupleurum chinense DC[J]. Industrial Crops & Products, 2018, 122: 392-401.
[47] Zhang C, Atherton J, Peñuelas J, et al. Do all chlorophyll fluorescence emission wavelengths capture the spring recovery of photosynthesis in boreal evergreen foliage[J]. Plant, Cell & Environment, 2019, 42(12): 3264-3279.
[48] 张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999(4):444-448.
[49] Ni Y, Lin K, Chen K, et al. Flavonoid compounds and photosynthesisin passiflora plant leaves under varying light intensities[J]. Plants, 2020, 9(5):633.
[50] Maai, Nishimura, Takisawa, et al. Light stress-induced chloroplast movement and midday depression of photosynthesis in sorghum leaves[J]. Plant Production Science, 2020, 23(2): 172-181.
[51] Schmitz H, Hilgers U, Weidner M. Assimilation and metabolism of formaldehyde by leaves appear unlikely to be of value for indoor air purification[J]. New Phytologist, 2000, 147(2): 307-315.
[52] Kondo T, Hasegawa K, Uchida R, et al. Absorption of formaldehyde by oleander (Nerium indicum)[J]. Environmental Science & Technology, 1995, 29(11): 2901-2903.
收稿日期:2021-09-23
基金项目:浙江省自然科学基金项目(LY17D050002)。
作者簡介:张紫研(1996—),女,浙江工商大学环境科学与工程学院环境工程专业2018级在读硕士研究生,研究方向为环境安全评价与生态修复技术。E-mail: 2448131538@qq.com。
*为通信作者,E-mail: zhgfang77@zjgsu.edu.cn。
