一株Ⅱ型草鱼呼肠孤病毒强毒株的分离鉴定及全基因组序列分析
2022-02-15曾伟伟董寒旭陈言峰
曾伟伟,董寒旭,杨 映,陈言峰,于 辉,李 华
(1.佛山科学技术学院 生命科学与工程学院,广东佛山 528225;2.广东省动物分子设计与精准育种重点实验室,广东 佛山 528225;3.广东普通高校动物分子设计与精准育种重点实验室,广东 佛山 528225)
草鱼(Ctenopharyngodon idella)是我国最重要的淡水经济鱼,其产量约占全国淡水鱼生产总量的20%[1],除西藏、青海零星养殖外,在我国各地均有一定规模养殖。然而,由草鱼呼肠孤病毒(Grass Carp Reovirus,GCRV)引起的草鱼出血病严重地阻碍了草鱼养殖业的健康发展[2]。GCRV 隶属水生呼肠孤病毒属,为呼肠孤病毒科一新成员,是中国大陆分离的第1 株鱼类病毒。该病毒主要引起中国淡水养殖主要品种草鱼在鱼种阶段发生出血病,死亡率可高达60%以上。该病毒流行广、危害大、死亡率高、发病季节长,严重威胁渔业生产[3]。草鱼呼肠孤病毒是正二十面体粒子,呈5∶3∶2 对称球形颗粒,直径为65~72 nm,无囊膜,具有双层衣壳,GCRV 基因组由11 条分节段的双链RNA(ds RNA)组成,RNA的3'端不含poly(A),3'和5'末端各含有5~7 个碱基(bp)的保守序列。目前已经报道GCRV 有40 多个分离株,包 括GCRV、854、861、873、875、876、9014、991、V、H-962、ZV-8802、854、HZ08、JX09-01、JX09-02、GD108、104、106、109、GZ1208 等,初步研究表明,不同分离株在致细胞病变、毒力、基因组电泳带型、基因组序列和特征等各方面有较大差异[1,4-9]。GCRV 感染细胞,有的毒株可感染单层培养细胞产生细胞病变效应(cytopathic effect,CPE),而有的毒株不产生CPE,但能在培养细胞中复制。GCRV 感染细胞的能力与其感染鱼体的毒力并不都是一致的,有的毒株(如GCRV873、JX0901、GZ1208)对培养细胞的感染力较强,但是对鱼体的毒力却较弱,有的毒株恰恰相反(如GCRV861、GD108、V 和9014 株)。由于呼肠孤病毒含分段dsRNA 基因组且其3'端不含poly(A)尾的特性,使得其基因组测定有一定的难度。随着分子生物学技术的发展,利用单引物扩增技术,越来越多的水生呼肠孤病毒完成了全基因组序列测定。目前GenBank 中可查询到已完成全基因组序列的草鱼呼肠孤病毒有10 多株,分别是873 株、HZ08株、GD108 株、104 株、HeNan988 株、918 株、106 株、HuNan794 株、109 株、GZ1208 株等[4-7,10]。GCRV 基因组序列的测定和分析比较,为不同GCRV 分离株的分类进化提供了重要的依据。
2020 年8 月份,广东佛山某养殖场草鱼爆发出血性疾病,并持续死亡,每天死亡草鱼几十尾到上千尾不等,患病草鱼的主要临床症状为体侧肌肉、鳍基部、口腔、鳃盖、眼眶明显充血,剥开皮肤,肌肉呈点状充血,剖检可见肠道有不同程度的充血发红,其他脏器未见明显的症状。采集具有典型出血病症状的病样,进行病毒分离、回归感染试验、分子生物学和免疫学鉴定以及全基因组序列分析,表明该分离株为一株II 型GCRV 强毒株,为揭示GCRV的流行态势变化和进一步防控GCRV 提供重要数据,为丰富该病的病原库及进行各地分离株比较分析奠定了基础。
1 材料与方法
1.1 试验试剂
M199 培养基、胎牛血清、胰酶为Gibco 公司产品;Taq DNA 聚合酶、dNTPs、DNA Marker 购自天根生物有限公司;Trizol Reagent 购于Invitrogen 公司;DNA 酶(RNAase free)、RNA 酶、绿豆核酸酶(MB)及其反应缓冲液,购自NEB 公司;反转录试剂盒购于宝生物(Takara)公司;T4 RNA ligase 购自Promega 公司;其他试剂均为国产分析纯。
1.2 抗体、细胞及毒株
抗II 型GCRV VP5 蛋白的多克隆抗体由本实验室制备并保存[11],草鱼肾细胞(CIK)系由本实验室制备并保存,用于病毒的分离和增殖;GCRV 873 株病毒由中国科学院武汉病毒研究所惠赠,GCRV 104株病毒由中国水产科学研究员长江水产研究所惠赠。
1.3 试验鱼
试验用草鱼购自广州景洋渔业有限公司,平均体长为12.0 ± 0.5 cm,体重为25.0 ± 0.5 g,在进行感染试验前全部试验鱼都在实验室鱼缸中暂养2 周,同时经三重PCR 检测为GCRV 阴性。
1.4 样品的采集及处理
病料组织取自广东佛山地区一草鱼养殖场的患病草鱼,采取发病鱼的肝、肾、脾和肠道,用50%甘油磷酸缓冲液保存,置于低温环境中带回实验室。用PBS(pH7.2)将保存于50%甘油磷酸缓冲液中的组织漂洗3 次,称取重量,将组织剪成小块,用组织匀浆器磨碎,用M199 培养基制成1∶10的组织匀浆液,反复冻融3 次后,依次经3 000 rpm/min、6 000 rpm/min 和10 000 rpm/min,每次离心10 min,去沉淀,上清液经滤膜孔径为0.22 μm的微孔滤器过滤除菌,于-70 ℃冰箱保存备用。
1.5 病毒的分离与传代
将上述处理好的组织悬液经三重RT-PCR 方法[12]检测为强阳性样品的上清液接种于长成致密单层CIK 细胞的细胞培养瓶内,28 ℃孵育1 h,之后加入含5 μg/mL 胎牛血清的M199 维持培养基,28 ℃恒温培养,每日观察细胞形态。病毒传代时,将病毒细胞培养物反复冻融2 次,再按上述接种方法做传代培养。
1.6 超薄切片电镜观察
收集盲传至第2 代病毒感染5 d 后的细胞,用戌二醛和四氧化锇双固定,梯度乙醇中脱水,苯二甲酸二丙烯酯包埋,制备超薄切片,在JEM-100CX II 透射电镜下观察和拍片。
1.7 PCR 鉴定
取CIK 细胞培养的第1、3、6 和10 代病毒原液及未感染病毒的CIK 细胞液各200 μl,于4 ℃3 000 g 离心10 min,收集上清液。按照Trizol Reagent 说明书的步骤进行病毒感染细胞总RNA的提取,然后按照TaKaRa AMV 试剂盒说明书进行反转录获得总cDNA,再以cDNA 为模板进行三重PCR检测[12],PCR 产物用1.5%琼脂糖凝胶电泳进行检测,检测为阳性的样品其PCR 扩增产物送至广州艾基生物科技有限公司进一步测序验证。
1.8 间接免疫荧光鉴定
间接免疫荧光实验在24 孔细胞培养板上进行,按照前面介绍的方法准备细胞和接种病毒,待接种病毒5 d 后,弃去培养液,用预冷的PBS(pH7.4)润洗2 次,5 min/次;然后用预冷的甲醇2 mL/孔,-20 ℃固定30 min,弃去甲醇固定液,室温放置10 min,PBS 洗3 次,5 min/次;加入1% Triton X-100(用pH7.4的PBS 稀释)200 μL/孔,室温透化处理30 min,PBS 洗3 次,5 min/次;加入3% 牛血清白蛋白200 μL/孔,室温封闭30 min,吸出牛血清白蛋白,加入含1% 牛血清白蛋白PBS 按1∶500 稀释的VP4 单克隆抗体200 μL/孔,室温作用60 min,PBS 洗3 次,5 min/次;加入用PBS 1∶2 000 稀释的FITC标记羊抗鼠荧光抗体,200 μL/孔,室温作用60 min,PBS 洗3 次,5 min/次;同时设立感染873 和104 株的对照和未接种病毒的阴性对照。将最后洗涤好的细胞培养板置倒置荧光显微镜下观察、拍照并记录。
1.9 回归感染试验
将制备好的组织匀浆悬液和CIK 细胞病毒液过滤除菌处理后稀释至病毒滴度TCID50为10-3/0.1 ml,然后注射当年10~15 cm 大小的草鱼,同时设注射无菌PBS的阴性对照组,每尾草鱼腹腔注射0.2 ml,每组试验鱼均为20 尾。试验期间水温控制在28 ℃左右,每天观察各组试验鱼的发病和死亡情况,连续3 w。同时在试验过程中,对攻毒后死亡或濒临死亡的鱼以及攻毒2 w 后未死亡或者发病的鱼分别采用三重RT-PCR 进行GCRV 病毒检测。
1.10 全基因组序列测定及分析
采用TRIzol 试剂盒从感染细胞的病毒中提取病毒RNA,具体方法参照试剂盒说明书。病毒cDNA的合成、克隆和测序参照单引物扩增技术[5,10]和5' RACE 方法进行[13]。病毒基因组序列采用DNASTAR 7.0 软件包进行分析,其他用于比对分析的GCRV 基因组序列收集自NCBI 中的GenBank 数据库。然后采用Clustal X 2.1 进行多重序列比对,采用MEGA v7.0.28 软件通过临位相连法(Neighbor-Joining,N-J)用RdRp 蛋白的氨基酸序列绘制GCRV 各分离株的系统进化树,Bootstrap 计算重复1 000 次。
2 结果
2.1 病毒的分离培养
病料接种CIK 细胞后,连续观察7 d,没有出现明显的细胞病变,盲传至第10 代,连续观察仍未出现明显的细胞病变。取第1、3、6 和10 代病毒原液进行三重RT-PCR 检测,均能扩增出特异性目的条带,大小为200 bp 左右,PCR 产物经测序表明与GCRV-HZ08、GD108、106、109 等草鱼呼肠孤病毒分离株的同源性较高,而未感染病毒的CIK 细胞未能扩增出目的条带,如图1 所示,其中1~4 分别为分离病毒盲传第1、3、6 和10 代病毒原液,NC 为未感染病毒的CIK 阴性对照,M 为DNA 分质量标准。
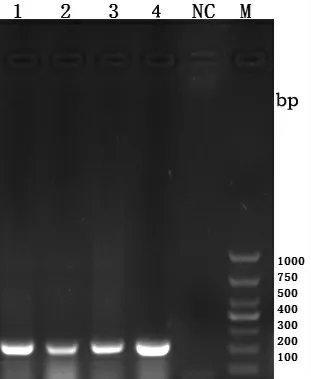
图1 病毒分离的PCR 鉴定结果
2.2 电镜观察鉴定结果
新分离株GD20-08 株感染CIK 细胞超薄切片在电镜下观察:透射电镜下CIK 细胞胞浆中有大量病毒粒子呈散在分布,直径大约为70 nm,平面图像呈六边形或近圆形,无囊膜结构,中央有一电子密度致密区域,而未感染病毒液的对照细胞没有观察到病毒粒子,如图2 所示,其中GD20-08 为感染新分离株的CIK 细胞,CIK-NC 为没有感染病毒的对照细胞。
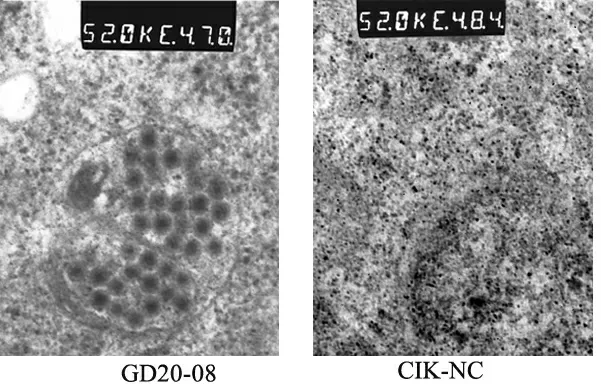
图2 病毒分离的电镜鉴定结果
2.3 间接免疫荧光鉴定结果
间接免疫荧光反应的细胞培养板置于荧光显微镜下观察,特异性的荧光细胞呈黄绿色,胞浆中黄绿色颗粒或亮斑为草鱼呼肠孤病毒存在的阳性信号。结果表明接种新分离株的CIK 细胞反应呈阳性,而接种873(I 型GCRV)和104(III 型GCRV)以及CIK 细胞对照无反应,如图3 所示,其中GD20-08、873 和104 分别为相应分离株病毒感染的细胞,NC 为没有感染病毒的对照细胞,表明该分离株为II 型GCRV,并命名为GD20-08 株。

图3 病毒分离的间接免疫荧光
2.4 回归感染试验结果
在注射后的第5 d,攻毒组草鱼开始出现游动失常、厌食、反应迟钝的症状,继而,病鱼体色变黑,身体失去平衡,出现这种症状的病鱼,在一天内即死亡。死亡的草鱼除体色发黑外,多数发病鱼可见体表有不同程度的出血点,如眼眶、鳃盖周围、下颚、尾鳍等部位,也有发病鱼有肠炎症状,如图4 所示。

图4 病毒分离的回归感染草鱼结果
攻毒14 d 后草鱼死亡率达96.7%(29/30),而没有感染病毒的对照组草鱼没有明显的临床症状,也无一例死亡。取发病死亡的鱼内脏组织进行三重RT-PCR 检测,能够扩增出一段200 bp 大小的条带,说明病毒可以在草鱼体内增殖。制备发病死鱼的组织液再次感染CIK 细胞进行病毒分离后,三重RTPCR 检测均为阳性。
2.5 基因组序列分析
GCRV GD20-08 株基因组全长为24.703 Kb,S1 至S11 基因组大小为3 928 bp 至10 24 bp,在Genbank 中的登录号分别KU254567~ KU254576,除S4 节段的为5'GUAUUUU…UUCAUC 3',其他各节段拥有共同的末端保守序列5'GUAAUUU…UUCAUC 3',这一点与106 株的完全一致,而与HZ08、GD108和109 株都有微小的差异。另外,邻近末端保守序列,各个基因节段又拥有节段特异的倒转重复序列与呼肠孤病毒科病毒毒株的基本特征一致,在病毒对其基因组进行筛选以及装配过程中可能起到重要作用。GD20-08 株基因组各节段只有惟一的一个ORF,预测只编码惟一蛋白。S1 基因编码一个长度为1 296 氨基酸的结构蛋白(VP1),分子量为143.8 KDa。推测S1 基因编码蛋白均具有鸟苷酰转移酶的功能,参与mRNA的加帽;S2 基因编码一个长度为1 273 氨基酸的结构蛋白(VP2),分子量分别为142.6 KDa,S2 基因编码的VP2 结构蛋白,为病毒的RNA 依赖性RNA 聚合酶(RdRp);S3 基因编码一个长度为1 232 氨基酸的结构蛋白(VP3),分子量分别为135.7 KDa,S3 基因编码的VP3 为病毒的核心蛋白,与MRV的λ1 和ARV的λA 蛋白有较近的亲缘关系,可能具有NTPase的功能,在病毒基因组转录的时候起到解旋酶的功能;S4 基因分别编码一个长度为716 氨基酸的非结构蛋白(NS1),分子量为79.1 KDa。NS1 与MRV 和ARV的μNS 蛋白有很近的亲缘关系,可能与病毒的包涵体形成及细胞骨架有关联;S5基因分别编码一个长度为726 氨基酸的结构蛋白(VP5),分子量为80.7 KDa,VP5 与MRV的2 和ARV的A 蛋白有很近的亲缘关系,推测可能是病毒内衣壳的构件,具有NTPase 功能,是一个RNA 结合蛋白,还能结合微管,决定毒株的表型,辅助RdRp 发挥作用;S6 基因分别编码一个长度为650 氨基酸的结构蛋白(VP,4),分子量为68.3 KDa。分析预测表明S6的编码蛋白VP4 与MRV的1 和ARV的B 蛋白有很近的亲缘关系,VP4 蛋白是病毒的主要的外衣壳蛋白,大约占病毒蛋白总重量的一半,在病毒的细胞侵入和组装方面有重要作用;S7 基因均编码一个长度为512 氨基酸的结构蛋白(VP6),分子量为56 KDa,VP6 可能为病毒的主要结构蛋白;S8 能够编码一个长达361 个氨基酸的非结构蛋白NS2,分子量为41.20 KDa,其功能未知;S9 基因均编码一个长度为418 氨基酸的结构蛋白VP7,分子量分别为47.9 KDa,VP7 蛋白与MRV的2 和ARV的A 蛋白有很近的亲缘关系;S10 基因编码一个长度为345 氨基酸的结构蛋白,分子量分别为38.4 KDa,分析表明S10的编码蛋白与MRV 和ARV的NS 蛋白具有很近的亲缘关系;S11 基因编码一个长度为309 氨基酸的非结构蛋白,分子量为35.4 KDa,如表1 所示。
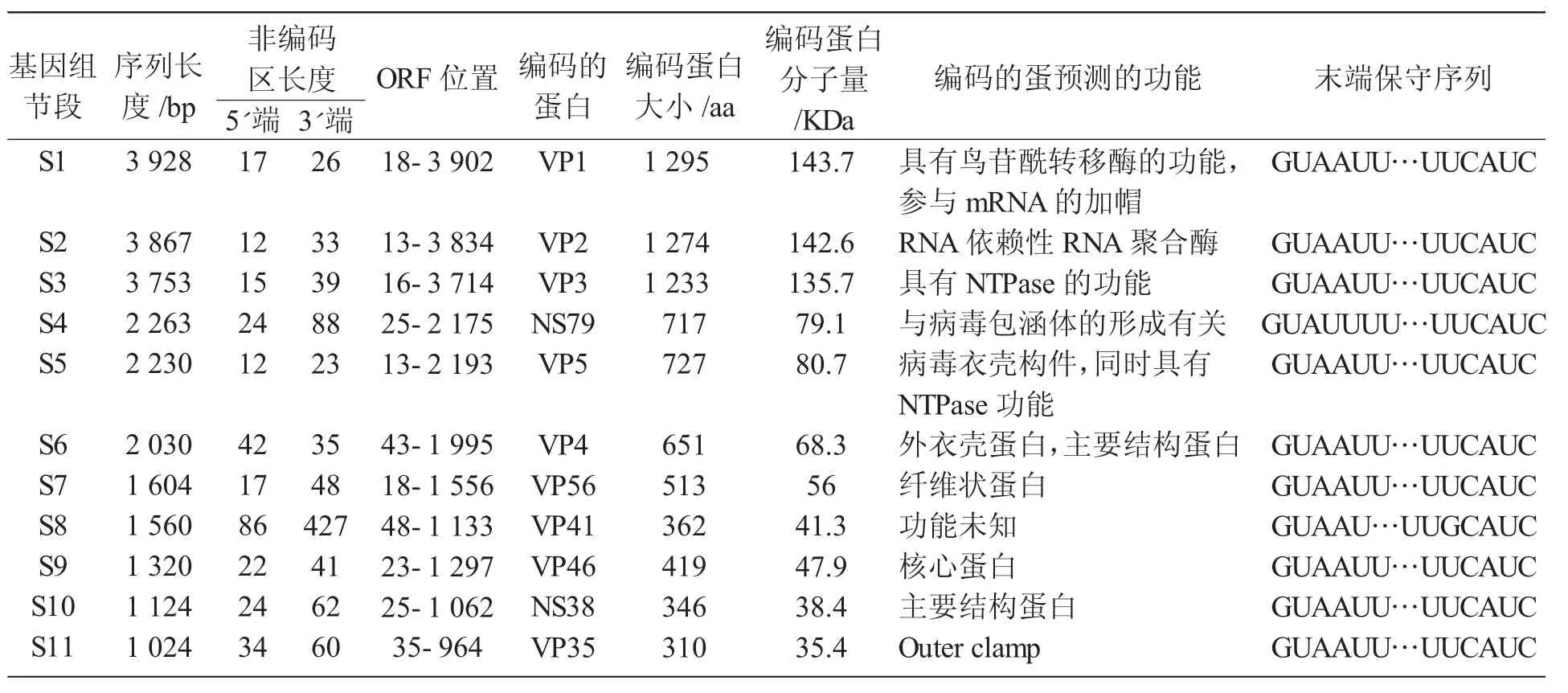
表1 GD20-08 株草鱼呼肠孤病毒病毒基因组各节段特点
GD20-08 分离株与其他GCRV 分离株的核苷酸和氨基酸序列同源性比较分析表明,该分离株与HZ08、GD108 等Ⅱ型毒株同源性较高,核苷酸序列的同源性从95.8%至99.2%不等,氨基酸序列的同源性从94.3%至100%不等,其中氨基酸序列同源性最低的为S7 基因编码的VP56 蛋白,为94.3%至98.4%,最高的为S10 基因编码蛋白,为99.4%至100%,如表2 所示。而GD20-08 株各节段基因编码的蛋白氨基酸序列的同源性与美国草鱼呼肠孤病毒(AGCRV),GCRV 873(Ⅰ型),HGDRV(Ⅲ型)的同源性则比较低,从16.1%至46.7%不等,大节段基因核苷酸序列及编码的蛋白氨基酸序列其同源性比小节段的更高,其中S2 节段编码的RNA 依赖的RNA 聚合酶VP2 蛋白最为保守,同源性均在45%以上,小节段基因编码的蛋白,比如VP56,VP41,NS38,VP46的同源性只在20%左右甚至更低,如表2 所示。

表2 GD20-08 与其他分离株各节段核苷酸和编码的氨基酸序列相似性比较
2.6 遗传进化分析
RdRps 被认为是呼肠孤病毒作为保守的蛋白,根据水生呼肠孤病毒RdRp 蛋白的氨基酸序列构建的遗传进化树表明,所有的草鱼呼肠孤病毒分离株聚为3 大类,GD20-08 和GCRV-HZ08、GCRVGD108、Huan1307、GCRV106 及109的亲缘关系较近,与他们共同构成一个主干支,即为前面研究报道的基因Ⅱ型,GCRV 873 和GZ1208 等聚为另外一类,为前面研究报道的基因Ⅰ型,GCRV 104 则单独聚为一类,为基因型Ⅲ型。通过RdRps 蛋白分子进化分析,可将草鱼源呼肠孤病毒划分为3 个不同的进化群,如图5 所示。

图5 基于GCRV 各分离株VP2(RdRps)蛋白序列构建的遗传进化树
3 讨论
近年来,随着鱼类养殖业的发展,草鱼的产量每年都呈上升趋势,但草鱼呼肠孤病毒引起的草鱼出血病问题并未得到有效缓解,据不完全统计,每年由于草鱼出血病导致的经济损失至少达10 亿[3,14-15],严重影响了广大草鱼养殖者的积极性和我国淡水养殖业的健康发展,对于该疫病的研究意义也显得越来越重要。由于GCRV 各毒株间基因组存在较大的差异,因此,进行草鱼呼肠孤病毒野毒株的分离、鉴定及全基因组序列特征的分析,是明确GCRV 不同分离株遗传进化关系及开发草鱼出血病防控技术的关键。
通过对广东佛山采集到的病料进行病毒分离测序鉴定,结果表明,新分离株GCRV GD20-08 与GCRV-HZ08、GD108 等Ⅱ型GCRV 分离株的同源性较高。随后,通过电镜观察和间接免疫荧光鉴定进一步验证从患病草鱼体内分离到了一株新的草鱼呼肠孤病毒,该分离株在电镜下观察到的细胞内排布特点与Ⅱ型GCRV 相似,而与873 相差较大。用抗Ⅱ型GCRV 分离株的抗体进行间接免疫荧光鉴定表明,该抗体可以很好地识别GD20-08 分离株,而不能识别873 以及104 株,说明GD20-08 有较强的免疫交叉反应,而与873 及104 株的免疫交叉反应较弱或者没有交叉反应,该结果和Wang 等[16]的研究结果一致。回归感染结果表明新分离株GD20-08 对草鱼的致死率达到96.7%,为一株超强毒株,可以作为感染模型建立、疫苗免疫效果评价等研究中的标准强毒株。因此,GD20-08的分离鉴定,对于GCRV的病原学研究以及防控技术和防控产品的开发均具有重要的意义。
利用单引物扩增技术,获得了GD20-08 分离株11 个节段的全基因组序列,通过将GD20-08 和其他GCRV 分离株的基因组序列比对分析表明,GD20-08 与HZ08,GD108 等Ⅱ型GCRV 各节段核苷酸序列的同源性在95.8%至99.2%之间,氨基酸序列的同源性在94.3%至100%之间,与873、GZ1208 等Ⅰ型GCRV 及104 各节段核苷酸序列和氨基酸序列的同源性分别在28.6%至52%之间和16.1%至46.7%之间。有趣的是,被认为最保守的RdRp 蛋白在GCRV Ⅱ型中并非最为保守,而是S10 节段编码蛋白,同源性在99.4%至100%之间。而变异较大是S7 和S8 节段基因,同源性多数均在94%至98%之间。此外,通过对GD20-08 与HZ08、GD108 等Ⅱ型病毒各节段基因核苷酸序列及其编码蛋白氨基酸序列同源性比较发现,很多节段的核苷酸序列同源性相对较低,但是氨基酸序列的同源性则非常高,比如S2节段Huan1307 与AH528的核苷酸序列同源性为97.9%,氨基酸序列同源性则高达99.5%,S4 节段与109的核苷酸序列同源性为98.6%,氨基酸序列同源性则为99.9%;S10 节段与HZ08、GD108、AH528的核苷酸序列同源性分别为98.9%、98.9%和98.8%,而氨基酸序列同源性均为100%。这种现象在其他GCRV 分离株之间也存在,说明GCRV的多数变异均为无意变异。
总之,本研究从具有典型出血症状的草鱼体内分离到一株Ⅱ型GCRV 新分离株GD20-08,为一株毒力超强毒株。同时完成了GD20-08 全基因组序列测定,通过比较各节段基因和蛋白序列及基因组特征,表明新分离株GD20-08 与GCRV-HZ08、GCRV-GD108 等草鱼呼肠孤病毒较为相近,而与GCRV-873、GCRV-104、AGCRV 等病毒相差甚远,基于RdRp 蛋白的遗传进化分析也表明GD20-08 与GCRVHZ08、GCRV-GD108 等草鱼呼肠孤病毒亲缘关系较近,并且GCRV 总体上分为三个基因型,与前人研究的结果一致[5-7,10,17]。本研究结果为草鱼呼肠孤病毒的基因变异和遗传进化分析提供了重要的基因材料和理论基础。
