Faim2基因敲除增加小鼠心肌肥厚*
2022-02-15刘嘉仪石红杰胡宇峰李红良
刘嘉仪 周 妍 石红杰 胡宇峰,3 李红良
(1.武汉大学人民医院,武汉 430060)(2.武汉大学模式动物研究所,武汉 430071)(3.武汉大学中南医院,武汉 430071)
病理性心肌肥厚通常由压力刺激或由疾病引起,例如高血压、瓣膜性心脏病、心肌梗死和神经激素[1]。在疾病早期,心脏通过一系列反应对环境刺激作出反应,包括腔室容积,收缩期收缩,舒张期舒张增加心脏超负荷发挥补偿作用。然而,持续的病理性心肌肥厚最终导致收缩功能障碍和心力衰竭[2]。改善心肌肥厚可以降低心血管疾病的风险,然而由于对病理性心肌肥厚发病机制的认识有限,临床治疗方法尚未得到优化,因此迫切需要探索新的靶点来治疗病理性心肌肥厚。
Fas凋亡抑制分子2(Faim2)是一种膜蛋白,相对分子质量为35 000。作为跨膜Bax抑制基序(TMBIM)家族的成员[3],Faim2是一组进化上高度保守的跨膜蛋白,具有细胞保护和抗凋亡特性[4]。在其具体作用上,Faim2通过与LC3相互作用介导自噬调节[3]。另外有实验表明,Faim2在细胞培养和小鼠短暂性血管缺血模型中均具有保护作用[5-6],此外,Faim2可能与2型糖尿病患者发生心肌梗死的风险相关[7]。并且本实验室前期的一项研究报告了Faim2同家族成员,溶酶体膜蛋白1通过靶向TLR4降解改善病理性心肌肥厚[8]。可见,Faim2与心血管疾病有一定潜在联系。但目前还没有结果证实Faim2在心肌肥厚中的作用。而在心肌肥厚的过程中,自噬、氧自由基的形成、细胞凋亡等均为引起细胞损伤的主要机制[9]。基于Faim2在血管缺血模型和自噬中的调控,我们合理猜测其在心肌肥厚中可能发挥重要作用。因此,本实验室构建Faim2基因敲除小鼠,并使用主动脉弓缩窄(transverse aortic constriction,TAC)手术建立小鼠心肌肥厚模型,深入研究Faim2在心肌肥厚中的作用。
1 材料和方法
1.1 材料
1.1.1实验动物:本实验选取雄性SPF级C57BL/6J背景的Faim2基因敲除小鼠及其同窝对照小鼠,年龄8~10 周,体质量23~28 g,小鼠基因鉴定结果见图1。所有入组动物均饲养于武汉大学模式动物研究所的SPF级环境中,实验动物生产许可证【SCXK(鄂)2019-0004】,实验动物使用许可证【SYXK(鄂)2019-0013】。确保恒温、恒湿,12 h∶12 h昼夜间断照明,提供饲料与饮用水,保证动物自由进食。本文中所有动物实验项目均经武汉大学人民医院动物保护与利用委员会审查,伦理审批号:WDRM动(福)第20201206D号,并按照国家卫生研究院(NIH)实验动物保护与利用指南严格执行。
1.1.2试剂与仪器
1.1.2.1试剂:戊巴比妥钠(80~90 mg/kg,Sigma-Aldrich,P3761),细胞核染料(0100-20,Southern Biotech)RIPA(65 mmol/L Tris-HCl pH 7.5, 150 mmol NaCl, 1 mmol/L EDTA, 1% NP-40, 0.5%脱氧胆酸钠, 0.1% SDS, 1×蛋白酶抑制剂和1×磷酸酶抑制剂),伊红染液(BASO公司,BA-4024),苏木精染液(谷歌生物公司,G1004),天狼猩红染液(海德创业生物科技公司,26357-02),抗体:Faim2(Abcam公司,Ab72113)。
1.1.2.2仪器:使用小型动物超声成像系统(VEVO2100,Fujifilm Visualsonics),Chemi Doc MP 成像系统(Bio-Rad,Hercules),电泳仪(伯乐公司,Power Pace Basic),研磨仪,超声破碎仪,低温离心机(Thermo公司,LEGNED MICRO17)。
1.2 方法
1.2.1Faim2-KO小鼠构建:采用CRISPR-Cas9技术构建Faim2基因全敲小鼠。通过在线CRISPR设计工具(http://chopchop.cbu.uib.no/)预测Faim2的引物序列为5’-GCCCTCGGCGCCACCCTCCTAT GAGG-3’,设计1条sgRNA:5’-GCCCTCGGCGCCA CCCTCCTATGAGG-3’,将对应sgRNA的ssODNs通过退火形成双链DNA,将双链DNA连入经BsaI限制性内切酶酶切的pUC57-sgRNA(Addgene 51132)构建sgRNA表达载体。以上述构建的sgRNA表达载体为模板,使用如下引物通过PCR扩增含有T7启动子及引导序列的DNA片断:正向引物:GATCCCTAATACGACTCACTATAG;反向引物:AAAAAAAGCACCGACTCGGT。以所扩增的PCR产物为模板使用T7 Transcription Kit(Invitrogen, AM1354)进行体外转录;Cas9质粒(Addgene 44758)通过T7 ULTRA Transcription Kit(Invitrogen, AM1345)进行转录。将转录得到的Cas9和sgRNA的mRNA使用Transcription Clean-Up Kit(Invitrogen, AM1908)纯化后,通过FemtoJet 5247显微注射系统注射入C57BL/6小鼠的单细胞受精卵内,并将其移植到代孕雌鼠输卵管中,经过19 d妊娠之后得到F0代小鼠。小鼠出生2周后,取耳部或尾部组织,提取基因组DNA进行鉴定。基因编辑小鼠基因鉴定引物:Faim2-F:5’-CTCGCACAGGTTGG AAGAGT-3’,Faim2-R:5’-GAGACTTACTGGGGTC CACG-3’,野生型小鼠包含一段长325 bp的DNA序列,而突变小鼠(Faim2基因敲除小鼠)该DNA序列发生切割,切除19 bp序列,从而导致目的基因编码过程发生移码突变,从而实现目的基因的敲除。实验所用小鼠为突变体纯合子。
1.2.2病理性心肌肥厚模型建立:小鼠腹腔注射戊巴比妥钠麻醉,夹趾无明显反应为麻醉成功;继而将小鼠插管并连接到呼吸机观察小鼠胸廓波动。使小鼠右侧卧位,对手术区皮肤进行充分消毒,左胸皮肤钝性分离软组织和肌层,用眼科钳在第二、三肋骨水平打开胸腔,充分暴露手术视野[10]。钝性分离主动脉弓降支与左肺并使用7-0缝线穿过。在血管上方平行放26 或27 g的针将血管打结后拔出。术后关闭胸腔,多普勒超声心动图证明手术成功。假手术组进行相同操作,但没有进行主动脉结扎。小鼠自主呼吸后拔除气管插管,将小鼠放回饲养笼内,放置饲料和饮用水,密切观察状态。
1.2.3心脏组织病理学检测:用10%甲醛固定心脏,脱水,石蜡包埋。石蜡切片厚度一般为5 μm,使用苏木精-伊红染色和天狼星红染色观察心脏切片的组织病理学和胶原沉积,并用细胞核染料标记细胞核。用图像分析系统(Image-Pro Plus 6.0)测量心肌细胞横截面积和左心室胶原面积[11]。
1.2.4Western blot 鉴定基因小鼠构建结果:小鼠左心室组织加入含蛋白酶抑制剂的Radio Immunoprecipitation Assay 缓冲液和钢珠,放入参数为30 Hz的研磨仪中充分研磨90 s,取出钢珠后,样品使用5K Hz的超声破碎仪裂解120 s,待裂解充分,置于4℃,12 000 r/min 离心 30 min。离心后取上清并用BCA 试剂盒定量蛋白浓度。蛋白变性后于10%的SDS-PAGE进行电泳,设置参数80 m V恒压;2 h。电泳完成后,以300 mA恒流转膜1 h,将蛋白条带转移至PVDF膜上,并使用5%的脱脂牛奶室温封闭1 h,随后在4℃冰箱中一抗孵育过夜。使用 Chemi Doc MP 成像系统进行显影。
1.3 统计学方法
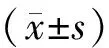
2 结果
2.1 Faim2-KO小鼠构建
为研究Faim2在病理性心肌肥厚中的作用机制,本实验构建了Faim2基因敲除(Faim2-KO)小鼠(图1A),并通过Western blot验证了基因敲除效率(图1B),结果显示,Faim2基因敲除小鼠构建成功。
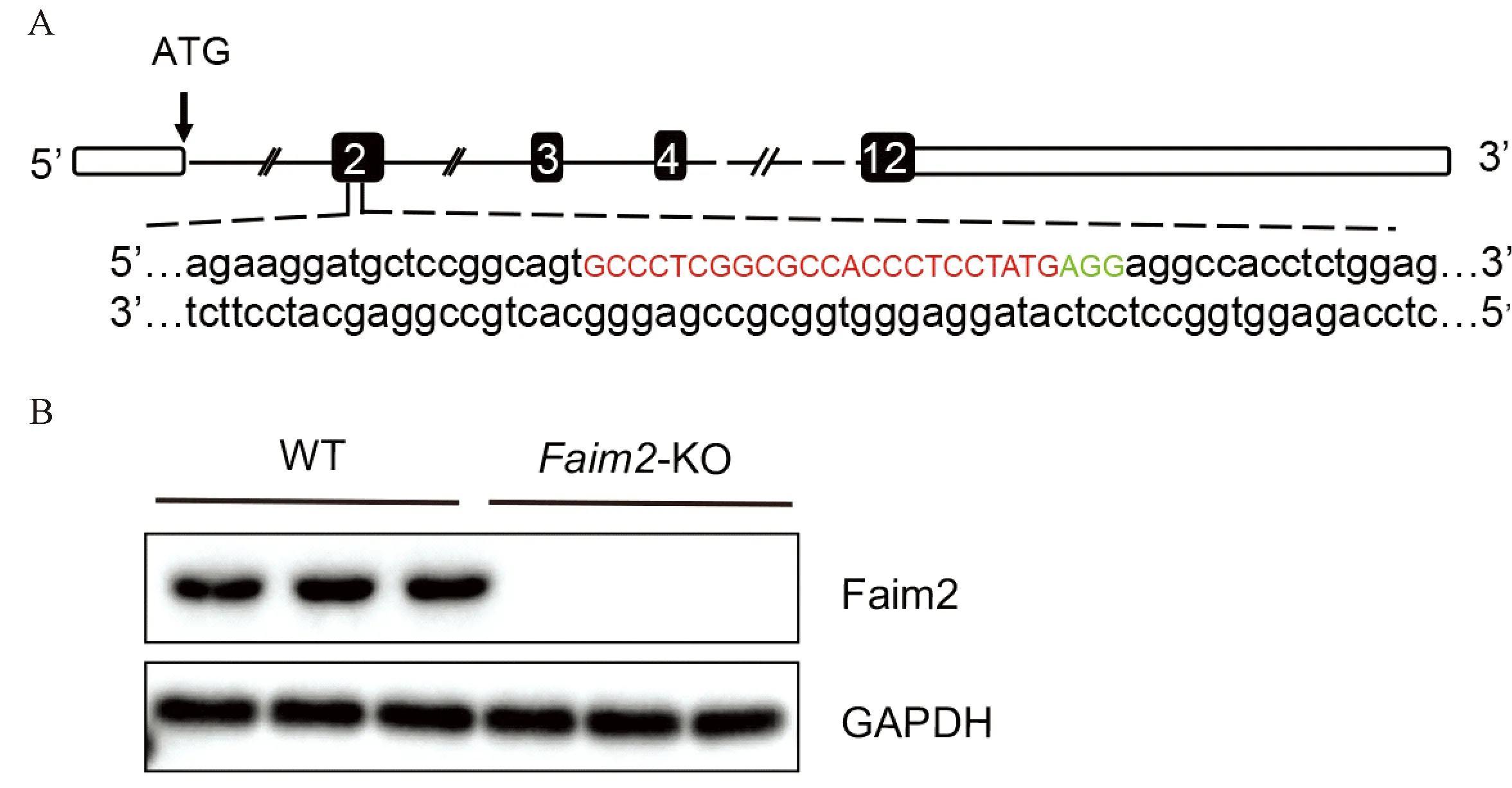
注:A.C57/6J小鼠Faim2基因示意图(E2,199 bp)。翻译起始位点(ATG)位于E1,单引导RNA(SgRNA)靶位点以红色突出显示;B.WT小鼠与KO小鼠心脏组织中Faim2的蛋白表达水平
2.2 Faim2敲除对小鼠病理性心肌肥厚的影响
与WT小鼠相比,Faim2-KO小鼠在TAC 4周后心脏大小明显增大,且室壁增厚,心肌细胞横截面积显著增加。以上结果提示Faim2-KO心肌肥厚程度明显加重(图2)。
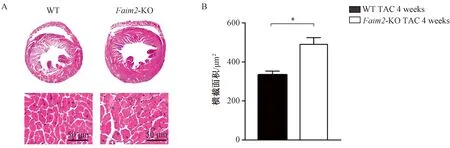
注:A.TAC术后4周,WT组和Faim2-KO组小鼠心脏切片苏木精-伊红染色的代表性图像(n=5);B.两组平均横截面积的定量结果,*P<0.05
2.3 Faim2敲除对压力负荷所诱导的心肌纤维化的影响
心脏切片的天狼星红染色结果显示,在 TAC手术 4周后,Faim2-KO 小鼠的胶原沉积严重,心肌纤维化程度要明显强于 WT 组(图3)。

注:A.TAC术后4周,WT和Faim2-KO小鼠心脏横切面天狼星红染色的代表性图像(n=5)。标尺,100 μm;B:两组左心室间质胶原容积的定量结果,*P<0.05
3 讨论
本研究构建了Faim2基因敲除小鼠,并以其与WT为实验对象,在主动脉弓缩窄手术4周后衡量通过超声及组织病理学检测了Faim2对于压力诱导的病理性心肌肥厚的作用。Western blot结果显示,Faim2基因敲除小鼠构建成功,且Faim2敲除后,实验组小鼠室壁变厚、心肌细胞增大、心肌胶原沉积增多。以上结果表明,Faim2的缺失进一步加重了病理性心肌肥厚的发展。
作为跨膜BAX抑制剂1母体(TMBIM)家族的一员,Faim2在细胞凋亡和坏死中发挥抑制作用[12]。以往的研究证实,Faim2通过与Fas受体直接相互作用,以及通过与Bcl-xl相互作用调节内质网中钙的释放来保护Fas,保护神经元免受死亡受体诱导的细胞凋亡,并参与轴突生长和神经元可塑性[13]。但是关于Faim2其他的功能与作用机制却没有深入研究。事实上,有研究发现,Faim2是一种膜蛋白,定位于溶酶体上,并且通过与LC3相互作用介导自噬调节[3]。自噬的特点是进化上保守的过程,即溶酶体依赖的细胞质组分和受损细胞器(如内质网、过氧化物酶体和线粒体)的降解,以及消除细胞内病原体[14]。并且自噬是病理性心肌肥厚的核心调节机制。在心脏中,自噬主要通过消除蛋白质聚集体和受损的细胞器,保护心脏免受饥荒、局部缺血和过度的β-肾上腺素刺激,在细胞应激过程中起促进生存的作用,过度自噬或者是自噬失调都会引起细胞受损、心肌肥厚[15]。基于Faim2对自噬的调控以及前文的研究中Faim2对于其他心肌肥厚因素(如缺血和细胞损害)的影响,我们猜测Faim2可能通过调节自噬系统而达到改善心肌肥厚的作用,这也将是我们未来的工作方向。
