陆地棉GhERL1基因的鉴定及生物信息学分析
2022-02-15刘文豪孔宪辉王旭文司爱君马麒赵福相余渝
刘文豪,孔宪辉,王旭文,司爱君,马麒,赵福相,余渝
(新疆农垦科学院棉花研究所/农业农村部西北内陆区棉花生物学与遗传育种重点实验室,新疆 石河子 832000)
植物细胞外信号主要由质膜定位的类受体蛋白激酶(Receptor-like kinases,RLKs)感知。类受体蛋白激酶是由一个信号肽、一个富含半胱氨酸的细胞外结构域、一个跨膜结构域和一个预测的细胞内激酶结构域组成的一类跨膜蛋白[1]。这些激酶参与细胞间通信协调植物组织的生长和发育,控制植物地上器官的伸长、叶片形成、花的发育和表皮分化[2],进而影响不同植物物种的非生物胁迫耐受性。棉花是我国重要的经济作物,对抗病、抗逆优质棉的培育是解决产量问题的根本途径,而分析关键基因的调控网络、差异表达及理化特性具有重要研究意义。
拟南芥ERfs家族受体(ERECTAfamily receptor,ERfs)是一个古老的富含亮氨酸重复序列的RLKs家族,该基因家族由ERECTA(ER)、ERECTA-LIKE1(ERL1)和ERL2组成[3]。研究表明,拟南芥ER介导的信号通路通过调节核小体动力学来促进细胞增殖,调节花序结构形成[4]。整个拟南芥ER家族基因的缺失导致了显著的矮化症、侧向器官尺寸减小和花朵发育异常,包括花瓣极性扩张、心皮伸长以及花药和胚珠分化的缺陷[5]。青枯病菌极易引起拟南芥突变体植株Ler(Landsbergerecta)产生萎蔫病,而转基因植株Ler对青枯病菌的抗病性显著增强。可能是ER基因通过感知来自青枯病菌的外部生物刺激,然后激活信号通路,导致对病原体的抵抗力增加[6]。目前,已经在菠菜、马铃薯、葡萄、黄瓜、大豆、高粱、杨树、小麦、水稻、番茄等植物中有关于ER基因家族成员研究的相关报道。大豆质膜上ER将光信号传递给胞质中的光敏色素,光敏色素进入核内与转录因子相互作用,启动赤霉素和生长素相关基因表达,促进植株下胚轴的伸长[7]。高粱ER家族基因SbER1和SbER2的表达水平均随着干旱胁迫程度的加深而逐渐提高,可能在抗旱机制中发挥作用[8]。PdERECTA改变气孔的发育模式降低气孔密度,从而限制水的消耗,增强杨树的耐旱性[9]。高温胁迫下小麦TaERECTA基因的表达促进过氧化物酶和相关底物的合成,提高对胁迫产生活性氧的分解速率,以保护细胞免受高温胁迫引起的损伤和死亡[10]。过表达拟南芥ER的转基因番茄和水稻品系在温室和田间试验中显示出更好的耐热性。此外,过表达ER的转基因拟南芥、番茄和水稻植物的生物量增加[11]。
迄今为止,陆地棉ERECTA家族成员ERL1基因尚未被综合分析,对生物和非生物胁迫的反应过程中发挥的作用尚未得知,其涉及的调控网络及差异表达尚不清楚。为了研究ERL1基因在植物生长发育和胁迫响应中的作用,本研究通过生物信息学方法获取陆地棉ERL1基因序列,进一步分析其理化性质、序列特征、亚细胞定位、染色体位置,并对不同胁迫条件下陆地棉ERL1基因的表达模式进行研究。实验结果将培育抗逆优质高产的新品种提供新的基因资源。
1 材料与方法
1.1 GhERL1蛋白理化性质分析
在NCBI(https://www.ncbi.nlm.nih.gov/)数 据 库下载陆地棉ERL1基因序列和蛋白序列,利用SMART网站(http://smart.embl.de/)进行结构域的预测分析,TMHMM2.0(https://services.healthtech.dtu.dk/)分析蛋白的跨膜结构,ProtScale(https://web.expasy.org/protscale/)预测蛋白亲疏水性。使用Prot-Param(https://web.expasy.org/protparam/)分 析理论等电点、带正负电荷的氨基酸残基、分子式、总原子数、不稳定系数、脂肪指数。
1.2 GhERL1蛋白的二级结构和三级结构分析
在SOPMA网站(https://npsa-prabi.ibcp.fr/)页面输入氨基酸序列,依据多序列比对和多级系统进化分析,设定默认参数,预测二级结构的四种状态[12]。在线网站SWISS-MODEL(https://swissmodel.expasy.org/)上传氨基酸序列,运行建模二级结构进一步折叠形成的结构域[13]。
1.3 GhERL1蛋白的亚细胞定位分析
为准确了解GhERL1蛋白在表达调控中所具有的功能,本研究从蛋白质数据中筛选特征向量构建数据集,使用在线网站Predictprotein(https://predictprotein.org/)和Plant-mPLoc(http://www.csbio.sjtu.edu.cn/)进行亚细胞定位预测。
1.4 GhERL1基因的表达模式分析
为了研究陆地棉发育过程中GhERL1基因的差异表达,从陆地棉转录组数据库(PRJNA248163)获取GhERL1基因在根茎叶不同组织的基因表达量,以及在开花后不同时间纤维、胚珠等部位的基因表达量。使用TB-Tools软件和GENESCLOUD网站进行差异表达分析、热图构建。
1.5 GhERL1蛋白互作网络分析
利用String(https://string-db.org/)在线工具分析GhERL1蛋白-蛋白相互作用网络[14]。输入蛋白序列,根据蛋白名称、来源、注释和序列相似性来进行蛋白质关联的功能性和物理性分析。
2 结果与分析
2.1 GhERL1蛋白理化性质分析
GhERL1蛋白具有ER家族典型的LRR富集区和(S_TKc)丝氨酸/苏氨酸蛋白激酶区,参与接收上游配体信号(图1A)。GhERL1蛋白序列含有998个氨基酸,在N端存在一个跨膜区位于第20到39个氨基酸之间,而第1-19个氨基酸在膜内,第40-998个氨基酸在膜外,跨膜区参与外部信号的传输(图1B)。每个位点的氨基酸得分正值表示疏水性,负值表示亲水性,GhERL1蛋白平均亲/疏水性值为-0.027,具有较弱的亲水性(图1C)。而通过Prot-Param分析得知,GhERL1蛋白序列分子量为110198.57,理论等电点为5.76,带负电荷氨基酸残基有100个,带正电荷氨基酸残基有80个,分子式C4916H7832N1304O1480S41,总 原 子数为15573。不稳定系数34.14,属于稳定蛋白类别。脂肪族氨基酸指数105.19。
2.2 GhERL1蛋白的二级结构和三级结构分析
SOPMA分析发现(图2),GhERL1的蛋白质序列含有998个氨基酸,而在这些氨基酸的分布排列中α螺旋403个,所占比例为40.38%;β转角29个,所占比例2.91%;延伸链120个,所占比例为12.02%;无规卷曲446个,所占比例为44.69%。

图2 GhERL1蛋白二级结构预测Figure 2 Prediction of secondary structure of GhERL1 protein
基于结构基因组学,把GhERL1的蛋白序列输入在线网站SWISS-MODEL,通过搜索序列结构模型相同的同源模型建立骨架,得到该蛋白三级结构的Cartoon模型,而这个模型的氨基酸排列顺序与二级结构预测基本相符,注释表明蛋白三级结构含有类受体蛋白激酶特有的丝氨酸/苏氨酸结构域,进一步验证了GhERL1蛋白结构的准确性(图3)。
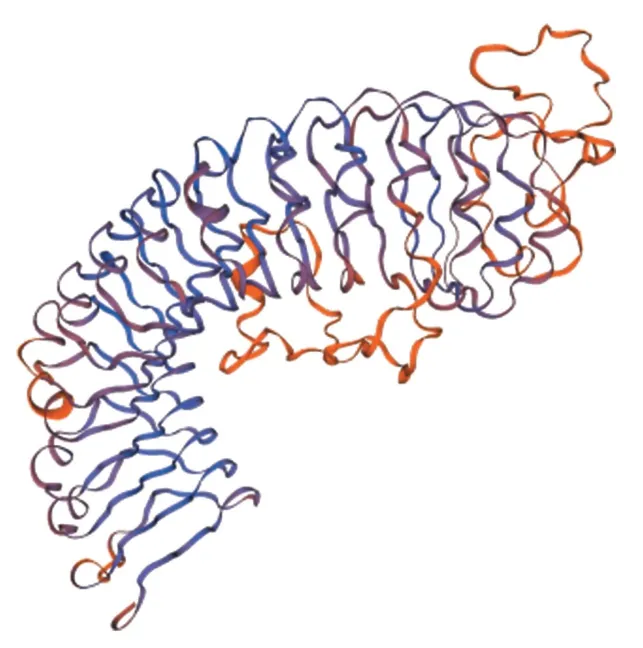
图3 GhERL1蛋白三级结构预测Figure 3 Tertiary structure prediction of GhERL1 protein
2.3 GhERL1蛋白的亚细胞定位分析
细胞中蛋白质合成后转运到特定的细胞器中,只有转运到正确的部位才能参与细胞的各种生命活动,如果定位发生偏差会对细胞功能产生重大影响。亚细胞定位的生物信息学研究作为亚细胞蛋白质组学实验研究的补充,相互验证与促进。本研究通过Plant-mPLoc预测结果表明该GhERL1蛋白定位在细胞膜,PredictProtein网站预测结果同样表明该蛋白定位在细胞膜(图4)。

图4 GhERL1蛋白亚细胞定位Figure 4 Subcellular localization of GhERL1 protein
2.4 GhERL1基因的表达模式分析
利用陆地棉转录组数据库对GhERL1基因进行表达模式分析。根据基因表达量值分析GhERL1基因的表达模式,在不同发育时期的子叶中表达存在差异性,第48小时的子叶表达量最高,第24小时的子叶中表达量最低(图5A)。在纤维形成的第20天基因表达量最高,在第10天表达量最低(图5B)。在开花后第1天的胚珠中表达量最高,第10天的胚珠中表达量最低(图5C)。GhERL1基因在陆地棉植株的根、茎、叶的表达模式存在显著的差异性,在根中的表达量最高,而在茎中的表达量相对最低(图5D)。
在模拟的冷、热、盐、干旱胁迫下,GhERL1基因的表达量与对照(未处理)相比,具有一定的差异性。在冷胁迫3小时的时候表达量最高,干旱胁迫6小时的时候表达量最高,热胁迫3小时的时候表达量最高,盐胁迫12小时的时候表达量最高(图5E)。当受到生物或非生物胁迫时,GhERL1基因通过上调或下调表达发挥其功能。推测其可能在低温、干旱、盐碱化等环境的胁迫中发挥重要作用。
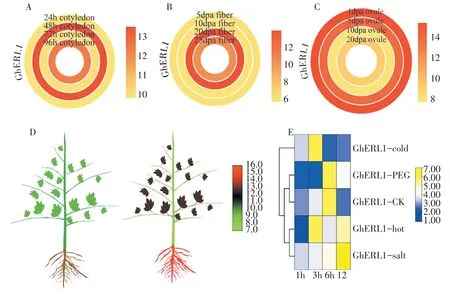
图5 GhERL1基因在不同组织的表达分析Figure 5 Expression analysis of GhERL1 gene in different tissues
2.5 GhERL1蛋白互作网络分析
蛋白通过彼此之间的相互作用构成蛋白质相互作用网络,来参与生物信号传递、基因表达调节、能量和物质代谢及细胞周期调控等生命过程的各个环节[15]。在STRING数据库中的蛋白互作网络中可找到GhERL1蛋白和EPF2(表皮模式因子2,Epidermal patterning factor 2)、TMM(受体类蛋白,Protein too many mouths-like)、SERK1(体细胞胚胎发生受体激酶1,Somatic embryogenesis receptor kinase 1)、BRL3-1(受体样蛋白激酶BRI1-like 3,Receptor-like protein kinase BRI1-like 3)等蛋白存在相互作用(图6)。气孔作为水气交换的通道,对于优化植物光合效率、增强环境适应能力具有重要的作用。植物可以通过改变气孔的孔径和分布适应环境胁迫,减少植株损伤[16]。GhERL1蛋白与TMM形成复合体参与识别气孔调节肽EPF2等,调节气孔发育过程中免疫应答,调控内在生理、发育过程以适应不断变化的环境。
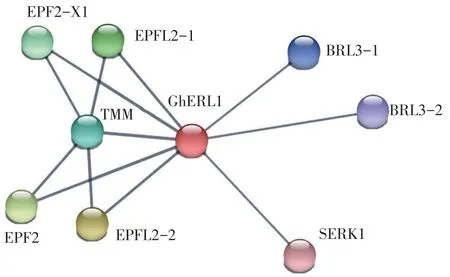
图6 蛋白互作网络分析Figure 6 Protein interaction network analysis
3 讨论
类受体蛋白激酶是植物生长的重要调节因子,ERf家族受体与气孔发育、茎尖分生组织功能、花细胞分化和生物/非生物胁迫有关[17]。本研究通过利用生物信息学方法对陆地棉GhERL1的理化性质、结构功能和表达模式等进行分析。
通过理化性质分析发现GhERL1蛋白的平均疏水性为-0.027,具有较弱的亲水性。而疏水性是水对非极性分子产生的排斥作用,在蛋白质的结构、构象及与其他蛋白质的相互作用等方面具有重要作用,与蛋白质的功能和性质密切相关。蛋白质的不稳定系数与其结构有关,GhERL1不稳定系数34.14,属于稳定蛋白类别。GhERL1蛋白二级结构主要由α-螺旋和无规卷曲构成,β-转角和延伸链的占比较少。GhERL1蛋白三级结构建模有助于了解GhERL1蛋白在结构的可视化,以及蛋白一蛋白相互作用和蛋白质功能分析方面的应用。植物蛋白质的亚细胞定位是功能基因组学的重要内容,而植物细胞的主要分区包括细胞膜和其他内膜系统、细胞核、细胞质以及位于其中的线粒体、叶绿体、高尔基体和内质网等各种细胞器[18]。GhERL1蛋白定位于细胞膜,感知膜外的富含半胱氨酸的多肽,在组织中实现细胞间的通信。
本研究分析了GhERL1基因在陆地棉不同组织的表达模式,发现GhERL1基因在叶中的表达量较高,可能参与叶片细胞发育,调控器官形态建成。GhERL1基因在根组织具有高表达量,而根组织具有吸收水分和固定地上部分的功能,还具有向土壤输入有机质和感知根部周边环境变化的作用,推测其在根系网络中具有重要功能。GhERL1基因在陆地棉植株的不同组织中均具有表达量,可能与陆地棉的整个生长过程相关。而这不同组织的表达量存在差异性,表明其在不同组织的不同发育阶段发挥着特有的功能。在蛋白-蛋白调控网络中,发现GhERL1编码蛋白与EPF2、TMM、SERK1、BRL3-1等蛋白存在相互作用。拟南芥EPF2在叶片表皮细胞发育中调节细胞密度,影响气孔形成,可在不影响养分吸收的前提下提高植物的抗旱性,对植物的生存和产量至关重要[19]。TMM的突变会导致拟南芥叶片的气孔模式缺陷,会消除茎部的气孔形成。陆地棉SERK1基因编码富含亮氨酸的重复受体蛋白激酶,在花药发育和花粉粒的形成中有一定作用[20]。组成相互作用网络的这些编码蛋白主要参与信号转导等途径,它们可能在陆地棉生长发育和响应胁迫反应中起重要作用。
4 结论
棉花在生长发育过程中,会受到高温、盐碱、干旱、营养缺乏、病菌侵害等各种恶劣因素影响。然而,棉花细胞可以感受外界逆境信号,激活抗逆信号通路,引起自身防御机制反应。本研究分析了GhERL1的序列结构和功能预测模拟,为大田育种广泛应用GhERL1改良作物生产潜力提供科学依据。而在GhERL1蛋白互作调控网络发现的这些蛋白质和基因有可能在未来解决一系列严重的农业问题,包括提高作物用水效率,以及改善高温、盐碱压力对作物的影响。
