紫花苜蓿叶片和根系膜脂过氧化及C、N特征对水分和N添加的响应
2022-02-15白婕臧真凤刘丛昝看卓龙明秀王可珍屈洋何树斌
白婕,臧真凤,刘丛,昝看卓,龙明秀,王可珍,屈洋,何树斌*
(1.西北农林科技大学草业与草原学院,陕西 咸阳 712100;2.宝鸡市农业科学研究院,陕西 岐山 722400)
紫花苜蓿(Medicago sativa)是一种多年生豆科牧草,具有营养价值高、产量高、固氮肥田等特点[1]。紫花苜蓿的高产对水分的需求较为旺盛,在干旱半干旱地区,水分是制约紫花苜蓿生产的重要因素之一[2]。干旱胁迫下,紫花苜蓿细胞膜脂过氧化,丙二醛(malondialdehyde,MDA)含量升高[3],净光合速率降低[4]、生物量减少[5]、营养价值降低[6]、碳(carbon,C)、氮(nitrogen,N)代谢受到抑制[7];与此同时,紫花苜蓿调整根冠比[8],启动渗透调节和抗氧化机制[3]等,增强其在干旱胁迫下的适应能力。然而,N肥管理是一项提高植物抗逆能力的重要措施[9]。研究表明,一定浓度外源N肥的投入能够缓解干旱胁迫[5]和盐胁迫[10-11]对紫花苜蓿的不利影响,可提高其在逆境胁迫下的生产能力。增加土壤中无机N的有效性调节了豆科植物的N营养,优化生物固N与无机N吸收的兼容性,是促进其在逆境胁迫下生长能力的重要机制之一[12]。
根系是紫花苜蓿储存营养物质[13],感知土壤水分匮缺和营养物质有效性的重要器官,在适应干旱胁迫的过程中发挥着重要作用[14]。由于根系在研究中取样较为困难,对多年生饲草根系的研究还相对不足。紫花苜蓿根系是否受干旱胁迫的影响[5,8],目前也没有较为一致的研究结论。此外,叶片和根系分别处于地上和地下不同环境,其物理、化学属性及时间和空间上资源获取策略也存在差异[15]。紫花苜蓿叶片和根系膜脂过氧化程度及C、N状态响应水分胁迫和外源N的添加是否具有较为一致的规律,目前也鲜有报道。因此,本研究以紫花苜蓿为研究对象,研究紫花苜蓿叶片和根系细胞膜完整性、C、N含量、C/N、稳定性同位素C(δ13C)和稳定性同位素N(δ15N)对不同水分和外源N添加的响应规律,以期为全面掌握紫花苜蓿各器官对水分和外源N添加的响应策略,为我国旱作农业区制定精准的紫花苜蓿水肥管理制度提供理论依据。
1 材料与方法
1.1 供试材料
选用紫花苜蓿金皇后(M.sativacv.Golden Empress)为供试品种,种子来自宁夏绿地草业科技有限公司。饱满均一的紫花苜蓿种子经95%酒精灭菌5 min,经蒸馏水漂洗干净后,置于垫有湿润滤纸的培养皿中并在4℃的培养箱萌发7 d。选择生长均一且健康的幼苗移栽到装有土壤的花盆中(14 cm×16 cm×22 cm),每盆定苗一株。土壤取自农田土壤耕作层,在装盆之前,过2 mm筛以去除石块及杂质。土壤养分如下:全C 13.5 g·kg-1,总N 1.26 g·kg-1,全磷0.8 g·kg-1。
1.2 试验设计
试验于2018年3-7月在西北农林科技大学草业与草原学院温室内进行。试验设土壤水分处理和外源N添加两个因素。土壤水分处理设水分胁迫处理(water stress,WS)(35%±5%)田间持水量(field water capacity,FWC)和充分灌溉且未渍水(well-watered,WW)(70%±5%)FWC两个梯度[16],每个水分处理下设置3个不同浓度的N添加梯度[17]:0、5和10 mmol·L-1(Nn、Nm和Nh)。移栽49 d后采用称重法每隔2 d控制不同水分梯度下的土壤含水量,同时以尿素(CH4N2O)为原料(含N量为46%)进行外源N的添加。每处理15盆植物,共计90盆紫花苜蓿。
1.3 测定指标及方法
处理28 d后将各处理清洗干净的紫花苜蓿带回实验室。一部分样品,用吸水纸擦干净后先于105℃的烘箱中杀青10 min后,在80℃的烘箱内烘干24 h至恒重,并用研钵等将干燥的叶片和根磨成粉末,保存在低温冰箱中待测C、N营养物质和稳定性同位素δ13C和δ15N;另一部分样品用液N固定后迅速保存在-80℃超低温冰箱中用于MDA的测定。参照李合生[18]的硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定MDA含量。有机碳用重铬酸钾外加热法测定[19]。全氮在待测样品经H2SO4-H2O2消煮后,用AA 3连续流动分析仪测定[20]。C、N同位素(δ13C和δ15N)由中国农业科学院农业环境与可持续发展研究所分析测试中心采用ATC-185稳定性同位素质谱仪测定[21]。
1.4 数据处理
使用Excel软件对数据进行整理,使用SPSS 25.0进行双因素方差分析(two-way ANOVA),并使用Origin 2021绘制图表。
2 结果与分析
2.1 水分和外源N添加对紫花苜蓿叶片和根系中MDA含量的影响
总体来看,水分和N添加对紫花苜蓿叶片MDA有显著影响(P<0.01),但对根系MDA的影响不显著(P>0.05)(图1)。在Nn和Nm处理下,水分胁迫显著提高了叶片MDA的含量(P<0.05),但在Nh处理下差异不显著(P>0.05)。而在根系中,在Nn和Nm处理下,MDA对水分的响应规律与叶片相反。与Nn相比,Nm和Nh有提高紫花苜蓿叶片和根系MDA含量的趋势,但差异不显著(P>0.05)。
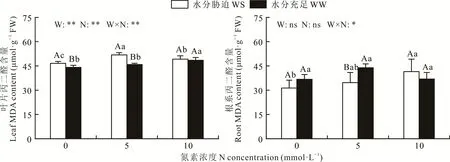
图1 水分和外源N添加对叶片和根系中MDA含量的影响Fig.1 MDA content in leaves and r oots subjected to water and exogenous nitr ogen addition
2.2 水分和外源N添加对紫花苜蓿叶片和根系C、N含量及C/N的影响
各处理下,叶片N含量在30~35 mg·g-1之间波动,根系N含量在15~20 mg·g-1之间波动,叶片N含量明显高于根系(图2)。水分对紫花苜蓿叶片和根系的C含量没有显著影响。相比水分对紫花苜蓿叶片和根系N含量的影响,外源N添加对紫花苜蓿叶片和根系N的影响更为显著。在WS处理下,与Nn和Nm相比,Nh显著提高了紫花苜蓿根系N含量(P<0.05)。在WW处理下,Nh处理显著提高了叶片N含量(P<0.05),但在WS处理下差异不显著(P>0.05)。根系N含量对水分和外源N添加的响应与叶片相反。在相同外源N添加下,WS处理显著提高了根系N含量(P<0.05)。水分对叶片的C/N影响差异不显著,但是WS处理明显降低了根系的C/N,特别是在Nn和Nh处理下差异显著(P<0.05)。在WS处理下,与Nn和Nh相比,Nm处理显著提高了根系C/N(P<0.05)。

图2 水分和外源N添加对叶片和根系C、N含量及C/N的影响Fig.2 Carbon,nitrogen content and C/N in leaves and roots subjected to water and exogenous nitrogen addition
2.3 水分和外源N添加对紫花苜蓿叶片和根系δ13C和δ15N的影响
如图3所示,紫花苜蓿叶片和根系的δ13C分别在-31~-29与-28~-25之间波动,δ15N均在-1~-4之间波动。在WW和WS处理下,随着外源N的添加,紫花苜蓿叶片和根系δ15N均显著降低(P<0.05)。在WW处理下,外源N添加显著增加了根系和叶片δ13C,但在WS处理下无显著影响。在相同的氮添加水平下,WS提高了叶片δ15N(P<0.05)、叶片δ13C(P>0.05)和根系δ13C(P<0.05),但却降低了根系δ15N(P>0.05)。
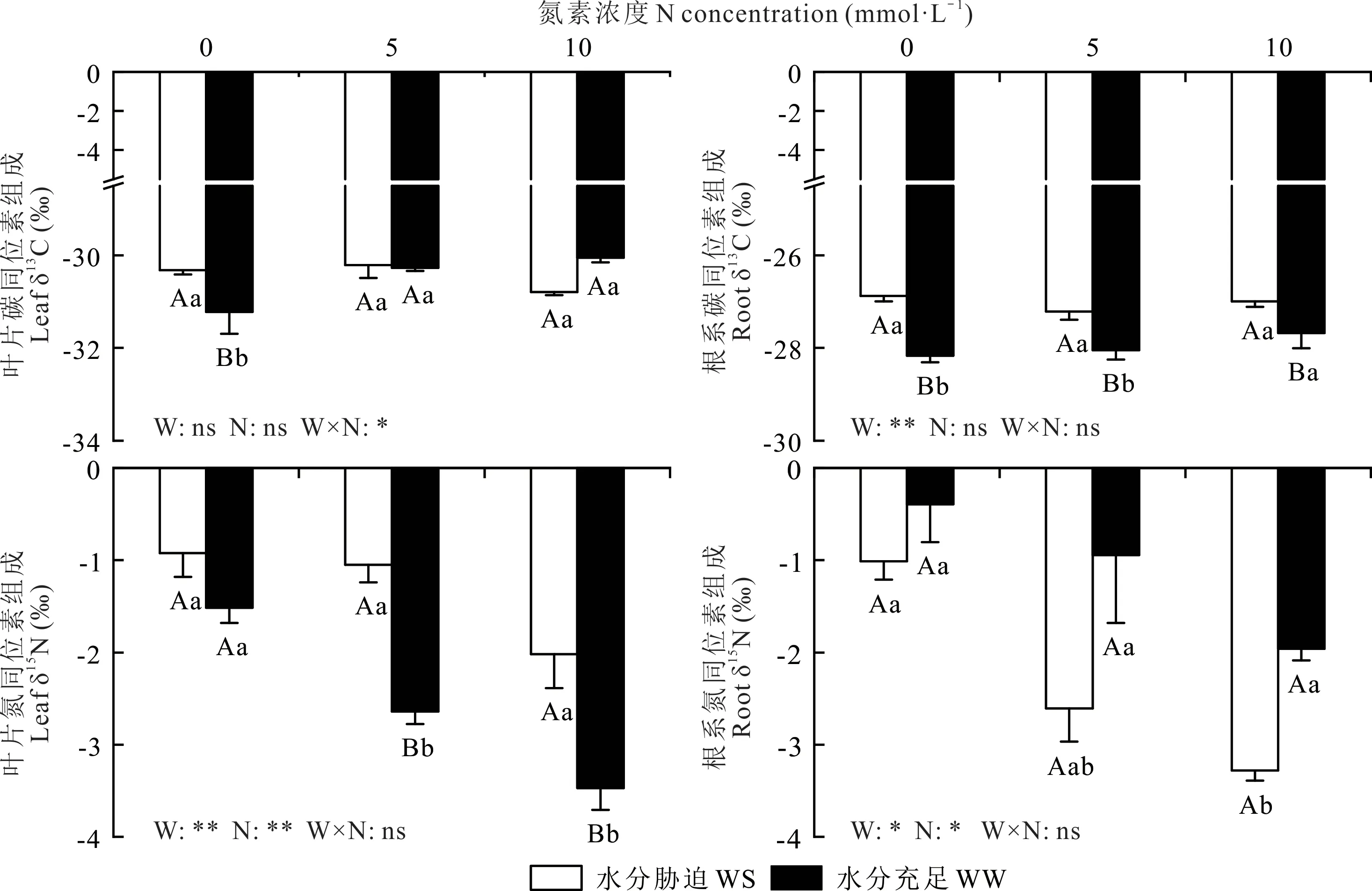
图3 水分和外源N添加对叶片和根系δ13C和δ15N的影响Fig.3 δ13C andδ15N in leaves and roots subjected to water and exogenous nitrogen addition
3 讨论与结论
丙二醛是逆境胁迫下细胞膜多不饱和脂肪酸分解的产物,其含量的高低代表植物受到伤害程度的大小[22]。本研究中水分胁迫下紫花苜蓿叶片膜脂过氧化,丙二醛含量增加,这与他人对紫花苜蓿的研究结果一致[3,23]。N是影响和调解植物抗逆性的重要环境因子[9]。研究表明,一定浓度的外源N投入能够缓解盐胁迫和干旱胁迫对紫花苜蓿生长的影响[5,11],提高其生产能力。然而,本研究中外源N的施入并没有缓解紫花苜蓿叶片和根系中膜脂过氧化的程度,这意味着N素对紫花苜蓿逆境胁迫的缓解作用受胁迫程度、物种抗逆性、植物生长阶段及N肥种类等的影响[11]。
本研究中水分胁迫和外源N的添加并没有显著影响紫花苜蓿叶片C含量,这可能与供试品种的抗旱能力有一定关系。此外,紫花苜蓿根系内储存大量的碳水化合物,这些营养物质可通过韧皮部转移到其他器官,调整了叶片中光合产物的降解和转运等[24]。值得注意的是,本研究中外源N的添加提高了水分胁迫下紫花苜蓿根系的C含量。这可能有两方面的原因:首先,在逆境胁迫或营养匮乏时一定浓度外源N的添加增加了紫花苜蓿根系蔗糖的含量,优化了根系形态并提高了根系营养物质的获取能力[5]。其次,外源N的添加在一定程度上抑制了紫花苜蓿的生物固氮能力,降低了根瘤形态建成及生物固氮对光合产物C的消耗,故更多的光合产物C被转运到紫花苜蓿根系[25]。紫花苜蓿叶片天冬酰胺N代谢酶活性对水分胁迫是较为敏感的[7],紫花苜蓿叶片的N代谢也易受到水分胁迫的抑制。然而,本研究中水分胁迫没有改变紫花苜蓿叶片N含量,但增加了紫花苜蓿根系的N含量。这是因为根系首先接收到来自水分胁迫的信号,继而启动一系列抗旱响应机制,例如调整了营养物质的分配策略等[26],根系会优先成为N库,谷氨酸、脯氨酸、甘氨酸和色氨酸等含量随之增加,从而提高了根系细胞维持细胞水分的能力[7]。与预期相反的是,水分胁迫下并没有降低紫花苜蓿叶片N的浓度,但增加了在水分充足条件下紫花苜蓿叶片氮的浓度。这说明此时紫花苜蓿生物固氮和矿化N之间达到了平衡[27]。外源N的添加增加了紫花苜蓿N的积累这个观点是有局限性的,受到水分状态、植物器官[5]及生长年龄等的影响[28]。外源N的添加可缓解根瘤受到的来自水分胁迫的伤害,并促进了脯氨酸、抗氧化酶类物质等的合成[29]。这是本研究中高浓度N的添加提高水分胁迫下紫花苜蓿根系N含量的潜在原因。然而,N的添加并没有改变水分充足情况下根系N的含量,这说明苜蓿根系N的积累受到源库关系的影响[17,30],且水分状态能够调整紫花苜蓿N的吸收和转运策略对外源N添加的响应。
植物器官的结构功能和生理特征的差异,是影响其计量学特征的重要原因[31]。本研究中紫花苜蓿根系C/N较叶片更高,且对水分和外源N添加更为敏感。水分是调控植物C/N的另外一个重要因素。但在本研究中水分胁迫没有改变叶片的C/N,降低了紫花苜蓿根系C/N。这可能是由于水分胁迫下植物分解贮藏碳水化合物,并通过木质部向根系转运[32],用于合成脂类增强其根系在逆境胁迫下获取限制性资源的能力[33]。研究表明,干旱胁迫下一定浓度外源N的添加增加了紫花苜蓿根系氨基酸的合成,提高了紫花苜蓿根系的C/N[5],本研究结果与此是一致的。此外,本研究中水分胁迫下外源N的添加对根系C/N计量比的影响比在充分供水情况下更为敏感,这与其他的一些研究结果是一致的[34]。然而,植物的C/N对环境因子的响应受植物的生长阶段、碳氮同化策略[35]、营养物质添加速率和季节[32]及多年生牧草年龄和茬次等因素的影响[36]。因此,进一步的研究应深入阐明紫花苜蓿C/N对水、N添加的响应策略,为紫花苜蓿草地的水肥管理策略提供理论依据。
植物不同器官具有同位素分馏效益[37]、光合C同化的途径及其转运策略[38]、含N量不同等特点[39],故植物叶片和根系δ13C和δ15N存在明显的差异。本研究中水分胁迫下植物分解贮藏在叶片中的能量物质,通过木质部向根系转运了更多的C[32],这可能是水分胁迫下紫花苜蓿根系δ13C增加的潜在原因。本研究中充分供水条件下叶片的δ15N较水分胁迫更低,这是因为随着水分的改善,N被移动作为了植物能够吸收到的主要N,所以植物δ15N降低[40]。有关水分胁迫降低了同一外源N添加水平下的根系δ15N,而且随着外源氮水平的增加根系δ15N降低,这可能是水分胁迫降低了土壤氮的有效性,限制了生物固氮功能[41]。但这个结果与另外一些增加外源N的有效性,增强了土壤N的转化速率,导致叶片积累更多的δ15N的结果是相反的[35,42]。然而,植物N同位素的变化受到土壤硝化、植物吸收特性(如时间和吸收类型)和菌根侵染率等的影响[30]。根据紫花苜蓿C、N同位素响应水肥的变化规律应进一步关注共生微生物如根瘤菌和菌根真菌对其的调控。
总之,水分胁迫加剧了供试紫花苜蓿叶片膜脂过氧化,但根系细胞膜对水分胁迫和N添加表现出了较强的稳定性,且外源N并没有缓解水分胁迫下紫花苜蓿膜脂过氧化的程度。紫花苜蓿叶片C、N含量对水分和外源N添加的响应也较为保守,但外源N的添加增加了根系中C、N含量,且增加程度受土壤水分的调节。紫花苜蓿因根系和叶片结构功能和生理特征的差异,根系C/N较叶片更高,根系δ13C明显高于叶片,根系各参数较叶片对水分和外源N添加更为敏感。
