饲料中添加喹乙醇和肉碱对鹦鹉鱼的生长和抗氧化指标的影响
2022-02-15赵建忠李长娥孙学亮陈成勋
赵建忠 李长娥 孙学亮 陈成勋
摘 要:為了探究饲料中添加喹乙醇和肉碱对鹦鹉鱼的生长和抗氧化指标的影响,本研究分别在基础饲料中添加0.5%肉碱和0.5%喹乙醇,以基础饲料为对照,鹦鹉鱼养殖30 d后,测定各组增重率、饵料系数、成活率、肝脏超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛含量(MDA)。结果表明:与对照相比较,饲料中添加0.5%肉碱显著降低了鹦鹉鱼的增重率(P<0.05),显著提高了成活率和饲料系数及CAT和SOD活性(P<0.05),但MDA含量无显著变化;饲料中添加0.5%喹乙醇显著提高了鹦鹉鱼的增重率和CAT、SOD活性及MDA含量(P<0.05),显著降低了饲料系数 (P<0.05)。综上,饲料中添加0.5%肉碱有助于提高机体的成活率、饲料系数和抗氧化能力,添加0.5%喹乙醇有助于提高增重率和抗氧化能力。
关键词:肉碱;喹乙醇;鹦鹉鱼;生长;抗氧化
中图分类号:S966.9 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2022.01.006
Effects of Olaquindox and Carnitine on the Growth and Antioxidant Indexes of Parrot Fish
ZHAO Jianzhong1, LI Change2, SUN Xueliang3,4, CHEN Chengxun3,4
(1.Tianjin Wuqing Animal Husbandry and Aquaculture Development Service Center, Tianjin 301700, China;2.Agricultural Development Service Center of Wuqing District, Tianjin 301700, China;3.College of Fisheries, Tianjin Agricultural College, Tianjin 300384, China;4.Tianjin Key Laboratory of Aquatic State and Aquaculture, Tianjin Agricultural College, Tianjin 300000, China)
Abstract:In order to explore the effects of adding olaquindox and carnitine in feed on the growth and antioxidant indexes of parrot fish, the experiment set two treatments including the basic feed with 0.5% carnitine and 0.5% olaquindox, and the basic feed was used as the control. After the parrot fish were cultured for 30 days, the weight gain rate, feed coefficient, survival rate, liver superoxide dismutase (SOD), catalase (CAT) and malondialdehyde (MDA) content of each group were determined. The results showed that compared with the control, the treatment of 0.5% carnitine is significantly reduced the weight gain rate of parrot fish (P<0.05) but significantly increased the survival rate, feed coefficient, and the activities of CAT and SOD (P<0.05), there was no significant change in MDA content; the treatment of 0.5% olaquindox significantly increased the weight gain rate of parrot fish, CAT, SOD activity and MDA content (P<0.05) but significantly reduced the feed coefficient (P<0.05). Comprehensively, adding 0.5% carnitine to the feed could increase the survival rate, feed coefficient and antioxidant capacity of parrot fish, and adding 0.5% olaquindox could increase its weight gain rate and antioxidant capacity.
Key words: carnitine; olaquindox; parrot fish; growth; antioxidant
收稿日期:2021-09-09
基金项目:天津市淡水养殖产业技术体系创新团队建设项目(ITTFRS2021000)
作者简介:赵建忠(1971—),天津人,工程师,主要从事水产养殖方面研究。
通讯作者简介:陈成勋(1967—),天津人,研究员,主要从事水产养殖方面研究。
肉碱(Carnitine,CN)别名肉毒碱,具有两种异构体,其中L-肉碱具有生物活性的[1]。1958年Fritz发现了肉碱在哺乳动物脂肪酸代谢中具有主导作用[2]。有研究发现L-肉碱普遍存在于动物组织中,可以作为营养添加剂在水产养殖上广泛的应用,饲料中添加150~200 mg·kg-1的肉碱可以促进鲤(Cyprinus carpio)、真鲷(Pagrus major)、草鱼(Ctenoph aryngodon idella)等鱼类生长,提高饲料转化率,并且有效降低肝胰脏和肌肉中的脂肪含量[3],起到改善肉质等的作用[4]。研究表明饲料中添加 L-肉碱,可以通过增加摄食量来提高水产动物的生长性能,并且大多数鱼类饲料中L-肉碱的适宜添加量在100~300 mg·kg-1范围内,少数在400 mg·kg-1以上[5]。在L-肉碱对幼鱼和成鱼生长性能的影响研究发现,因为幼鱼正处于快速生长阶段,其对能量的需求更多一些,而当饲料中添加L-肉碱会通过加快脂肪酸的氧化来提供能量,所以幼鱼比成鱼受到 L-肉碱影响较大[6]。在L-肉碱对水产动物的有效保护效果研究中发现,L-肉碱对鱼类的抗氧化功能具有促进作用[7]。于宏等[8]的研究表明在饲料中肉碱的添加量为0.5%时,养殖30 d后,地图鱼的成活率有显著提高、CAT、SOD活性有显著性提高和MDA含量变化不明显。有研究发现10%脂肪水平的饲料中添加1 g·kg-1肉碱可以显著提高血浆的SOD、CAT和GSH-Px的活力(P<0.05),并且同时显著降低了血浆MDA含量(P<0.05)[9]。
喹乙醇(Olaquindox)是一种氧化喹恶啉类药物,其经过化学合成可以作为抗菌促生长药剂使用,因其具有蛋白同化作用,能提高饲料转化率,促进鱼类生长和催肥,现在国内和国外广泛用作水產动物养殖的饲料添加剂[10]。此外,除了用于促生长外,该药具有广谱抗菌作用,可治疗淡水养殖鱼类细菌性肠炎、细菌出血性败血症、疖疮病等疾病。在20世纪 80 年代以后的水产养殖中得到广泛运用。有研究表明,以剂量为 30~300 mg·kg-1饲料能显著提高水产动物的生长率和成活率[11];在建鲤的饲料中添加 50~200 mg·kg-1的喹乙醇时,有显著或极显著的促生长作用[12]。
鹦鹉鱼(Parrot fish)是由红魔鬼(Amphilophus labiatus)的雄鱼和紫红火口(Cichlasoma synspilum Hubbs)的雌鱼杂交所得新品种,属于淡水热带观赏鱼类,由于其颜色艳丽,体型优美,广受人们喜爱[13]。鹦鹉鱼作为主要的观赏鱼品种,其生长速度与健康状态直接影响其销售量与利润。肉碱和喹乙醇在水产养殖中已经广泛应用,并都取得良好效果,但对于鹦鹉鱼的影响研究较少。通过在饲料中分别添加肉碱和喹乙醇,并分别测定其生长指标和抗氧化酶指标,摸索这两种药物对鹦鹉鱼的生长速度和健康状况的影响,为生产更加高效的鹦鹉鱼饲料提供参考。
1 材料和方法
1.1 试验材料
试验养殖所需的鹦鹉鱼,体长为(6.65±0.40)cm,体重为(29.12±0.94) g,全部由天津市金海马水产养殖有限公司养殖,正式试验开始前将鹦鹉鱼在养殖池中暂养1周,挑选270尾体表无外伤,体型正常且体长体重基本一致的鹦鹉鱼作为正式试验用鱼。
1.2 试验方法
1.2.1 试验设计与饲料 试验设置2个处理,分别为0.5%肉碱和0.5%喹乙醇,即分别在基础饲料中添加0.5%肉碱和0.5%喹乙醇,以基础饲料为对照。每个处理设计有3个重复,一共9组,每组养殖的鹦鹉鱼为30尾,共养殖鹦鹉鱼为270尾。将提前处理好的饲料,放在通风避光处晾干,装袋后阴凉处常温保存。
1.2.2 试验期间饲养管理 试验开始时,按照体重的3%左右做为鹦鹉鱼的日投喂量(以饲料吃完为准),每日定时投喂3次,时间分别为每天的9:00、13:00和17:00。试验期间要保持试验池24 h增氧,换水周期为3 d 1次,每次的换水量应不超过水池总水量的1/3为宜,试验期间养殖池的水温保持在25~28 ℃之间,水体溶解氧应保持在6.5~8.2 mg·kg-1之间,水体的pH维持在8.0~8.3之间,试验的养殖周期为30 d。
1.3 试验指标测定
1.3.1 鹦鹉鱼的生长相关指标 试验分别测定9组鹦鹉鱼的初始和养殖结束后的体重、体长和试验期间的饵料量,并按照公式计算以生长相关指标。
增重率(%) = [(平均末重-平均初重]/平均初重)]×100
饵料系数 = 饲料消耗量/[(平均末重-平均初重) /鱼尾数]
成活率(%) = (成活尾数/总尾数)× 100
1.3.2 鹦鹉鱼的肝脏生化相关指标测定 试验周期结束后,每组中分别收集5条鹦鹉鱼的肝脏,放在冻存管内,在-80 ℃保存。用生理盐水按照1:9的比例制备各组织匀浆液。并按照各指标测定试剂盒说明书的操作步骤依次进行测定。
蛋白含量计算公式:
蛋白含量(g·L-1)= [(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)]×标准管浓度
超氧化物歧化酶活力计算公式:
SOD活力(U·mgprot-1)= [(对照管OD值-测定管OD值)/对照管OD值]÷50%×(反应液总体积/取样量)÷组织中蛋白含量
过氧化氢酶活力计算公式:
CAT活力(U·mgprot-1)= (对照管OD值-測定管OD值)×271×[1÷(60×取样量)]÷组织中蛋白含量
丙二醛含量计算公式如下:
MDA含量(mmol·mgprot-1)= [(测定管OD值-测定空白管OD值)/(标准OD值-标准空白管OD值)]×标准品浓度×蛋白含量
1.4 数据处理与分析
本试验所有数据均用SPSS 13.0 和Excel 2003进行处理分析,以P<0.05为显著水平。
2 结果与分析
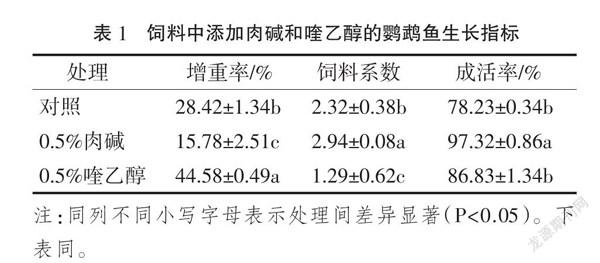
2.1 肉碱和喹乙醇对鹦鹉鱼生长指标的影响
在饲养30 d后,各试验组鹦鹉鱼的生长指标见表1。由表1可知,添加0.5%肉碱组增重率显著小于对照组(P<0.05);添加0.5%喹乙醇的增重率显著高于对照组和添加0.5%的肉碱组(P<0.05);添加0.5%肉碱组的饲料系数显著高于对照组和添加0.5%喹乙醇组(P<0.05),添加0.5%喹乙醇组的饲料系数显著低于对照组(P<0.05);添加0.5%肉碱组的成活率显著高于对照组和添加0.5%喹乙酸组(P<0.05),添加0.5%喹乙醇组的成活率与对照组差异不显著(P>0.05)。
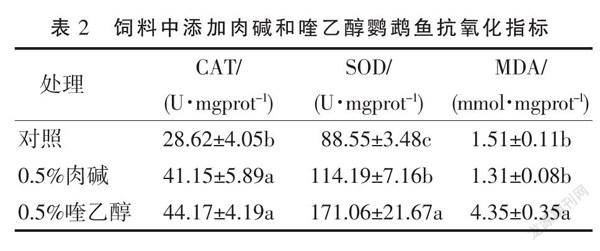
2.2 肉碱和喹乙醇对鹦鹉鱼抗氧化指标的影响
在饲养30 d后,各试验组鹦鹉鱼的抗氧化指标见表2。由表 2 可知,添加0.5%肉碱组和0.5%喹乙醇组CAT活力都显著高于对照组(P<0.05),添加0.5%肉碱组与0.5%喹乙醇组的CAT活力差异不显著(P>0.05);添加0.5%喹乙醇组的SOD活力显著高于添加0.5%肉碱组和对照组(P<0.05),添加0.5%肉碱组SOD活力显著高于对照组(P<0.05);添加0.5%喹乙醇组的MDA含量显著高于添加0.5%肉碱组和对照组(P<0.05),添加0.5%肉碱组和对照组的MDA含量差异不显著(P>0.05)。
3 结论与讨论
肉碱作为饲料添加剂,即可以减少饲料中蛋氨酸添加量的作用,还对机体的脂质代谢有重要作用,其是脂肪酸进行β-氧化的载体,可以提高脂肪的氧化供能。有研究发现L-肉碱添加到饲料中可以提高鲈和鲤等鱼体的增重率[14-15]。在饲料中添加肉碱对鲫鱼的影响研究中发现,其可以改善鲫鱼(Carassius auratus)对饲料的利用效率[16]。但在饲料中添加肉碱对罗非鱼、军曹幼鱼、鲤和大西洋鲑(Salm osalar)等的影响研究中发现其对于生长指标影响并不明显[17-20]。另外还有研究发现,在罗非鱼饲料中添加150 mg·kg-1的肉碱可以提高饲料效率并且对鱼体生长有明显促进作用,但当添加浓度为300 mg·kg-1时其对饲料效率和生长的影响就不明显[21];在露斯塔野鲮(Labeorohita)的饲料中添加肉碱对其生长和饲料效率的研究[22]中也得到相近的结果;在对鲫鱼的研究中发现,饲料中L-肉碱的添加量为50 mg·kg-1时能够改善生长性能,当肉碱的浓度为200 mg·kg-1时,其相对生长率和饲料效率都降低[16]。这些研究结果表明,不同的肉碱添加量试验结果不一致,肉碱对于机体的影响是个复杂的过程,其作为饲料添加剂应该合理使用,设计合理的添加量,否则不利于机体的生长。本试验在基础饲料中添加浓度为0.5%肉碱,即5 000 mg·kg-1,属于高浓度范围,降低了鱼体的增重率与饵料系数,对鹦鹉鱼的生长不利;但鹦鹉鱼成活率显著高于对照组(P<0.05),可能因为肉可碱能提高鹦鹉鱼的代谢强度[23],使鱼类的成活率提高。
喹乙醇作为饲料添加剂在水产养殖中广泛应用,喹乙醇能通过机体的内分泌系统,影响机体代谢机能,促进蛋白质合成从而促进了鱼类的生长[24]。有研究发现其对建鲤、草鱼等鱼类的生长均有明显的影响[25-26]。本试验中,发现添加0.5%喹乙醇组增重率显著高于对照组(P<0.05),可以说明喹乙醇对于机体生长有促进作用。
过氧化氢酶(catalase,简称CAT)是动植物以及好氧微生物中的氧还原酶,在H2O2分解为H2O和O2 - 的催化反应过程中有重要作用,在铁螯合物作用下其可以使H2O2不与O2反应生成-OH,从而可以减少过氧化脂质和自由基的形成,也能够对机体起到重要的保护作用[27-30]。因此,CAT可以作为重要的抗氧化因子对于水产动物,成为机体内天然的清除剂,可以有效清除机体内的自由基以及活性氧[31]。超氧化物歧化酶(SOD)可将有害的超氧阴离子自由基转化为过氧化氢,机体内的过氧化物酶可以进一步催化H2O2等生成H2O和O2,从而避免细胞受到自由基的毒害[32]。CAT和SOD的活性变化是机体在胁迫逆境下的免疫力的反应[33]。丙二醛(MDA)作为由自由基产生的脂质过氧化的代谢产物,当机体通过产生自由基时,可以发生脂质过氧化的作用。本试验中,饲料中添加量为0.5%肉碱组的CAT和SOD活力均显著高于对照组,添加量为0.5%肉碱组的MDA含量低于对照组,说明饲料中添加肉碱可以提高鱼机体的抗氧化能力,减少自由基对鹦鹉鱼机体的细胞损伤。
动物和植物组织细胞的功能受到毒性物质的影响发生改变,并且机体细胞内的自由基代谢也受到毒性物质的影响导致代谢失衡,进而由此引发的一些连锁反应的结果与毒性物质有着密不可分的关系[34]。机体细胞内的抗氧化系统是所有需氧生物机体内清除活性氧自由基、阻止过氧化损伤的重要机体保护机制,可以清除机体组织细胞代谢产生的活性氧自由基,保持活性氧自由基的含量,对机体正常的生理功能起到保护作用[35]。有研究研究发现,某些药物在用于治疗疾病时,可能会对机体产生毒性物质。机体内产生毒性的同时会导致机体内氧化应激反应以及过氧化作用[36]。这类药物导致机体组织损伤的一种分子机制是抗氧化酶基因表达的改变[37]。喹乙醇和这些药物相似,在适宜的剂量下对动物机体起到提高免疫力和促进生长的作用,但对机体使用较高浓度或时间过长时就会产生一定毒性作用。有研究表明,动物机体对喹乙醇中毒时,组织内会发生一定程度的病变[38]。本试验中,饲料中添加0.5%喹乙醇,鹦鹉鱼CAT和SOD活性均显著高于对照组,但同时其MDA含量也显著高于对照组,说明机体细胞可能受到了毒性作用,而高的CAT和SOD值是机体对喹乙醇的应激反应,即0.5%喹乙醇添加量对鹦鹉鱼机体可能产生了毒性作用。
综上所述,与对照相比较,饲料中添加0.5%肉碱,鹦鹉鱼成活率和饲料系数显著提高,鹦鹉鱼肝脏CAT和SOD的活性显著提高且MDA含量低于对照组,说明饲料中添加0.5%肉碱可以提高机体抗氧化能力;饲料中添加0.5%喹乙醇,鹦鹉鱼肝脏CAT和SOD活性均显著增强。
参考文献:
[1] 王优军, 李勇, 蒋克勇. L-肉碱在水产养殖中的应用[J]. 中国饲料, 2005(16): 20-21, 24.
[2] 朱友谊. 肉碱的作用机理及使用效果[J]. 科学养鱼, 1998(8): 36-37.
[3] 田娟, 冷向军, 李小勤, 等. 肉碱对草鱼生长性能、体成分和脂肪代谢酶活性的影响[J]. 水产学报, 2009, 33(2): 295-302.
[4] 刘万涵, 朱友谊. 肉碱在水产动物营养上的研究进展[J]. 浙江海洋学院学报(自然科学版), 2001, 20(z1): 39-45.
[5] WANG Q J, LUO S, GHONIMY A,et al. Effect of dietary l-carnitine on growth performance and antioxidant response in Amur minnow(Phoxinus lagowskii Dybowskii)[J]. Aquaculture Nutrition, 2019, 25(4): 749-760.
[6] 武帆, 楊振才. L-肉碱在水产养殖中的研究进展[J]. 河北渔业, 2021(7): 29-32, 36.
[7] 于婷, 王秋举, 陈秀梅, 等. L-肉碱的代谢及其在鱼类养殖应用中的研究进展[J]. 中国畜牧杂志, 2019, 55(4): 34-39.
[8] 于宏, 孙学亮. 肉碱对地图鱼生长和抗氧化指标的影响[J]. 农村科学实验, 2019(12): 81, 83.
[9] 徐端红, 安芳芳, 贾新彦, 等. 日粮肉碱和脂肪水平对鲤鱼生长性能、血液 生化指标和抗氧化性能的影响[J]. 中国饲料, 2019(10): 77-81.
[10] 杨先乐, 胡鲲, 邱军强, 等. 喹乙醇在鱼体内蓄积及其对鱼类的影响[J]. 水生生物学报, 2005, 29(1): 13-19.
[11] 杨波, 陈吉红. 喹乙醇在水产动物中的应用及其安全性评价[J]. 兽药与饲料添加剂, 2006, 11(2): 13-15.
[12] 邱楚武. 喹乙醇在水产饲料中的作用及应用[J]. 兽药与饲料添加剂, 2002, 7(2): 31-32.
[13] 王甘翔, 潘亚均, 宋之琦, 等. 血鹦鹉人工养殖技术[J]. 水产科技情报, 2009, 36(3): 143-145.
[14] TWIBLI R G, BROW P B. Effect of dietary carnitine on growth rates and body composition of hybrid striped bass (Morone saxatilis male× M. chrysops female)[J]. Aquaculture, 2000, 187(1/2): 153-161.
[15] 张东鸣, 黄权, 周景祥, 等. 不同饲料蛋白质水平条件下L-肉碱对鲤鱼生长和肌肉营养成分的影响[J]. 吉林农业大学学报, 2002, 24(1): 82-87.
[16] 王立新, 周继术, 杨元昊, 等. L-肉碱对鲫鱼生长和代谢的影响[J]. 西北农林科技大学学报(自然科学版), 2004, 32(10): 63-65, 70.
[17] 杜震宇, 刘永坚, 田丽霞, 等. 添加不同构型肉碱对于罗非鱼生长和鱼体营养成分组成的影响[J]. 水产学报, 2002, 26(3): 259-264.
[18] 王骥腾, 韩涛, 田丽霞, 等. 2个脂肪水平下添加肉碱对军曹鱼生长及体组成的影响[J]. 浙江海洋学院学报(自然科学版), 2007, 26(2): 125-131.
[19] 蔡雪峰, 罗琳, 薛敏, 等. 添加不同的促生长剂对鲤鱼生长和鱼体成分的影响[J]. 中国畜牧兽医, 2003, 30(6): 27-29.
[20] JI H, BRADLEY T M, TREMBLAY G C. Atlantic salm on (Salm o salar)fed L-carnitine exhibit altered intermediary metabolism and reduced tissue lipid, but not change in growth rate[J]. Journal of Nutrition, 1996, 126(8): 1937-1950.
[21] BECKER K, SCHREIBER S, ANGONI C. Growth performance and feed utilization response of Oreochromis niloticus×Oreochromis aureus hybrids to l-carnitine measured over a full fattening cycle under commercial conditions[J]. Aquaculture, 1999, 174: 313-322.
[22] KESHAVANATH P, RENUKA P. Effect of dietary L-carnitine supplements on growth and body composition of fingerling rohu, Labeo rohita (Hamilton)[J]. Aquaculture Nutrition, 1998, 4(2): 83-87.
[23] 林仕梅, 罗莉, 叶元土, 等. 肉碱对草鱼代谢强度的影响[J]. 西南农业大学学报, 2001, 23(4): 343-346.
[24] 叶金云, 陈月英, 沈智华. 喹乙醇(HMQ)添加量对一龄草鱼生长和成活率的影响[J]. 浙江水产学院学报, 1992, 11(1): 25-31.
[25] 文良印, 李义, 杨加琼, 等. 饲料中添加喹乙醇对建鲤生长的影响[J]. 淡水渔业, 1995, 25(1): 18-20.
[26] 徐树宽. 喹乙醇[J]. 浙江畜牧兽医, 1991, 16(4): 27-29.
[27] AEBI H. Catalase in vitro[J]. Methods in engymology, 1984, 105: 121-126.
[28] 周一, 严自正, 张树政. 嗜热链霉菌过氧化氢酶的纯化及性质研究[J]. 微生物学报, 1990, 30(5): 336-343.
[29] 刘昌玲, 王国庆. 细菌过氧化氢酶的分离、结晶及性质[J]. 生物化学与生物物理进展, 1990, 17(5): 380-383.
[30] 张尔贤, 吴丹奇, 俞丽君, 等. 猪血过氧化氢酶的纯化及其某些性质研究[J]. 药物生物技术, 1994, 1(2): 5-8.
[31] WINSTON G W. Oxidants and antioxidants in aquatic animals[J]. Comparative Biochemistry and Physiology. C, Comparative Pharmacology and Toxicology, 1991, 100(1/2): 173-176.
[32] DIGUISEPPI J, FRIDOVICH I. The toxicology of molecular Oxygen[J]. Critical Reviews in Toxicology, 1984, 12(4): 315-342.
[33] 饶玉才, 胡宝庆, 文春根. 嗜水气单胞菌感染对背角无齿蚌5种免疫相关酶活力的影响[J]. 水生生物学报, 2009, 33(3): 406-412.
[34] LIVINGSTONE D R, GARCIA MARTINEZ P, MICHEL X, et al. Oxyradical production as a pollution-medicated mechanism of toxicity in the common mussel, Mytilus edulis L., and other mollusks[J]. Functional Ecology, 1990, 4(3): 415-424.
[35] WINSTON G W. DI GIULIO R T. Prooxidant and antioxidant mechanism in aquatic organism[J]. Aquatic Toxicology, 1991, 19(2): 137-161.
[36] DURAK I, KARAAYVAZ M, CIMEN M Y, et al. Aspirin impairs antioxidant system and causes peroxidation in human erythrocytes and Guinea pig myocardial tissue[J]. Human & Experimental Toxicology, 2001, 20(1): 34-37.
[37] 李詠梅, 宋伯根, 赵桂芬, 等. 盐酸阿霉素对大鼠心肌损伤的分子机制研究[J]. 中国临床药理学与治疗学, 2002, 7(3): 209-212.
[38] WALDMANN K H, KIKOVIC D, STOCKHOFE N. [Clinical and hematological changes after olaquindox poisoning in fattening pigs][J]. Zentralblatt Fur Veterinarmedizin. Reihe a, 1989, 36(9): 676-686.
