白首乌的化学成分、药理作用及栽培技术综述
2022-02-15张明沈明晨陈镭李春阳吴承东
张明 沈明晨 陈镭 李春阳 吴承东




摘要:耳叶牛皮消是白首乌的常用药材来源,其95%产自江苏省滨海县。目前已从耳叶牛皮消中分离出74种化合物,主要为C21-甾苷类、苯乙酮类、萜类和生物碱类,研究表明这些化学成分具有显著的药理活性,包括抗肿瘤、免疫调节、保护肝脏、抗抑郁以及舒张血管等。近年来,白首乌在药用价值以及临床应用方面取得了较大研究进展,但对白首乌生物活性潜在分子作用机制以及高效栽培模式的研究仍存在一些空白。本文总结耳叶牛皮消的化学成分、药理作用、栽培技术等方面的应用和进展,阐明现阶段白首乌综合开发利用面临的主要挑战,以期对白首乌产业的可持续发展提供理论依据。
关键词:白首乌;耳叶牛皮消;化学成分;药理作用;栽培技术
中图分类号: S567.23+9.01 文献标志码: A
文章编号:1002-1302(2022)02-0022-08
收稿日期:2021-05-13
基金项目:江苏现代农业产业关键技术创新项目[编号:CX(20)2006];江苏现代农业(特粮特经)产業技术体系项目(编号:JATS【2020】219)。
作者简介:张 明(1977—),男,江苏盐城人,助理研究员,主要从事特粮特经作物栽培研究。E-mail:511899401@qq.com。
通信作者:吴承东,助理研究员,主要从事特粮特经作物栽培研究。E-mail:1484904139@qq.com。
白首乌是萝藦科鹅绒藤属植物,具有补肾益肝、强筋壮骨、调节胃痛、乌须生发等功效,被奉为延年防老的珍品。目前世界上有200多种白首乌品种,根据其植物来源分为3种类型:隔山牛皮消(Cynanchum bungei Decne.,CB)、耳叶牛皮消(Cynanchum auriculatum Royle ex Wight.,CA)、戟叶牛皮消[Cynanchum wilfordii (Maxim.) Hemsl.,CW]。
白首乌中含有多种活性物质,其中C21甾苷类、苯乙酮类、萜类等为其主要的活性成分,与白首乌的药理作用密切相关。张宁等通过ITS序列分析发现,隔山牛皮消、耳叶牛皮消、戟叶牛皮消样品的序列间存在多个变异位点,且序列组成、碱基含量以及遗传距离等方面均不同,证明了这3种白首乌间的差异性[1]。本文主要围绕耳叶牛皮消的化学成分、药理作用以及栽培技术方面的研究展开综述,以期为白首乌生产以及药用价值等综合开发利用提供理论依据。
1 滨海白首乌产业概述
江苏省滨海县种植耳叶牛皮消已有一百多年的历史,当地耳叶牛皮消的产量占全国总产量的95%以上,被誉为我国的“首乌之乡”。但由于首乌传统产品加工技术含量较低,研究开发的深度不够,导致滨海白首乌的资源利用仍存在很大不足。目前主要是把白首乌去除根皮后加工成首乌粉,将其作为保健产品在市场上进行销售,根皮则被作为废弃物处理。然而,Wang等曾研究报道白首乌根皮中含有较高的C21甾苷化合物,去根皮加工的传统方法使得白首乌活性成分损失较多,直接造成首乌药材资源的浪费[2]。因此,在提高白首乌的种植效益的同时,更应该提高首乌资源的利用效率,从而加快发展滨海白首乌的标准化生产以及营养品、保健品等方面的综合开发利用。
2 白首乌化学成分
2.1 C21 甾苷类
C21甾苷类是白首乌的主要活性成分,广泛分布于鹅绒藤属植物中。从耳叶牛皮消中分离出的C21甾苷化合物已有40多种(表1),相对于戟叶牛皮消、隔山牛皮消的C21甾苷含量均较高[3]。以往的生物学研究表明,C21甾苷化合物在抗肿瘤[4-6]、免疫调节[7]、抗抑郁[8]、抗真菌[9]、抗癫痫[10]、神经保护[11]、血管舒张[12]以及减肥[13]等多方面发挥着重要作用。Qin等通过光谱分析证明,黄芪甲苷C能显著抑制B、T淋巴细胞的增殖[7]。Huang等采用菌丝生长速率法,鉴定了11种C21甾苷化合物的抑菌活性,发现告达庭和青阳参苷元有较强的抗真菌活性[14]。Zhu等通过体外试验研究C21甾苷化合物对人脑胶质瘤U251、U87细胞生长的作用机制发现,告达庭和告达庭-2,6-双脱氧-3-O-甲基-β-D-磁麻糖能显著抑制U251、U87细胞的生长,并与试验处理时间以及C21甾苷化合物的剂量呈正相关。目前,国内外对C21甾体化合物的研究主要围绕告达庭苷元,而筛选C21甾苷类活性苷元方面的研究还较少,因此还需要进一步系统研究C21甾苷化合物的活性成分及其作用。
2.2 苯乙酮类
苯乙酮类化合物是白首乌中具有代表性的生物活性成分之一,具有显著的抗炎、舒张血管、保肝、降血糖、保护神经的作用。1992年,首次报道从戟叶牛皮消中分离出2,4-二羟基苯乙酮和4-羟基苯乙酮,之后研究者们从戟叶牛皮消、隔山牛皮消以及耳叶牛皮消中先后提取出24种苯乙酮类化合物,其中从耳叶牛皮消中提取出的苯乙酮类化合物有8种[29](表2)。近年来,国内外对苯乙酮类化合物的研究取得了较大进展。Zhang等首次采用高效液相色谱-电喷雾串联质谱联用技术对混合物中的cynandione A及其衍生物进行了简单有效的筛选鉴定,他们通过评估分解曲线,迅速区分位置异构体以及手性异构体,并发现苯乙酮的裂解反应主要有水的消除反应、甲基自由基的消除反应以及CO与二聚体的解离[30]。cynandione A是苯乙酮的生物活性代表,是一种具有联苯结构的特征双苯乙酮衍生物,另外有研究报道cynandione B可能是cynandione A的人工产物[31]。2011年,Sun等研究发现高速逆流(HSCCC)不仅能够有效分离纯化苯乙酮类化合物,同时也能从植物(如白首乌)中分离纯化低浓度、高极性的相似结构成分[32]。Sun等进一步探索提取苯乙酮的方法,2013年他们报道离子液体超声辅助萃取(ILUAE)可显著提高苯乙酮的回收率,且该萃取方法环保又高效[33]。目前对白首乌苯乙酮类化合物的研究仍处在提取纯化阶段,需要研究者们对其活性作用进行更深入的研究。
2.3 萜类
萜类化合物主要来源于甲戊酸衍生物,是植物中重要的次生代谢产物。根据5个碳的单元数结构可将萜类化合物分为单萜类、倍半萜类、二萜类、二倍半萜类。目前,从CA、CB、CW中已提取出一些具有生物活性的萜类化合物,其中CA居多(表3)。但CA中萜类化合物的活性还需进一步研究验证。
2.4 生物碱类
生物碱化合物是一类具有显著生物活性且含有丰富生物碱的含氮有机化合物。目前,研究者通常用水浴法从白首乌中分离提取出生物碱。Zhang等在耳叶牛皮消化学成分的试验中发现5种生物碱,即3-羟基吡啶、3-羟基-2-甲基吡啶、吡啶甲醇、5-羟基-(6CI,9CI)以及1H-咪唑-5-羟酸[16](表4)。但是迄今为止,关于生物碱类活性成分的研究仍未见报道。
2.5 其他化合物
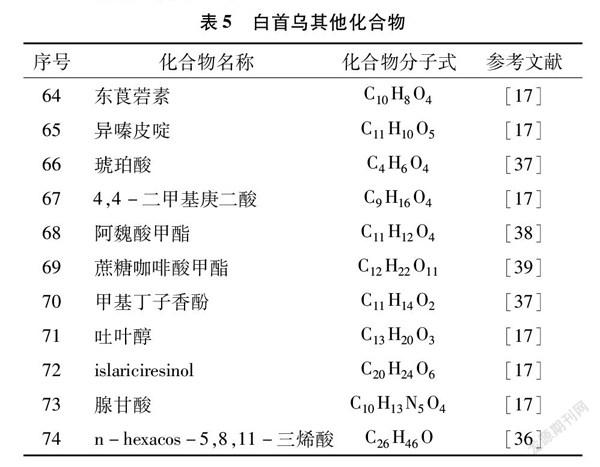
此外,从耳叶牛皮消中还提取出其他的化合物,包括東莨菪素、异嗪皮啶、琥珀酸、4,4-二甲基庚二酸、阿魏酸甲酯、蔗糖咖啡酸甲酯、甲基丁子香酚、吐叶醇、islariciresinol、腺甘酸、n-hexacos-5,8,11-三烯酸(表5)。
3 白首乌药理作用
药理学研究表明,耳叶牛皮消、隔山牛皮消、戟叶牛皮消都有抗肿瘤、抗真菌活性的作用。但由于3种白首乌的C21甾体、苯乙酮等生物活性成分不同,导致这3种植物的生物学功能不同。目前对白首乌在抗肿瘤以及抗炎方面的研究较多,而在补肾、健骨筋骨、保护心血管系统、增强免疫功能等传统药用价值方面尚未深入研究。今后的药理学研究应重点挖掘其传统药用价值。
3.1 抗肿瘤
白首乌具有多种药理作用,近年来因其潜在的抗肿瘤活性受到了广泛关注。大量的体内、体外试验表明,从白首乌中分离得到的粗提物以及C21甾体等对肿瘤细胞具有拮抗作用,并表现较强的抗肿瘤活性。
Hu等研究发现CA的粉末悬浮液(0.25~4.00 mg/mL)通过诱导G1期细胞生长中止,可以抑制S-180以及富集癌(EAC)细胞的生长,且抑制效果与CA的剂量呈正相关;他们进一步试验发现,连续12 d给C57BL/6小鼠皮下接种CA(225 mg/kg),Lewis肺癌细胞的生长以及癌细胞转移均显著受到抑制,其抑制率分别为38.68%、63.64%[40]。Shan等通过小鼠体外试验,证明了1 μg/mL CA的乙醇提取物对K562细胞有显著的抑制作用,抑制率为24.06%[35]。另外,他们发现CA的乙醇提取物、正丁醇馏分(100 mg/kg)也能阻碍小鼠体内S-180肉瘤的生长,其抑制率分别为42.22%、41.50%。Wang等研究CA根皮和块茎不同部位的抗肿瘤活性,证实CA块茎中的氯仿、乙酸乙酯馏分对HepG2、SMMC-7721癌细胞的生长有较强的抑制作用[2]。
C21甾体是白首乌中主要的抗肿瘤活性化合物。CA中的耳叶牛皮消A和耳叶牛皮消B能够抑制肿瘤细胞PC 3、Hce-8693、HeLa、PAA的生长[16]。Li等研究发现,当IC50值为8.6~58.5 μmol/L时,CA中的开德苷元3-O-β-洋地黄毒糖苷、开德苷元 3-O-α-迪吉糖-(1→4)β-磁麻糖、告达庭-3-O-β-磁麻吡喃糖苷对肿瘤细胞SMMC-7721、HeLa具有一定的毒性作用[18]。Peng等通过常规方法和二乙基亚硝胺(DEN)诱导大鼠的肝细胞癌(HCC),再利用超高效液相色谱串联质谱法(UPLC-MS/MS),成功在大鼠的血浆和组织中,测定了告达庭化合物的抗癌活性。另外,耳叶牛皮消中的告达庭-2,6-双脱氧-3-O-甲基-β-D-磁麻糖能显著抑制肿瘤细胞SMMC-7721、H22的生长[6,20]。Huang等通过大量试验证明,相对于对照阿霉素(IC50分别为0.32、0.18 μmol/L),青阳参苷元对K-562有较强的抑制作用(IC50值为 6.72 μmol/L);罗素他命对HL-60有较强的细胞毒性作用(IC50值为2.49 μmol/L)[41]。由此可见,CA在抗血管生成以及抗癌细胞入侵方面有着较大应用前景,有望成为新型的抗肿瘤治疗药物[38]。
综上所述,白首乌的粗提物和纯化合物,如HepG2、S-180、EAC、SMMC-7721、HUVECs、HT1080、pc3、Hce-8693、HeLa、PAA、U251、U87、SGC-7901、HL-60、KB-V1、MCF7/ADR细胞等,对多种肿瘤细胞有显著的抑制作用。另外,开徳苷元、告达庭、青阳参苷元 、罗素他命等C21甾体化合物可以通过诱导肿瘤细胞的凋亡或阻碍细胞的增殖,从而抑制肿瘤细胞的生长。然而,其抗癌机制仍需要于进一步的临床试验来明确。
3.2 免疫调节
中国医学认为,白首乌主治久病虚弱,可增强人体抗病能力,曾有相关研究报道CA具有较强的免疫活性。Gao等试验证明,CA的多糖溶液(2、4、6 mg/mL)能够显著促进体外T淋巴细胞增殖。另外,他们连续7 d给小鼠喂CA多糖溶液[50、100、150 mg/(kg·d)],发现CA多糖溶液能够提高小鼠免疫功能,从而抑制小鼠的脾脏指数以及胸腺指数,不仅促进了小鼠细胞的吞噬作用,还增强了小鼠迟发性过敏反应以及碳颗粒的清除能力。这些结果证实,多糖具有调节人体免疫平衡的作用,并提高小鼠的非特异性和特异性细胞免疫功能[22]。然而,CA多糖溶液影响免疫功能的分子机制尚不清楚,须做进一步试验研究。
3.3 保护肝脏
Lv等利用氢化可的松作为对照,发现CA的总C21甾体苷(4、8、16 mg/kg)能显著降低大鼠由于CCl4损伤导致的肝脾/纤维化指数、血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性、血清透明质酸(HA)和Ⅲ型前胶原(PCⅢ)含量以及肝组织中的丙二醛(MDA)和羟脯氨酸(Hyp)水平,并能提高肝组织中的超氧化物歧化酶(SOD)活性,从而减轻了CCl4诱导的急性肝损伤[42]。白首乌是传统的养肝补品,希望未来的研究能够阐明白首乌这些生物成分护肝功能的活性机制。
3.4 降糖降脂
CW中的cynandione A、cynwilforone A具有显著的降血糖作用,主要通过下调磷酸烯醇式丙酮酸羧酸激酶(PEPCK)和葡萄糖-6-磷酸酶(G6P)的表达从而抑制肝脏糖异生,该研究是苯乙酮具有降糖作用的首次报道[43]。Liu等试验发现CA中的wilfoside K1N(50 mg/kg)可以明显抑制小鼠食欲,控制小鼠体重[13]。众所周知,肥胖是糖尿病的重要致病因素之一。CW提取物可以显著降低高血脂小鼠的动脉粥样硬化指数,从而改善高胆固醇血症状况[44]。但目前CA关于降糖降脂的研究较少,且白首乌降糖降脂的具体机制还需要进一步研究。
3.5 抗抑郁
随着现代发展节奏的变快,人们的生活压力变大,近年来抑郁症的发病率暴增且仍呈上升趋势。白首乌苷C、牛皮消新苷C、牛皮消新苷D、牛皮消新苷E、耳叶苷 L在强迫小鼠悬尾试验(TST)、强迫游泳试验(FST),以及矿场试验(OFT)中表现出显著的抗抑郁活性[8]。Ji等报道,给小鼠灌胃CA的乙醇提取物(TGC 80 mg/kg)、CHCl3/甲醇馏分(TGD 80 mg/kg、TGE 80 mg/kg),2次/d,连续给药5 d,发现小鼠悬尾时间分别减少了61.7%、64.5%、61.9%。他们用同样的方法给小鼠分别灌胃TGC(80 mg/kg)、TGC- d (80 mg/kg)、TGC- e(20 mg/kg)并测定小鼠游泳静止时间,发现与对照相比,分别减少32.6%、47.3%、48.7%。进一步试验研究给小鼠灌胃TGC(10 mg/L)、TGC-d(10 mg/L)、TGC-e(10 mg/L),证实小鼠脑突触体中血清素的再摄取受到抑制,其抑制率分别为7.4%、4.5%、71.1%,这些结果表明TGC、TGC-d、TGC-e具有潜在的抗抑郁活性,且可能与阻碍血清素的再摄取相关[45]。然而,因该研究一方面缺乏基于抑郁症病理生理学的血清生化指标分析,另一方面试验中使用的CA含量较高,限制了研究结果在实际临床上的应用。
3.6 扩血管活性
白首烏是一种被广泛应用于养血补血的药用植物,能有效预防动脉粥样硬化性血管疾病。研究表明,CA中的告达庭在抗血管生成作用中发挥着至关重要的作用。Wang等发现告达庭通过干扰血管内皮生长因子(VEGF)-VEGFR2-AKT/黏着斑激酶(FAK)的信号通路,可以阻断人脐静脉内皮细胞(HUVECs)的迁移、侵入以及毛细血管样管的形成,从而抑制HUVEC细胞的增殖[46]。Chol等连续6周给高脂高胆固醇饮食(HFCD)的大鼠喂食CA的乙醇提取物[10 000、200 mg/(kg·d)],证明CA可以改善与胰岛素抗体AKT/iNOS/NO/cGMP信号通路相关的多种血管疾病,如血管内皮功能障碍、肥胖、高血压以及高脂血症[47]。进一步研究发现,CA也能够通过阻碍NO/cGMP信号通路,从而改善饮食或遗传性高脂血症小鼠的血管内皮功能障碍[48]。这些研究结果为白首乌在心血管保护方面的应用提供了良好的依据。但目前告达庭的心血管保护作用以及白首乌舒张血管活性的分子机制有待进一步研究。
4 白首乌高效栽培技术
国内外研究者们已对白首乌的药理活性进行了一系列的研究,而白首乌栽培方面的研究工作仍存在较大不足。江苏沿海地区农业科学研究所新洋试验站多年来致力于白首乌栽培技术的研究,力求寻得首乌种植发展的高效种植模式。
4.1 套种
白首乌春季播种的出苗时期长(40~50 d),利用这一特点,试验站科研人员尝试白首乌套种栽培模式,旨在通过套种技术提高白首乌的复种指数,增加种植效益。目前,已报道了白首乌与大小麦、蚕豆以及油菜的套种栽培模式,这些作物对土壤的适应性都很强,能够在大多数类型的土壤环境中生长[49-51]。白首乌耐旱怕涝,不宜种植在易受水淹的田块。最好选用耕层深厚、土质肥沃、排水通畅的土壤,并保证田间墒沟(30 cm)、田头沟(80~100 cm)以及腰沟(每隔30~50 m开1条,深度 50~60 cm)配套,从而提高白首乌的耐涝能力。
套种栽培模式中,在大小麦、蚕豆以及油菜的种植期间,田地应深翻耕,做到土地平整细碎,施足基肥,适时播种,及时收获,并将脱粒后的秸秆铺在白首乌行间,既可以作为肥料,还可以一定程度上减轻白首乌苗期田间杂草的生长。白首乌种植过程中,若田间杂草较多,播后出苗前可利用50%乙草胺乳液1 200~1 500 mL兑水(750 kg/hm2)均匀喷施于表面;出苗后可在杂草3~5叶期,利用10.8%高效氟吡甲禾灵乳油450 mL兑水(750 kg/hm2)均匀喷施。及时追施苗肥,开塘穴施氮磷钾复合肥(450~600 kg/hm2)和腐熟饼肥(750~1 500 kg/hm2),从而促进白首乌壮苗早发。在白首乌生长前中期,对生长不整齐的田块喷施或开穴追施平衡肥(尿素75~120 kg/hm2);对黄僵苗和受灾苗及时松土透气;对于生长旺盛的田块,喷施多效唑,从而保证白首乌的平衡生长。白首乌生长中后期,用磷酸二氢钾(3 kg)、百施利(1 500 mL)兑水(300 kg/hm2)间隔10 d喷施叶面 2~3次。另外,在白首乌的整个生育期应注意以中华萝藦叶甲和红脊长蝽为主的虫害防治以及褐斑病的防治。
4.2 水旱轮作
水旱轮作系统是我国目前重要的作物种植系统之一,交替变化土壤的水热条件,使得系统内的土壤养分循环以及转换等方面显著不同于纯旱作或湿地系统。由于白首乌在重茬种植过程中易出现块根腐烂、病虫害问题,新洋试验站技术人员开展了白首乌水旱轮作栽培技术的试验研究[52]。通过选用种植年限相同相邻田块,前茬分别种植水稻和大豆,结果表明白首乌水旱轮作技术能够显著降低霜霉病和褐斑病的发病率,提高了白首乌产量以及白首乌黄酮、多酚、甾苷等活性成分含量。此外,该技术提高了肥料的利用效率,对维持土壤生产力,确保作物和环境安全,推动农业的可持续发展具有重要的理论和实践意义。
4.3 立式栽培
白首乌是一种喜温光的经济作物,在首乌栽培过程中应注意温度和光照条件。白首乌立式栽培可以改善首乌叶面的分布位置,从而提高叶面积指数,增强光能的利用率,进而提高首乌的产量。新洋试验站技术人员研究了首乌立式栽培的最佳种植密度,结果表明,栽培过程中将株距以及行距控制在40 cm左右,并将藤蔓攀缘的树枝插在距离首乌块根10 cm左右位置,其单株产量最高[53]。另外,将首乌花果期茎叶长度控制在250 cm以下,可以有效提高白首乌的块根质量。该研究根据首乌生长、考种情况以及块根产量的统计分析结果,证明了白首乌立式栽培明显优于传统栽培模式。
5 总结和展望
白首乌是我国传统中药材之一,历来被中医学用于滋补肝肾、强健筋骨、增强免疫等。目前白首乌的一些疗效已被现代药理学研究证实,比如白首乌的养肝护肝功能。然而白首乌其他生物活性成分的潜在分子机制与传统用途之间的相关性尚不清楚,因此仍需进一步研究白首乌的药理作用,从而证明其传统中药学用途。
白首乌的化学成分决定其药理作用以及对疾病的治疗作用。C21甾苷和苯乙酮化合物是白首乌中主要的活性成分,具有抗肿瘤、抗炎症、降血脂和护肝等作用。近年来,白首乌潜在药用价值以及临床应用方面取得了重大进展,但白首乌的研究仍存在一些空白。
第一,植物中的化合物与其药理作用密切相关。植物体内一般含有数千种化合物,目前从白首乌中仅分离出151种化合物,不能代表白首乌的化学组成。从白首乌中提取出新的化合物,将更有利于新型药物的开发以及临床的运用。
第二,白首乌药理学研究不够深入,大部分报道只与粗提物相关,对潜在分子机制的分析尚不充分。在今后的研究中可以重点探讨C21甾苷化合物和苯乙酮类的作用机制,并通过人工生物合成告达庭、罗素他命以及cynandione A的衍生物,增强其抗肿瘤活性和抗炎作用,开发具有临床潜力的药物。此外,白首乌有多种传统药用价值,但仅有一小部分被研究证实,应进一步研究白首乌传统用途与药理作用之间的关系,从而促进白首乌的临床应用。
第三,白首乌化合物的毒性评价是开展临床试验以及开发新药的必要条件。毒性评价可保证药物疗效和患者临床用药的安全性,该方面的试验应引起重视,但目前相关报道较少,应研究白首乌主要活性成分的分布以及代谢机制,为新型天然抗肿瘤药物的开发利用提供科研基础。
第四,白首乌与其他中药材相似,其化学成分复杂,因此需要建立国际公认统一的质量安全标准。我们可通过现代生物学分析和特异性分析,确定白首乌化学成分的来源及特异性,并根据研究结果确定其质量参考标准。此外,应进一步开发白首乌的非药用部分,如白首乌的花、茎、叶等。
第五,滨海白首乌产业发展状况与消费者对市场需求不匹配,当前种植优质品种较少,高产优质种植方式不多,白首乌制品品种传统、单一。随着生活水平的提高、现代医疗模式的变化以及天然药物市场的扩大,人们对功能性保健食品、美容用品、中草药及中药制剂等产品的需求量增加。滨海白首乌种植应发挥其传统优势和地域优势,结合滨海白首乌产业现状,进一步加强对白首乌的高产优质栽培、良种选育、遗传基础以及产品加工等方面的研究,从而选出功能突出的白首乌品种、优质高产的栽培技术以及多样的白首乌制品种类。
白首乌是我国最受欢迎的传统中药材之一,但目前国内还没有白首乌临床试验的文献报道。根据上述的研究空白,应系统开展白首乌的化学活性成分、潜在分子机制、毒性评价、质量安全标准以及高产栽培方面的研究。
参考文献:
[1] 张 宁,闫 滨,徐星航,等. 不同来源白首乌rDNA ITS序列分析[J]. 中国中药杂志,2010,35(12):1537-1540.
[2]Wang X J,Li Z L,Lv X H,et al. Antitumor evaluation and multiple analysis on different extracted fractions of the root of Cynanchum auriculatum Royle ex Wight[J]. Journal of Separation Science,2017,40(15):3054-3063.
[3]郭 娜,李曉鹏,许 枬,等. 耳叶牛皮消中C21甾类化学成分的分离与鉴定[J]. 沈阳药科大学学报,2016,33(1):28-33.
[4]Zhu L Z,Hou Y J,Zhao M,et al. Caudatin induces caspase-dependent apoptosis in human glioma cells with involvement of mitochondrial dysfunction and reactive oxygen species generation[J]. Cell Biology & Toxicology,2016,32(4):333-345.
[5]Fu X Y,Zhang S,Wang K,et al. Caudatin inhibits human glioma cells growth through triggering DNA Damage-Mediated cell cycle arrest[J]. Cellular & Molecular Neurobiology,2015,35(7):953-959.
[6]Peng Y R,Ding Y F,Wei Y J,et al. Caudatin-2,6-dideoxy-3-O-methy-β-D-cymaropyranoside 1 induced apoptosis through caspase 3-dependent pathway in human hepatoma cell line SMMC7721[J]. Phytotherapy Research,2011,25(5):631-637.
[7]Qin J J,Chen X,Lin Z M,et al. C21-steroidal glycosides and sesquiterpenes from the roots of Cynanchum bungei and their inhibitory activities against the proliferation of B and T lymphocytes[J]. Fitoterapia,2018,124:193-199.
[8]Yang Q X,Ge Y C,Huang X Y,et al,Cynanauriculoside C-E,three new antidepressant pregnane glycosides from Cynanchum auriculatum[J]. Phytochemistry Letters,2011,4(2):170-175.
[9]Yoon M Y,Choi N H,Min B S,et al. Potent in vivo antifungal activity against powdery mildews of pregnane glycosides from the roots of Cynanchum wilfordii[J]. Journal of Agricultural & Food Chemistry,2011,59(22):12210.
[10]Li J L,Fu Y,Zhang H Y,et al. Two new humulanolides from the roots of Cynanchum wilfordii[J]. Tetrahedron Letters,2015,56(46):6503-6505.
[11]Jiang H W,Lin J,Wang G M,et al. Acetophenone derivatives from the root bark of Cynanchum wilfordii as potential neuroprotective agents[J]. Phytochemistry Letters,2018,24:179-183.
[12]Wang X,Fu X,Zhao S,et al. Antiangiogenic properties of caudatin in vitro and in vivo by suppression of VEGFVEGFR2AKT/FAK signal axis[J]. Molecular Medicine Reports,2017,16(6):8937-8943.
[13]Liu S,Chen Z,Wu J,et al. Appetite suppressing pregnane glycosides from the roots of Cynanchum auriculatum[J]. Phytochemistry,2013,93:144-153.
[14]Huang L J,Wang B,Zhang J X,et al. Synthesis and evaluation of antifungal activity of C21-steroidal derivatives[J]. Bioorganic & Medicinal Chemistry Letters,2016,26( 8):2040-2043.
[15]Gu X J,Yao N,Qian S H,et al. Four new C21 steroidal glycosides from the roots of Cynanchum auriculatum[J]. Helvetica Chimica Acta,2009,92(1):88-97.
[16]Zhang R S,Ye Y P,Shen Y M,et al. Two new cytotoxic C-21 steroidal glycosides from the root of Cynanchum auriculatum[J]. Tetrahedron,2000,56(24):3875-3879.
[17]Yin M,Chen Y,Ming W,et al. Chemical constituents in the root of Cynanchum auriculatum[J]. Journal of Chinese Medicinal Materials,2007,30(10):1245-7.
[18]Li Y,Zhang J,Gu X,et al. Two new cytotoxic pregnane glycosides from Cynanchum auriculatum[J]. Planta Medica,2008,74(5):551-554.
[19]Qi L W,Gu X J,Li P,et al. Structural characterization of pregnane glycosides from Cynanchum auriculatum by liquid chromatography on a hybrid ion trap time-of-flight mass spectrometer[J]. Rapid Communications in Mass Spectrometry Rcm,2010,23(14):2151-2160.
[20]Peng Y R,Li Y B,Liu X D,et al. Antitumor activity of C-21 steroidal glycosides from Cynanchum auriculatum Royle ex Wight[J]. Phytomedicine,2008,15(11):1016-1020.
[21]Kim C S,Oh J Y,Choi S U,et al. Chemical constituents from the roots of Cynanchum paniculatum and their cytotoxic activity[J]. Carbohydrate Research,2013,381:1-5.
[22]Huang L J,Wang B,Zhang J X,et al. Studies on cytotoxic pregnane sapogenins from Cynanchum wilfordii[J]. Fitoterapia,2015,101(Complete):107-116.
[23]Mitsuhashi H,Sakurai K,Nomura T,et al. Constituents of Asclepiadaceae plants. ⅩⅦ. Components of Cynanchum wilfordi HEMSLEY[J]. Chemical & Pharmaceutical Bulletin,1966,14(7):712.
[24]Hwang B Y,Kim S E,Kim Y H,et al. Pregnane glycoside multidrug-resistance modulators from Cynanchum wilfordii[J]. Journal of Natural Products,1999,62(4):640.
[25]Teng H L,Lu Y,Li J,et al. Two new steroidal glycosides from the root of Cynanchum auriculatum[J]. Chinese Chemical Letters,2011(1):77-80.
[26]Wang D,Bao Y R. A new steroidal glycoside from roots of Cynanchum wallichii[J]. Chemistry of Natural Compounds,2015,897-899.
[27]Lu Y,Teng H L,Yang G Z,et al. Three new steroidal glycosides from the roots of Cynanchum auriculatum[J]. Helvetica Chimica Acta,2011,94(7):1296-1303.
[28]Ma X X,Jiang F T,Yang Q X,et al. New pregnane glycosides from the roots of Cynanchum otophyllum[J]. Steroids,2007,72(11/12):778-786.
[29]Li J,Kadota S,Kawata Y,et al. Constituents of the roots of Cynanchum bungei Decne. Isolation and structures of four new glucosides,bungeiside-A,-B,-C,and -D.[J]. Chemical & Pharmaceutical Bulletin,1992,40(12):3133-3137.
[30]Zhang X,Lei S,Huang H,et al. Rapid identification of acetophenones in two Cynanchum species using liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Pharmaceutical & Biomedical Analysis,2009,49(3):715-725.
[31]Lin Y L,Wu Y M,Kuo Y H. Revised structures for four acetophenones from Cynanchum taiwanianum[J]. Phytochemistry,1997,45(5):1057-1061.
[32]Sun Y,Lin H,Wang J,et al. An application of high-speed counter-current chromatography for separation and purification of bungeiside-A,bungeiside-B and baishouwubenzophenone from Cynanchum bungei Decne[J]. Phytochem Anal,2011,22(6):526-531.
[33]Sun Y,Liu Z,Wang J,et al. Aqueous ionic liquid based ultrasonic assisted extraction of four acetophenones from the Chinese medicinal plant Cynanchum bungei Decne[J]. Ultrasonics Sonochemistry,2013,20(1):180-186.
[34]Ying L,Piao D,Zhang H,et al. Quality assessment and discrimination of the roots of Cynanchum auriculatum and Cynanchum wilfordii by HPLC-UV analysis[J]. Archives of Pharmacal Research,2013,36(3):335-344.
[35]Shan L,Zhang W D,Zhang C,et al. Antitumor activity of crude extract and fractions from root tuber of Cynanchum auriculatum Royle ex Wight[J]. Phytotherapy Research,2010,19(3):259-261.
[36]Wang X J,Lv X H,Li Z L,et al. Chemical constituents from the root bark of Cynanchum auriculatum-ScienceDirect[J]. Biochemical Systematics and Ecology,2018,81:30-32.
[37]Jiang Y F,Choi H G,Ying L,et al. Chemical constituents of Cynanchum wilfordii and the chemotaxonomy of two species of the family Asclepiadacease,C. wilfordii and C. auriculatum[J]. Archives of Pharmacal Research,2011,34(12):2021-2027.
[38]He M F,Lin L,Wei G,et al. Antiangiogenic activity of Tripterygium wilfordii and its terpenoids[J]. Journal of Ethnopharmacology,2009,121(1):61-68.
[39]Yeo H,Kim J. A benzoquinone from Cynanchum wilfordii[J]. Phytochemistry,1997,46(6):1103-1105.
[40]Hu S,Jin Z,Wang S,et al. The mechanism of antitumor activity of total glucosides extracted from Cynanchum auriculatum royle (CA)[J]. Chinese Journal of Cancer Research,1989,1(2):33-40
[41]Huang L J,Wang B,Zhang J X,et al. Studies on cytotoxic pregnane sapogenins from Cynanchum wilfordii[J]. Fitoterapia,2015,101(Complete):107-116.
[42]Lv W,Zhang A,Shan X,et al. Effects of general glycosides in Cynanchum auriculatum of Jiangsu province on liver fibrosis of rats[J]. Zhongguo Zhong Yao Za Zhi,2009,34(19):2508-2511.
[43]Jiang H W,Gu S S,Cao L,et al. Potential hypoglycemic effect of acetophenones from the root bark of Cynanchum wilfordii[J]. Natural Product Research,2018,33(16):1-8.
[44]Lee H S,Choi J H,Kim Y E,et al. Effects of the Cynanchum wilfordii ethanol extract on the serum lipid profile in hypercholesterolemic rats[J]. Preventive Nutrition & Food Science,2013,18(3):157-162.
[45]Ji C X,Li X Y,Jia S B,et al. The antidepressant effect of Cynanchum auriculatum in mice [J]. Pharmaceutical Biology,2012,50(9):1067-72.
[46]Wang X,Fu X,Zhao S,et al. Antiangiogenic properties of caudatin in vitro and in vivo by suppression of VEGFVEGFR2AKT/FAK signal axis[J]. Molecular Medicine Reports,2017,16(6):8937-8943.
[47]Deok H C,Yun J L,Jin S K,et al. Cynanchum wilfordii ameliorates hypertension and endothelial dysfunction in rats fed with high fat/cholesterol diets[J]. Immunopharmacology and Immunotoxicology,2011,34(1):4-11.
[48]Choi D H,Yun J L,Oh H C,et al. Improved endothelial dysfunction by Cynanchum wilfordii in apolipoprotein E(-/—) mice fed a high fat/cholesterol diet.[J]. Journal of Medicinal Food,2012,15(2):169.
[49]赫明濤,吴承东. 白首乌蚕豆套种栽培技术[J]. 耕作与栽培,2013(4):48-49.
[50]赫明涛,耿安红,郭树庆,等. 小麦套种白首乌栽培技术[J]. 耕作与栽培,2015(5):62-63.
[51]吴承东,赫明涛,王 军,等. 白首乌-油菜套种栽培技术[J]. 现代农业科技,2013(8):27-28.
[52]张 明,顾小兵,李春阳,等. 白首乌水旱轮作种植技术研究[J]. 农业开发与装备,2020 (11):203-204.
[53]张 明,吴承东. 白首乌露地立式高效栽培关键技术[J]. 江西农业,2017(8):9-10.
