抗血管紧张素Ⅱ1型受体抗体在肾脏疾病中的应用
2022-02-14邓佳仪综述胡伟新审校
邓佳仪 综述 胡伟新 审校
抗血管紧张素Ⅱ(AngⅡ)1型受体(AT1R)抗体是近年来备受关注的一种自身抗体,不仅与器官移植的体液排斥反应相关,也与许多自身免疫性疾病有关,如系统性硬化症(SSc)及其相关肺动脉高压(PAH)、系统性红斑狼疮(SLE)、子痫前期等[1-3],表明抗-AT1R抗体与炎症、微血管功能、纤维化存在密切联系。抗-AT1R抗体在器官移植中研究较多,它是移植后排斥反应的重要危险因素,参与血管排斥反应,并与移植物失功和预后有一定关系[4]。在系统性硬化,抗-AT1R抗体能够预测SSc-PAH患者的发展以及预后[1]。抗-AT1R抗体还促进胎盘滋养细胞分泌可溶性fms样酪氨酸激酶1(sFlt-1),引起孕妇内皮损伤和功能障碍,促进子痫前期的发生发展[2]。本文综述抗-AT1R抗体的产生及危险因素、致病机制以及与肾脏疾病相关的研究。
AT1R及其抗体的结构与功能
血管紧张素Ⅱ1型受体(AT1R)Ang Ⅱ受体有AT1R和AT2R两种亚型。AT1R是位于3号染色体长臂上(3q24)的AGTR1基因编码的G蛋白偶联受体[5],分布于全身多种细胞,尤其是心脏、肝脏和肾脏的内皮细胞、肾小球足细胞、血管平滑肌细胞及免疫细胞[6-7]。AT1R和AT2R在正常肾小球表达较弱,沿肾小球毛细血管环呈点状分布,在肾脏损伤时,随着蛋白尿的增加,AT1R和AT2R的染色强度逐渐增强[7]。
AT1R的C-末端螺旋Ⅷ能和钙调蛋白结合,参与受体内化、G蛋白激活及信号转导[8]。AT1R与配体结合后,其胞质尾部的丝氨酸/苏氨酸残基被G蛋白受体激酶磷酸化,激活信号转导的级联反应[9]。Ang Ⅱ是AT1R的天然配体,可通过AT1R调节动脉血压和水盐平衡[5],参与伤口愈合、组织修复、细胞迁移、蛋白质合成、足细胞功能等生理过程[7-8]。Ang Ⅱ还可与AT2R结合,发挥抗炎、抗增殖、抗纤维化或抗凋亡的功能,保护心血管、肾脏以及神经等[10]。在肾小球足细胞,AT1R介导的作用抑制足突裂隙隔膜相关分子的mRNA表达,导致足突损伤和蛋白尿的产生,而AT2R介导的作用增强了这些分子的表达而起到降低尿蛋白的作用[11]。
抗-AT1R抗体抗-AT1R抗体是一种能与AT1R结合的IgG1和IgG3亚型的功能性激动性抗体[12]。抗-AT1R抗体与AT1R结合的方式类似于Ang Ⅱ,但结合位点有所不同:Ang Ⅱ是一种顺位AT1R配体,结合 AT1R跨膜螺旋和细胞外环之间的口袋中的顺位(内源性)位点[13];而抗-AT1R抗体是变构AT1R激动剂,识别AT1R的细胞外环2(ECL2)表位[6]。与Ang Ⅱ相比,抗-AT1R抗体可延长AT1R的刺激活性,引起血管收缩、炎症、组织纤维化、内皮功能损伤等病理过程[8]。抗-AT1R抗体导致损伤的机制和信号通路尚未完全明确。有研究表明,抗-AT1R抗体与内皮细胞、血管平滑肌的AT1R结合激活蛋白激酶C(PKC),导致内皮细胞激活,通过细胞外信号调节激酶1/2(ERK1/2)磷酸化以及激活蛋白1(AP-1)和核因子κB (NF-κB)活化,增加组织因子(TF)、纤溶酶原激活物抑制剂1(PAI-1)、白细胞介素(IL)-1、IL-6、 IL-8、肿瘤坏死因子α(TNF-α)、巨噬细胞炎症蛋白1(MIP-1)、血管细胞黏附分子1(VCAM-1)等趋化因子和血管黏附分子表达,促进中性粒细胞迁移、成纤维细胞Ⅰ型胶原和活性氧(ROS)的产生,参与促凝、损伤、炎症、免疫调节等反应[6,12,14-15]。抗-AT1R抗体可通过AT1R增加内皮细胞、血管平滑肌细胞、血小板、淋巴细胞等多种细胞内的Ca2+内流,一方面导致血管收缩,另一方面调节钙调神经磷酸酶信号通路,活化T细胞核因子(NFAT),上调下游目标基因的转录,增加PAI-1、IL-8、TNF-α等表达,还可以促进胎盘滋养细胞分泌sFlt-1(图1)[16-17]。研究发现,抗-AT1R抗体可促进C3转化为C3a(具体机制不明),除了导致细胞损伤和炎症反应,C3a还可与滋养细胞的C3a受体(C3aR)结合促进sFlt-1的分泌[18]。sFlt-1通过附着胎盘生长因子(PLGF)和血管内皮生长因子(VEGF)的受体结合域,阻止它们与内皮受体的相互作用,减弱内皮细胞的增殖、迁移和血管形成能力,损伤内皮功能,进而促进子痫前期的发展[19]。还有研究者认为,抗-AT1R抗体可能会导致足细胞损伤、肾小球细胞增生和蛋白尿。在动物模型和足细胞研究中,抗-AT1R抗体阻止了裂隙隔膜分子的mRNA表达,进而导致蛋白尿[11]。AT1R拮抗剂(ARB)和7AA表位多肽可以阻断由抗-AT1R抗体介导的部分作用[12,18]。
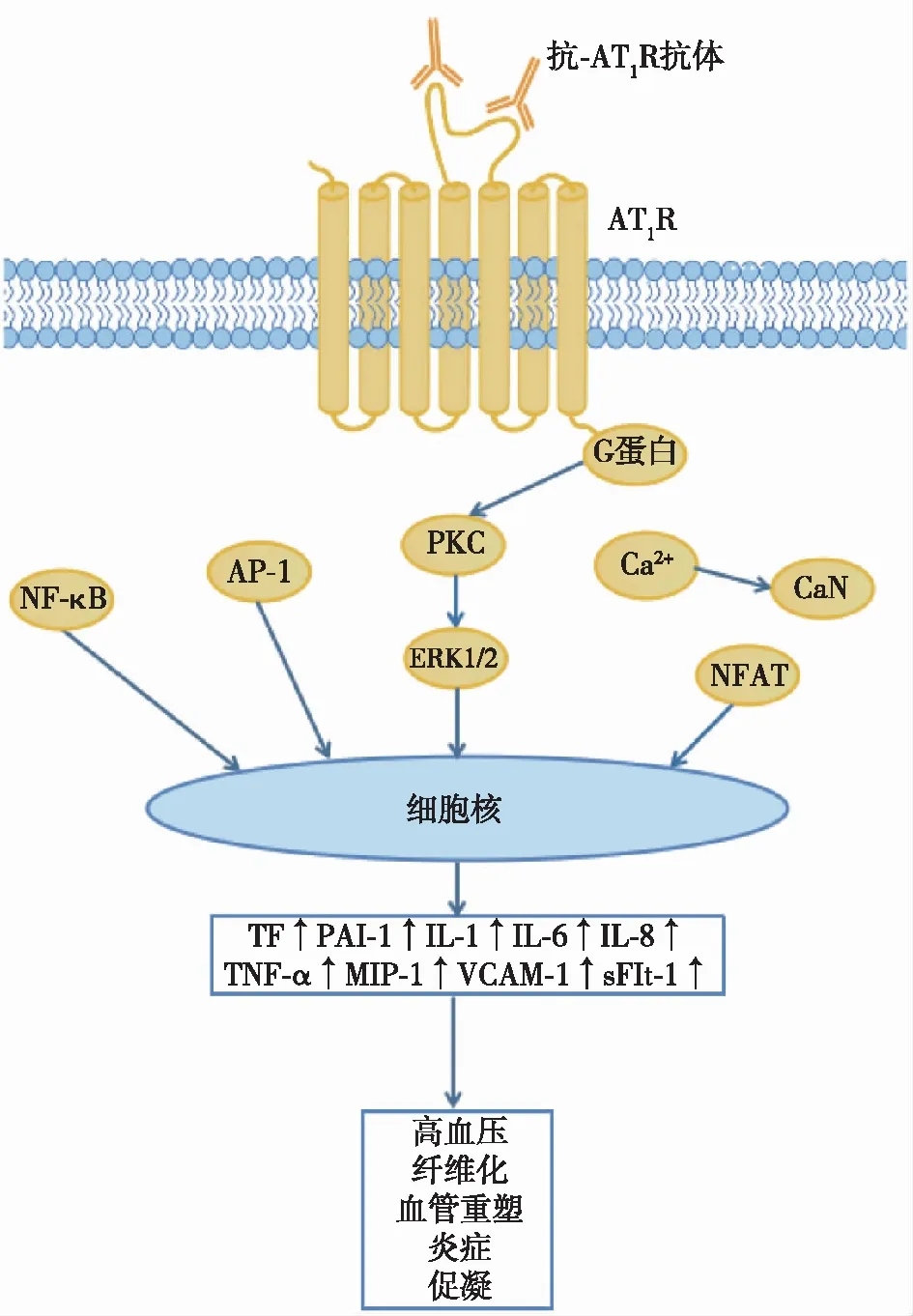
图1 抗-AT1R抗体与AT1R结合的信号传导途径AT1R:血管紧张素Ⅱ1型受体;PKC:蛋白激酶C;ERK1/2:细胞外信号调节激酶1/2;PAI-1:纤溶酶原激活物抑制剂1;TF:组织因子;AP-1:激活蛋白1;NF-κB:核因子κB;CaN:钙调神经磷酸酶;NFAT:活化T细胞核因子;IL;白细胞介素;TNF-α:肿瘤坏死因子α;MIP-1:巨噬细胞炎症蛋白1;VCAM-1:血管细胞黏附分子1;sFlt-1:可溶性fms样酪氨酸激酶1
抗-AT1R抗体产生机制
抗-AT1R抗体的产生机制复杂,涉及一系列病理生理事件,可能与机体自身免疫识别暴露的隐蔽抗原或者识别构象发生改变的抗原有关。有学者提出,内皮受损以及AT1R细胞外部分脱落可以诱导自身抗体形成[9]。也有学者认为重复的受体刺激是促进受体内化降解、诱导自身免疫的重要机制:膜表面受体被反复刺激后内化,内化受体在溶酶体中降解融合,转移到细胞表面后提呈给免疫细胞引起自身免疫[20]。Dragun等[12]推测肾移植时缺血再灌注损伤(IRI)可能改变了AT1R的密度或构象,从而激活自身免疫。
研究表明,既往肾移植史、糖尿病、狼疮性肾炎(LN)或局灶性节段性肾小球硬化是移植前产生抗-AT1R抗体的危险因素,而IRI、感染、存在供体特异性抗体(DSA)、排斥反应等可能导致内皮损伤并可诱导移植后新发抗-AT1R抗体[14]。国外有研究发现减少免疫抑制药物可能与抗-AT1R抗体的产生有关[5]。由此可见,促进抗-AT1R抗体产生的因素多样,并且各个因素与抗体产生之间的关联性还无法统一。
抗-AT1R抗体与自身免疫性疾病
狼疮性肾炎(LN)全基因组关联研究(GWAS)表明大量非HLA位点对SLE发病有显著影响[21]。不少学者在LN(尤其是在活动性LN)患者中都检测到了抗-AT1R抗体,但在不同研究中抗-AT1R抗体的发生率各不相同。Xiong等[22]发现LN患者的抗-AT1R抗体阳性率为66.29%,其中近12周未使用免疫抑制剂的LN患者中抗体阳性率为76.06%,使用免疫抑制剂的LN患者的抗体阳性率为27.78%,而健康人群抗体阳性率为9.64%,这说明抗-AT1R抗体升高与LN活动密切相关,免疫抑制剂能显著抑制抗-AT1R抗体的产生。Mejia-Vilet等[23]报道在107例已经使用糖皮质激素的活动性LN患者中抗体阳性率为54%,这与Xiong等[22]的发现差别较大,可能与测量方法、患者人种、LN活动性、使用免疫抑制剂的时间、种类有关。Mejia-Vilet等[23]还发现,治疗前抗-AT1R抗体的水平与治疗12月的反应性无关,但是他们并未检测治疗后抗-AT1R抗体水平,也并未分析治疗后抗体水平及其变化与治疗反应的关系。因此,在LN患者中何时出现抗-AT1R抗体以及抗-AT1R抗体能否预测疾病发展和预后还有待进一步研究。
在SLE患者固有的免疫功能紊乱背景下,沉积在内皮下的免疫复合物可能通过活化内皮细胞、增加黏附分子表达、产生趋化因子和炎症反应、激活补体等机制导致内皮细胞损伤[24],后者暴露内源性AT1R的抗原表位,从而诱导机体产生抗-AT1R抗体。
根据目前研究,抗-AT1R抗体在LN中作用主要体现在抗-AT1R抗体对微血管的损伤上。Mejia-Vilet等[23]报道抗-AT1R抗体水平与血清补体C3和C4水平相关,并且抗-AT1R抗体可能与微血管损伤相关,主要表现为内膜纤维化和中膜增生。他们发现抗-AT1R抗体阳性组的补体C3、C4水平均低于抗-AT1R抗体阴性组。在肾活检病理中,抗-AT1R抗体阳性的活动性LN患者的节段性肾小球病变、内膜下纤维化及中膜增生均多于抗-AT1R抗体阴性的LN患者,抗-AT1R抗体阳性LN的血管病变可能是由于抗-AT1R抗体激活血管平滑肌细胞的AT1R,引起平滑肌细胞增殖、氧化应激和细胞迁移等病理生理反应,继而导致血管重塑和动脉粥样硬化。
系统性硬化症(SSc)以内皮细胞功能障碍、血管周围浸润为特征的微血管病变和炎症是SSc发病的关键。有研究表明,抗-AT1R抗体和抗内皮素1型A受体(抗-ETAR)抗体与SSc的血管病变、炎症和纤维化有关。抗-AT1R抗体和抗-ETAR抗体通过AT1R和ETAR促进微血管内皮细胞释放IL-8、VCAM-1,促进中性粒细胞跨内皮细胞迁移及中性粒细胞中ROS产生,导致内皮细胞激活并影响内皮细胞的修复。抗-AT1R抗体和抗-ETAR抗体还可促进成纤维细胞分泌胶原蛋白,其促纤维化的作用与抗体水平相关。实验证实反复抗-AT1R抗体和抗-ETAR抗体刺激可导致小鼠肺结构的显著改变,表现为间质组织细胞密度增加以及间质细胞浸润增加[25],这可能是SSc-PAH的发生机制之一。Becker等[1]报道SSc-PAH和结缔组织病相关肺动脉高压(CTD-PAH)患者的抗-AT1R抗体和抗-ETAR抗体水平明显高于特发性肺动脉高压(IPAH)患者,在对253例SSc患者随访时发现抗-AT1R抗体和抗-ETAR抗体可预测SSc-PAH的发生以及患者的死亡。研究人员注意到这两种抗体可以增加细胞内Ca2+内流并提高Ang Ⅱ和内皮素1(ET-1)的缩血管作用。此外,他们用SSc患者的IgG对小鼠进行实验时也观察到不同程度的肺动脉闭塞性病变和细胞浸润。基于这些研究结果,抗-AT1R抗体和抗-ETAR抗体可能是未来干预SSc的新靶点。
抗AT1R与其他肾脏疾病
子痫前期研究人员最先在子痫前期患者中发现抗-AT1R抗体。抗-AT1R抗体直接参与子痫前期的病理生理过程,影响母体和胎儿的不良结局。动物实验研究发现,抗-AT1R抗体能以剂量依赖的方式诱导妊娠小鼠出现子痫前期症状。将抗-AT1R抗体注入妊娠小鼠体内可引起高血压、蛋白尿和部分子痫前期表现[26]。多项研究表明,抗-AT1R抗体可通过AT1R升高血压,也可激活细胞内信号通路导致TNF-α、ROS、sFlt产生增加[27]。Siddiqui等报道,在重度子痫前期患者中,循环抗-AT1R抗体水平与收缩压、蛋白尿和循环sFlt-1水平显著相关[28]。因此,有人提出假设,胎盘缺血导致的免疫反应激活促进了抗-AT1R抗体的产生,抗体刺激AT1R后导致sFlt-1过表达。抗-AT1R抗体可以激活补体C3,诱导包括胎盘和肾脏在内的多种组织中的C3沉积。C3a和胎盘组织中的C3aR结合,促使sFlt-1分泌增多[18]。其次,抗-AT1R抗体还可以启动钙调神经磷酸酶信号,使NFAT磷酸化,增加Flt基因转录[17]。sFlt-1可阻断VEGF和PLGF作用,减弱内皮细胞的增殖、迁移和血管形成能力,导致内皮损伤和功能障碍,引起高血压和蛋白尿[19]。
糖尿病肾病糖尿病肾病是糖尿病最常见的微血管并发症之一。在糖尿病患者中,高糖和葡萄糖副产物会促进氧化和炎症的发生,导致肾内皮功能障碍[29]。晚期糖基化产物(AGEs)会导致Ang Ⅱ自分泌增多[30],过多的Ang Ⅱ可通过AT1R触发细胞增殖和细胞外基质积聚、巨噬细胞浸润、趋化因子增加,从而导致肾小球内压增高、内皮细胞损伤及抗原暴露[20]。因此,糖尿病患者体内产生的抗-AT1R抗体可能与代谢紊乱导致内皮细胞损伤有关,也可能与局部增多的Ang Ⅱ导致受体内化有关。我国学者发现糖尿病肾病患者血清抗-AT1R抗体的阳性率明显高于糖尿病患者和正常对照者[31]。Zhao等[20]也得出同样结论,在他们的研究中,糖尿病肾病患者抗-AT1R抗体和抗-β1 受体抗体阳性率分别为51.5%和 53.1%。在酒石酸美托洛尔和缬沙坦治疗7月和13月后,抗-AT1R抗体和抗-β1 受体抗体阳性患者的尿蛋白排泄率明显改善,并且明显优于抗体阴性组。值得考虑的是,我们能否通过检测糖尿病肾病患者有无相应受体抗体,再根据其检测结果给予相应的受体拮抗剂优化治疗。
靶向抗-AT1R抗体的治疗
抗-AT1R抗体在疾病中具有普遍的致病性,并与疾病不良结局相关,因此针对抗-AT1R抗体的治疗可能改变患者预后。ARB可以通过竞争AT1R有效阻断肾素-血管紧张素-醛固酮系统(RAAS)活化,具有明显的心脏和肾脏保护作用。在心脏和肾脏移植中,移植后1年内使用ARB患者的微血管病变比未使用ARB的患者轻[22,32]。ARB阻断Ang Ⅱ和AT1R结合是否可以减少Ang Ⅱ对AT1R的重复刺激,从而减少受体内化、减少抗-AT1R抗体的产生值得进一步研究。
血浆置换去除抗-AT1R抗体可用于病情较为严重的患者[12],使用血浆置换联合ARB对肾移植后出现严重血管排斥反应、恶性高血压的患者有一定效果[33]。有研究发现血浆置换联合应用免疫抑制剂可能改善CTD-PAH患者的血流动力学参数[34]。
运用抗-AT2R抗体激活AT2R反向调节AT1R介导的作用可能是一种治疗的新方法。Liles等[35]发现兔抗-AT2R抗体在与Ang Ⅱ或抗-AT1R抗体共存时,可以识别AT2R第二细胞外环N端附近的优势序列,有效地拮抗Ang Ⅱ诱导的大鼠提睾主动脉收缩的作用,并且在体外研究中抗-AT2R抗体不与AT1R发生反应。因此,针对RAAS过度激活或已产生抗-AT1R抗体的患者使用抗-AT2R抗体是否能够改善部分症状也值得继续探究。
小结:抗-AT1R抗体是一种功能性自身抗体,模拟AT1R的天然配体,引发血管收缩、促炎症和促纤维化等表现,在肾脏疾病发生和发展中发挥重要作用。ARB可以通过竞争AT1R减弱抗-AT1R抗体的致病效果。目前抗-AT1R抗体在器官移植中的价值已得到大家的认可,但在其他疾病中的作用还不明确,并不同疾病中的抗-AT1R抗体如何产生?何时产生?都没有确切的答案,需要更多的研究来解决这个难题。
