热量限制对肾缺血损伤后纤维化的影响及机制研究
2022-02-14查宏楚朱杰夫李惠敏宋志霞
查宏楚 朱杰夫 师 朗 夏 瑶 李惠敏 宋志霞
急性肾损伤(AKI)是较为常见的严重临床综合征,其主要临床特征是肾功能在短期内下降导致体内肌酐和尿素等含氮废物蓄积。据统计,AKI每年造成约200万人死亡,且部分存活的AKI患者仍可进展为慢性肾脏病(CKD)[1-4]。多种CKD均以肾纤维化为共同终点且难以逆转。肾纤维化以细胞外基质(ECM)的过度沉积导致组织瘢痕为特征,其发生发展的机制尚不明确,目前临床上无有效防治措施。
热量限制(CR)预处理对肾损伤的保护作用在多种啮齿类动物损伤模型中得以证实[5-7]。近期来自科隆大学的Roman-Ulrich Müller团队在肾脏缺血再灌注损伤(IRI)模型,探讨了CR对肾损伤保护作用的分子机制[8]。但是在临床实践中多面临的是肾脏缺血的后期阶段,而CR在肾脏缺血后修复中的作用及机制尚不清楚。本文拟探讨CR对肾脏IRI后纤维化的影响及机制。
对象与方法
研究对象C57BL/6J小鼠购于三峡大学实验动物中心。肾小管特异性ATG7基因敲除(RT-Atg7-KO)鼠是通过ATG7 flox/flox小鼠同KSP3.1-Cre转基因小鼠杂交培育建立的RT-Atg7-KO小鼠模型(图1)。ATG7 flox/flox和KSP3.1-Cre小鼠购自美国缅因州Jackson实验室。自噬报告小鼠为RFP-GFP-LC3转基因鼠[C57BL/6-Tg(CAG/RFP/EGFP/Map1LC3B)1Hill/J],购自美国缅因州Jackson实验室。

图1 A:肾小管特异性ATG7基因敲除鼠的鉴定及验证;B:ATG7免疫印迹代表图
实验方法
分组和造模 本动物研究方案经三峡大学伦理委员会批准(批准文号202205010T2)。将体重为20~25 g的C57BL/6J雄性小鼠(共20只)随机分为假手术组、假手术CR组、IRI组(左侧肾脏缺血30 min再灌注)、IRI-CR组(左侧缺血30 min再灌注CR),每组5只鼠。按照文献报道的方法,术前麻醉小鼠,分离左侧肾动脉,用动脉夹夹闭左侧肾动脉30 min,后松开动脉夹,将小鼠肌层和皮肤层依次缝合[9]。整个手术过程小鼠体温维持在(36 ℃~37.2 ℃)。术后第3天开始,CR组小鼠限时喂食(进食时间3.5 h),每日饮食摄入量为正常水平的 66%,对照组小鼠缺血术后自由饮食,所有动物均自由饮水。每天限时饮食时观察各组小鼠状态情况并记录。在再灌注第20天行右肾切除术,右肾切除术后24 h麻醉小鼠并通过左侧肾动脉取血,留取血清样本采用7 600 p Hitachi生化仪器检测血清肌酐、尿素氮。同时左侧肾脏做冠状切面,留取部分组织行病理检查(图2A)。RFP-GFP-LC3融合蛋白的自噬报告小鼠、RT-Atg7-KO鼠的造模方法与C57BL/6J雄性小鼠一致。
免疫组化和肾小管损伤评分 经多聚甲醛固定后的肾组织分别经过梯度乙醇70%、85%、95%、100%脱水以及二甲苯处理后进行石蜡包埋。5 μm的石蜡切片经过二甲苯和乙醇的逐步水化后进行免疫组化、Masson及HE染色,染色肾组织石蜡切片脱蜡后水洗,柠檬酸抗原修复,封闭。Beclin1一抗(proteintech,11306-1-AP,1∶200)、α平滑肌肌动蛋白(α-SMA)一抗(RnDSystems, MAB1420-SP,1∶20)。
肾小管损伤评分:视野内有0~25%损伤小管为1分,视野内有26%~50%损伤小管为2分,视野内有51%~75%损伤小管为3分,视野内有>75%损伤小管为4分。 所有的切片为随机检查外髓质和皮质部分,每张切片检测10个视野,取平均值计算肾小管损伤评分,用显微镜拍摄具有代表性的照片。
免疫印迹 SDS蛋白裂解液提取各组肾皮质组织蛋白,检测ATG7(Proteintech,10088-2-AP,1∶1 000)、β-actin(ZEN BIO,380624,1∶5 000)和微管相关蛋白轻链3B(LC3B)(Novusbio,NB100-2220,1∶1 000)的表达。稀释后的一抗4℃孵育过夜,洗涤后辣根过氧化物酶(HRP)偶联的二抗孵育1 h。使用化学发光对印迹进行检测。
统计学方法采用《Graph Pad Prism 9.0.0》进行统计学分析,数据以平均±标准差表示。采用配对t检验确定两组间的统计学意义。采用单因素方差分析确定两组以上之间的统计学意义。P<0.05为差异有统计学意义。
结 果
CR加重了肾缺血性纤维化结果显示,IRI后采用CR处理组血清肌酐(图2B)和尿素氮(图2C)较正常饮食组显著升高。肾组织HE染色可见IRI后肾间质炎性浸润、小管扩张、间质增生等损伤,其中CR处理组明显加重(图3A)、肾小管损伤评分CR组较高(图3B)。最值得关注的是,相比于单纯IRI组,CR组细胞外基质的过度沉积导致组织瘢痕异常明显,包括炎症细胞浸润、肌成纤维细胞活化、小管萎缩和毛细血管稀疏化等(图4A)。纤维化标志物α-SMA的表达和纤维化面积比也在CR处理组明显增加(图4B、C)。

图2 实验流程及C57BL/6J小鼠肾功能Sham:假手术组;CR:热量限制;UI30R:单侧缺血30 min再灌注组;A:动物实验流程图;B:各组血清肌酐结果;C:各组尿素氮结果;*:与Sham 或者 Sham+CR组相比,P<0.05;#:与UI30R组相比,P<0.05;n=5

图3 C57BL/6J小鼠肾脏组织HE染色及肾小管间质损伤评分Sham:假手术组;CR:热量限制;UI30R:单侧缺血30 min再灌注组;A:肾组织HE染色(×400);B:肾小管损伤评分;*:与Sham组或者Sham+CR组相比,P<0.05;#与UI30R组相比,P<0.05;n=5
CR增强了肾缺血后自噬活性在表达RFP-GFP-LC3融合蛋白的自噬报告小鼠IRI模型中发现,AKI后小鼠肾小管细胞黄绿色及红荧光均增强,提示自噬活性增强。最值得关注的是,IRI后经过CR处理组肾小管细胞红色荧光尤为显著增强,提示自噬溶酶体形成增加(图5A、B)。在C57BL/6J小鼠IRI模型中发现,肾脏的细胞自噬标记蛋白Beclin1水平上升。当经过CR处理后Beclin1表达更为显著(图5C)。LC3B免疫印迹结果同荧光结果一致(图5D、E)。这些结果均表明,CR显著增强了肾缺血后肾小管上皮细胞自噬活性。

图4 C57BL/6J小鼠肾脏组织病理及间质纤维化面积比Sham:假手术组;CR:热量限制;UI30R:单侧缺血30 min再灌注组;α-SMA:α平滑肌肌动蛋白;A:肾组织Masson染色(×400);B:肾组织α-SMA组化染色(×400);C:间质纤维化面积比;*:与Sham组或者Sham+CR组相比,P<0.05;#:与UI30R组相比,P<0.05;n=5

图5 自噬报告小鼠肾脏组织RFP-GFP-LC3荧光、C57BL/6J小鼠Beclin1组化及LC3B免疫印迹代表图LC3:微管相关蛋白轻链 3;Sham:假手术组;CR:热量限制;UI30R:单侧缺血30 min再灌注组;A:CR组激活自噬,自噬溶酶体形成(IF,×400);B:单位肾小管上皮细胞LC3点数半定量;C:Beclin1表达在CR组增高(IH,×400);D:LC3B免疫印迹;E:LC3Ⅱ/Ⅰ半定量分析;*:与Sham组相比,P<0.05;#:各组黄绿色点数相比,P<0.05;n=5>
CR对肾缺血性纤维化的影响在自噬被抑制后明显减弱为了进一步探讨自噬在CR促进小鼠的肾缺血性纤维化进程的作用,我们将肾小管特异性ATG7基因敲除鼠分组行单侧IRI及CR处理实验。结果发现,肾小管特异性ATG7敲除后,CR对小鼠的肾脏缺血性纤维化影响消失(图6A~C)。同时,在肾小管特异性ATG7敲除鼠中,CR对肌酐及尿素氮的影响也消失(图6D、E)。可见,自噬被抑制以后CR对肾缺血性纤维化的影响消失。上述结果提示,IRI后CR处理可能由于过度激活自噬引起肾脏纤维化加重。CR影响缺血性肾脏纤维化的进展同自噬密切相关。
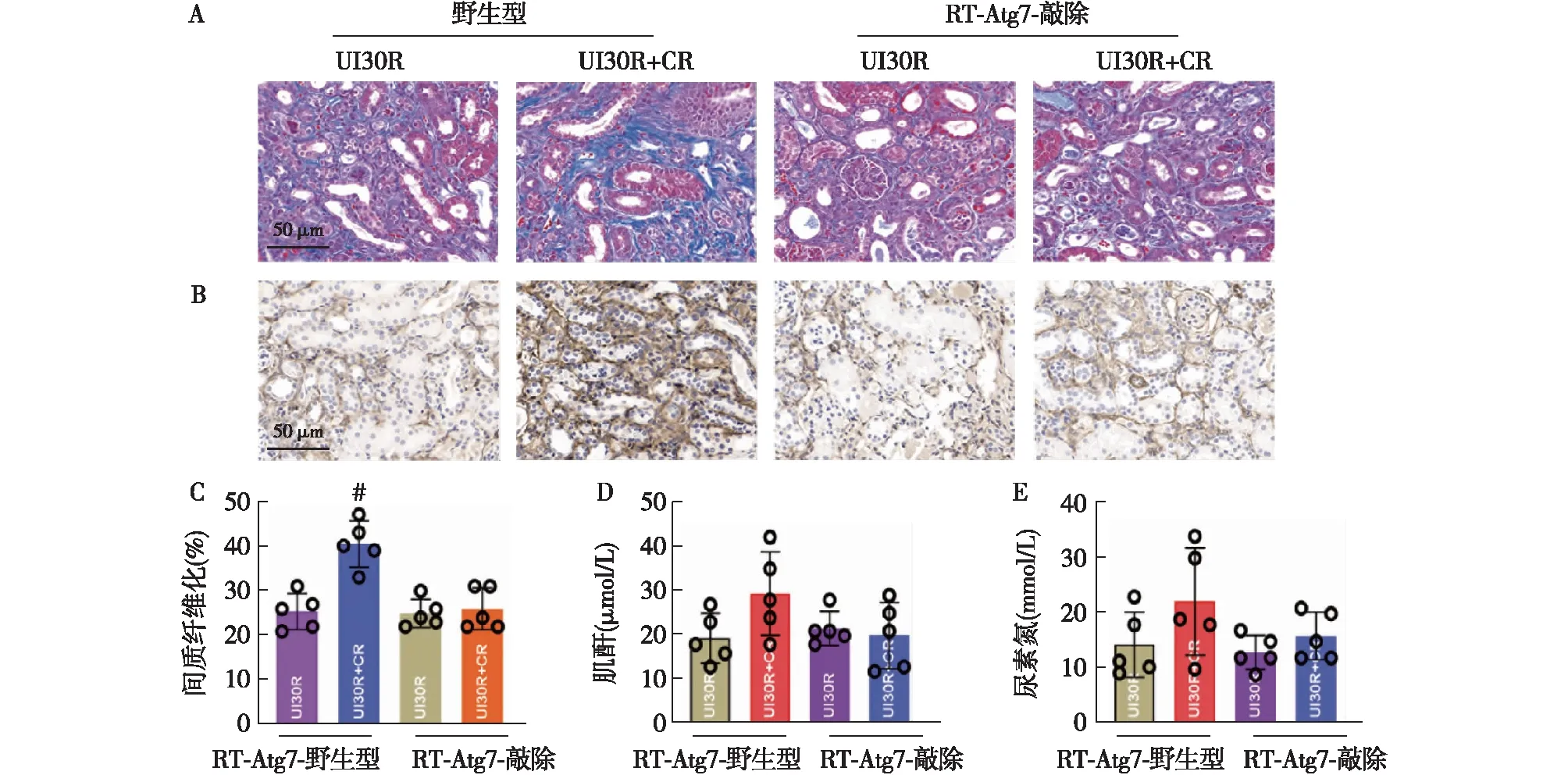
图6 ATG7敲除鼠肾脏组织病理和肾功能Sham:假手术组;CR:热量限制;UI30R:单侧缺血30 min再灌注组;α-SMA:α平滑肌肌动蛋白;A:ATG7敲除后,CR对肾缺血性纤维化影响消失(Masson染色,×400);B:ATG7敲除后,CR组α-SMA表达与UI30R组无明显差异(IH,×400);C:半定量分析;D:ATG7敲除后,CR组与UI30R组血清肌酐无明显差异;E:ATG7敲除后,CR组与UI30R组血尿素氮无明显差异;#:与UI30R组相比,P<0.05
讨 论
在阐释肾纤维化的机制和制订相应治疗策略中,尽管许多研究者已作出了巨大努力,但在如何阻止肾纤维化进展方面仍无可行的有效方案。近年来,CR的研究较热门,而CR对肾缺血后纤维化进程的影响目前尚无研究,本研究试图探讨了这一科学问题。我们发现在IRI后,CR干预对肾脏IRI损伤后修复并未呈现出保护作用,反而加重了肾纤维化。
AKI后肾脏纤维化的过程中,成纤维细胞活化伴随着炎症细胞的浸润,如中性粒细胞、淋巴细胞和巨噬细胞等。肾小管上皮细胞发生多种变化,包括部分上皮细胞向间充质细胞转化、细胞周期阻滞、细胞衰老和凋亡,导致肾小管萎缩。毛细血管内皮细胞损伤,发生衰老和凋亡,导致微血管稀疏化[10]。所有这些细胞成分都可能通过分泌ECM成分、细胞外囊泡、可溶性因子和代谢产物来促进肾脏纤维化的形成[11]。贯穿这一转变过程需要大量能量的支持,CR必然带来各种重新分配。如CR可诱导细胞代谢途径转向糖酵解[12]。另外,既往有研究指出,哺乳动物雷帕霉素靶蛋白(mTOR)激酶为营养和能量感知的靶点[13]。mTOR通路又是自噬调控的关键环节。可见CR影响较大的生物学过程包括细胞自噬。自噬是对细胞内的蛋白质和细胞器进行管理和质量控制的生物现象,在机体的生理和病理过程中均可见。研究证实,当细胞受到应激时,原本处于低水平维持平衡生物分子的恒定合成的自噬,就会被大幅度上调,这种变化增加了细胞的吸收和降解功能,将大分子物质释放回胞质中以驱动必需的代谢反应并产生能量[14-16]。自噬是各种疾病的重要调节器,其作用是正面的还是负面的尚未完全阐明[17-19]。已证实,肾缺血性纤维化全过程中均存在自噬的变化,在缺血损伤的早期,大部分学者认为发挥保护作用,但是在AKI后修复不良性的肾脏纤维化进程中的作用尚不清楚,值得进一步探讨。有学者发现自噬可能通过加重脂毒性从而促进了肾纤维化进展[20]。故本研究探讨了细胞自噬在AKI向CKD转变过程中的影响。研究发现,CR和IRI均可激活自噬,当IRI组小鼠被CR处理3周后,自噬持续激活,且较单因素处理更强。我们在表达RFP-GFP-LC3融合蛋白的自噬报告小鼠进一步验证发现,CR处理IRI组小鼠后,小鼠近端小管的细胞自噬水平显著增加,并且在手术后3周同样能观察到明显的自噬小体和自溶小体的存在。可见,在AKI向CKD转化的过程中,自噬的过度激活对肾脏损伤后的修复极为不利。由此我们推测CR通过进一步激活自噬从而加重IRI后肾纤维化进展,AKI之后抑制自噬的活性可能有助于延缓肾纤维化。
自噬相关基因ATG7编码泛素E样连接酶,在ATG12与ATG5结合前激活ATG12,促进前吞噬体的扩张,ATG7还促进蛋白质LC3-Ⅰ与磷脂酰乙醇胺的脂质化,产生LC3Ⅱ。ATG7全敲除小鼠出生24 h内死亡[21]。由此可见,ATG7是自噬现象中的关键基因,所以我们选择ATG7条件敲除小鼠作为研究对象,探讨自噬阻断后CR对肾脏缺血损伤后的修复情况。干预细胞自噬对小鼠AKI-CKD进程中有什么影响呢?本研究通过条件性肾小管ATG7敲除小鼠进行IRI后,给予CR处理。结果发现,ATG7敲除后,CR干预组肾脏纤维化程度与非CR组相当。有学者发现,肾脏纤维化促进因子TGF-β1、PDGFB、CTGF和FGF2的表达在AKI之后均显著上调,在ATG7敲除小鼠中仅观察到FGF2较低,这一研究提示自噬可能促进了FGF2的分泌[8]。在本研究中,ATG7敲除后消除了CR对IRI后肾脏慢性化进程的影响,进一步验证了CR可通过进一步激活自噬加重AKI后的肾纤维化。既往学者证实AKI前CR处理具有肾脏保护作用,而我们在AKI后CR加重肾损伤。这一现象提示,CR激活自噬在AKI的不同阶段将发挥不同的作用。然另有研究发现,衰老使肾脂肪酸氧化途径活性降低,促进肾纤维化表型。而CR可改善衰老过程中受损的肾脂肪酸氧化途径,减缓了纤维化进程[22]。同时衰老也伴自噬功能障碍[23]。可见CR在诱发纤维化的背景及干预时间不同的情况下,对肾纤维化的影响截然相反。在临床工作中,对预判可能发生AKI的患者适当的CR预处理可能有助于预防AKI的发生或减轻AKI的程度,而对于AKI后的患者保持充足的热量供应可能会促进肾损伤的修复,阻止或延缓纤维化的进展。
总之,本研究为防治AKI后肾纤维化提供了新思路。在AKI后的修复过程中,细胞自噬可能影响肾纤维化促进因子的分泌。因此,在肾移植受者恢复期给予充足热量供应是非常重要的,同时我们可通过抑制自噬缓解AKI向CKD的转变,这为肾移植受者的恢复期需要足够的热量提供了重要依据。
