PD-1/PD-L1与PI3K/AKT交叉对话与乳腺癌变免疫微环境
2022-02-14李德辉苏伊璠
李德辉 苏伊璠,2
P(1河北省中医院,河北 石家庄 050011;2河北中医学院研究生学院)
乳腺癌发病率和死亡率居全球女性恶性肿瘤之首〔1〕。乳腺癌的发生经历“正常细胞→单纯性增生→非典型增生→原位癌→浸润性癌”的连续病变过程,癌前病变作为乳腺癌发生发展的重要阶段,干预乳腺癌前病变,阻断其向乳腺癌发展,是目前防治乳腺癌的研究关键〔2〕。程序性死亡分子(PD)-1/PD-1配体(PD-L1)信号通路介导形成的免疫抑制微环境是乳腺癌变细胞赖以生存的基础,对促进乳腺癌发生发展、逃避免疫监视等方面起着重要作用〔3〕。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路异常激活与乳腺癌的发生、发展、治疗及转归关系最为密切〔4,5〕。PD-1/PD-L1与PI3K/AKT信号通路存在交叉对话,并影响肿瘤免疫微环境〔6,7〕,现就两条通路在乳腺癌变中具体交叉对话机制研究现状进行梳理和展望。
1 乳腺癌变免疫微环境
乳腺癌变免疫微环境,即浸润到乳腺癌变组织内部的免疫细胞及其所分泌的细胞因子等与癌变细胞共同构成的局部内环境,对癌变细胞的生长、增殖及转移有着重要调控作用。浸润的免疫细胞主要成分包括T细胞、B细胞、巨噬细胞、自然杀伤细胞及树突细胞,其中T细胞比例约占80%,发挥主导作用。具有免疫活性的T细胞按照功能和表面标志物的不同,可以分为CD8+细胞毒性T淋巴细胞(CTL)及CD4+辅助性T淋巴细胞(包括Th1、Th2、Th17和Treg细胞4个细胞亚群)。在肿瘤免疫应答中,CD8+CTL是抗肿瘤免疫的关键效应细胞,其识别肿瘤细胞表面的主要组织相容性复合体(MHC)Ⅰ型分子-肿瘤抗原肽复合物后,在Th1细胞分泌的白细胞介素(IL)-2、γ-干扰素(IFN-γ)等细胞因子作用下,进而被激活并增殖分化为具有特异性杀伤活性的效应CTL,激活穿孔素颗粒酶介导的细胞毒途径及细胞凋亡因子(Fas)/Fas配体(FasL)介导的细胞凋亡途径,效应CTL释放孔素和颗粒酶,穿孔素使肿瘤细胞的膜溶解而形成孔洞,然后颗粒酶进入细胞,引起DNA断裂,使肿瘤细胞死亡。CTL通过表达细胞凋亡相关膜表面分子Fas和肿瘤细胞表面FasL结合,从而诱导肿瘤细胞死亡。见图1。Mahmoud等〔8〕对1 300余例乳腺癌患者评估CD8+T细胞的预后意义,结果显示CD8+细胞毒性T淋巴细胞总数与较高的肿瘤分级相关,并与患者的生存率改善相关。CD4+T细胞亚群Th1、Th2、Th17、Treg及其相关细胞因子及Th1/Th2和Th17/Treg两个稳态平衡在肿瘤免疫微环境中发挥关键作用,对乳腺癌变的发生、发展及预后都至关重要。
1.1Th1/Th2免疫失衡与乳腺癌变 CD4+T细胞在肿瘤抗原提呈细胞(APC)表面MHCⅡ型分子提呈的肿瘤抗原刺激下,分化为Th1和Th2细胞。Th1细胞通过分泌IL-2、IFN-γ细胞因子使CD8+T细胞活化和增殖,促进细胞免疫,其自身也可通过分泌大量的肿瘤坏死因子(TNF)-α直接发挥肿瘤杀伤作用,而对正常细胞则无明显毒性。肿瘤免疫主要指细胞免疫,Th1细胞介导的细胞免疫应答可以有效地抑制肿瘤发生发展。Th2细胞通过分泌IL-4、IL-6及IL-10等细胞因子促进B细胞增殖、分化、成熟和抗体生成,促进体液免疫应答。Th1/Th2指的是功能不同的Th细胞亚群Th1与Th2之间所存在的平衡,Th1/Th2比值在肿瘤患者和其他疾病时发生改变,肿瘤患者血液和肿瘤组织中Th2细胞的数量往往超过了Th1细胞,细胞免疫不能有效激活,以细胞免疫为主的抗肿瘤免疫反应受到抑制,从而使癌变细胞得以生存,促进恶性肿瘤发生、进展。研究发现〔9〕,在人乳腺癌及乳腺癌动物模型的乳腺癌变组织中,间质浸润的Th2细胞数量大大多于Th1细胞,Th1/Th2免疫平衡被打破,Th1向Th2飘移,机体细胞免疫受到抑制。
1.2Th17/Treg免疫失衡与乳腺癌变 Th17细胞通过特异性转录因子维甲酸相关孤儿受体(ROR)γt调控细胞因子IL-17的分泌,启动、维持和促进肿瘤生长。研究发现,Th17细胞在乳腺癌微环境中的聚集在肿瘤的早期阶段,随着肿瘤的进展,Th17呈进一步聚集的态势〔9〕。Treg细胞是一群具有免疫抑制功能的T细胞,其特异性表达转录因子叉头框蛋白(FOX)P3,FOXP3在Treg的分化发育及其介导的肿瘤免疫逃逸中发挥关键作用,因而是鉴别肿瘤微环境中Treg的有效靶标〔10〕。研究表明,Treg在乳腺癌患者外周血和肿瘤组织中过量增加,介导的免疫逃逸在乳腺癌的发生发展过程中发挥着重要作用〔11,12〕。Treg能够通过多种途径抑制CD8+T淋巴细胞的活化、增殖和功能,诱导CD8+T淋巴细胞凋亡,抑制机体抗肿瘤免疫。Treg能分泌IL-10,IL-10是一类强有力的抑制性细胞因子,在对抗Th1介导的免疫应答中作用十分突出。Vizio等〔13〕发现Treg细胞参与Th17启动的癌变过程。如果Th17/Treg平衡遭到打破,则出现免疫耐受、肿瘤进展、淋巴转移等〔14〕。Th17/Treg免疫失衡可能是乳腺癌变的一个启动因素,与病理分化程度及患者预后明显相关〔11〕。
2 PD-1/PD-L1与PI3K/AKT交叉对话在乳腺癌变免疫微环境中的作用
PD-1/PD-L1信号通路的激活可介导免疫抑制性乳腺癌变微环境形成,在乳腺癌的发生、发展、侵袭以及转移中发挥重要作用〔15〕。PD-1表达于乳腺癌变周围浸润的CD8+T淋巴细胞表面,PD-L1异常高表达于乳腺癌变细胞表面,PD-1与PD-L1特异性结合后,通过PD-1胞质区的免疫受体酪氨酸转换基序(ITSM)募集磷酸酶(SHP)-2,引起下游蛋白激酶PI3K的去磷酸化,抑制下游AKT通路的活化,进而抑制CD8+T细胞的正常活化、增殖及细胞因子的分泌,促进活化的CD8+T细胞凋亡,介导癌变细胞逃避CD8+T细胞的杀伤,最终实现癌变细胞的免疫逃逸。PD-1/PD-L1信号通路在肿瘤发生免疫逃逸过程中的关键作用,为肿瘤免疫治疗的药物研发提供理论依据,PD-1/PD-L1抑制剂成为近年来肿瘤免疫治疗研究的最大热点。PD-1/PD-L1抑制剂可以阻断T细胞PD-1与癌变细胞PD-L1的结合,解除免疫抑制,使CD8+T细胞恢复活性,增强免疫应答,识别并杀伤癌变细胞。目前Nivolumab、Pembrolizumab、Atezolizumab等多个抗PD-1或PD-L1抗体被美国食品药品监督管理局(FDA)批准用于肿瘤治疗,临床证实在非小细胞肺癌、黑色素瘤、乳腺癌、胃癌等多种肿瘤中疗效显著〔16〕。

图1 乳腺癌变免疫微环境〔15〕
PI3K/AKT信号转导通路异常活化在乳腺癌变过程中起着非常重要作用,PI3K作为联系胞外信号与细胞应答效应的桥梁分子,在一系列上游或旁路信号分子的影响下,作用于AKT及其下游信号分子,控制乳腺癌变中至关重要的细胞生物学过程,包括细胞增殖、凋亡、细胞周期、血管形成等〔4,5〕。研究发现PI3K/AKT信号通路通过影响癌变免疫微环境中CD8+T细胞的活性及癌变细胞PD-L1的表达参与癌变免疫抑制微环境的形成,进而促进肿瘤发生发展,如果阻断PI3K/AKT信号通路,可下调癌变细胞表面PD-L1表达,解除患者的免疫抑制状态,促进患者机体免疫功能恢复,提高患者抗肿瘤固有的免疫效应〔17,18〕。抑癌基因PTEN的缺失可导致PI3K/AKT通路激活,进而增强PD-L1 mRNA的转录〔19〕。激活NF-κB也可以促进PD-L1 mRNA转录〔20〕。肿瘤微环境中CD8+T细胞产生IFN-γ参与PD-L1表达的上调〔21〕。见图2。
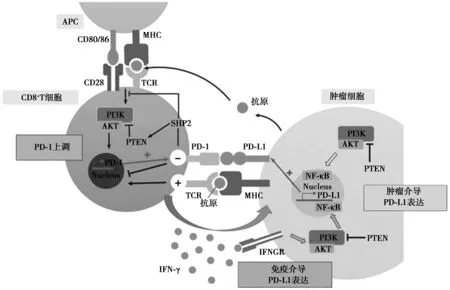
图2 PD-1/PD-L1与PI3K-AKT信号通路在乳腺癌变免疫微环境中的交叉对话〔22〕
3 研究展望
免疫微环境是乳腺癌发生、进展的关键因素,PD-1/PD-L1与PI3K-AKT信号通路间的相互作用介导了乳腺癌免疫抑制微环境的形成,对于乳腺癌的发生与发展具有重要的意义,以PD-1/PD-L1与PI3K-AKT信号通路为治疗靶点的免疫治疗为乳腺癌治疗开辟了新的道路。由于乳腺癌发生、发展受复杂信号通路网络调控,虽然乳腺癌变PD-1/PD-L1与PI3K-AKT信号通路间的交叉对话取得了很大进展,但仍有许多问题需要解决,如两通路抑制剂是否对控制乳腺癌变有协同作用,随着对两通路交叉对话的分子生物学机制的深入研究,期望靶向两通路交叉对话的抑制剂将会在乳腺癌治疗中发挥巨大作用。
