卒中后发作性运动障碍1例报告
2022-02-14王茜茜沈翔桂雅星王国栋吴云成
王茜茜,沈翔,桂雅星,王国栋,吴云成
1 病例介绍
患者男性,60岁。2021年8月17日因“步行后头昏10个月,伴频发活动后左侧肢体僵直半个月”入院。患者于2020年10月开始频繁出现步行后头昏,伴头重脚轻感,全身无力,不伴视物旋转、恶心呕吐、耳鸣、肢体抽搐等,休息后可好转。于2020年12月前往复旦大学附属中山医院就诊,诊断为多发腔隙性脑梗死,具体用药不详,后患者未复诊。半月前患者出现频繁发作性左侧肢体由远端至近端的僵直,发作时左侧肢体伸直体位,上肢显著,每次持续数秒后自行好转,最长不超过30 s,频繁时每小时发作数十次,发作时全程意识清醒能回忆,站立后发作次数增加,坐、卧位休息时发作次数减少,自诉发作前有不适预感,不伴疼痛,不伴肢体无力,无肢体麻木、肢体抽搐及二便失禁,不伴发作时摔倒,发作结束后活动自如。为求进一步治疗,以“癫痫部分性发作待查”收入我院。
既往史:患者高血压病史1年余,血压最高200/100 mmHg(1 mmHg=0.133 kPa),长期规律口服硝苯地平控释片(30毫克/次,1次/日)和培哚普利吲达帕胺片(1.5粒/次,1次/日),自诉血压控制在130/80 mmHg左右。糖尿病病史6年余,口服二甲双胍(0.25克/次,3次/日),空腹血糖控制在6 mmol/L左右。吸烟史30年,30支/天,已戒烟6月余。否认饮酒史。否认家族遗传病史,否认脑梗死、脑出血、癫痫家族史。
入院查体:血压140/90 mmHg,神志清楚,言语流利,精神可。双肺呼吸音清,未闻及干、湿啰音。心率80次/分,律齐。颈软,双侧瞳孔等大等圆,对光反射灵敏,眼球活动正常,未见眼震,双侧额纹及鼻唇沟对称,伸舌居中。四肢肌力5级,四肢肌张力正常。四肢腱反射正常,病理征阴性,深浅感觉及共济运动无异常。NIHSS 0分,GCS 15分。
实验室检查:血常规、二便常规、肝肾功能、凝血常规、D-二聚体、电解质、甲状腺功能、乙型肝炎表面抗体、丙型肝炎抗体、抗HIV抗体、抗梅毒螺旋体抗体等未见明显异常,TG 1.38 mmol/L,TC 2.80 mmol/L,HDL-C 0.85 mmol/L↓,LDL-C 1.70 mmol/L。空腹血糖5.31 mmol/L,糖化血红蛋白6.3%↑。
血管超声检查(2021-08-17):双侧颈动脉硬化伴左侧斑块形成,双侧下肢动脉硬化伴斑块形成。
头颅MRI检查(2021-08-19):右外侧膝状体旁病变[DWI序列高信号(图1A),T2FLAIR序列高信号(图1B),ADC序列低信号(图1C)],提示近期腔隙性脑梗死。
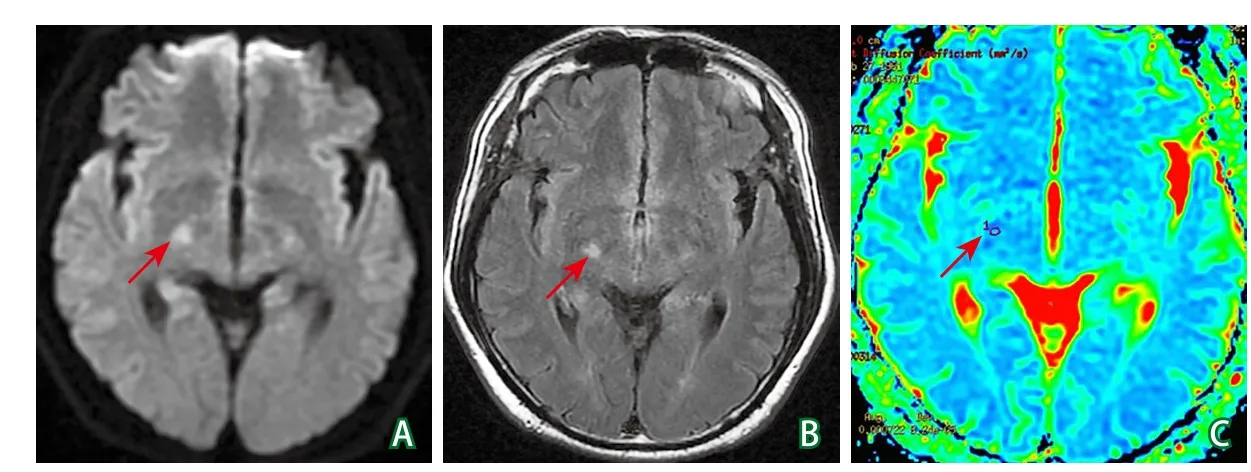
图1 发作性运动诱发性运动障碍患者头颅MRI平扫检查结果
颈部及头颅CTA检查(2021-08-19):右侧颈内动脉海绵窦段管壁见钙化斑块,管腔未见狭窄;右侧椎动脉V5段较对侧纤细(图2A);双侧颈内动脉颅内段粥样硬化性改变(图2B)。
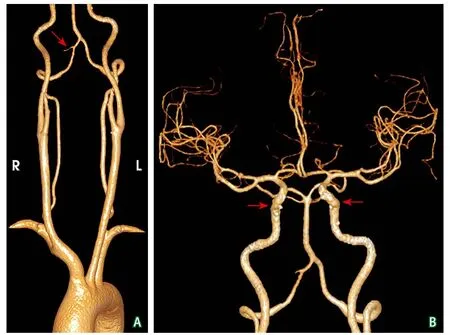
图2 发作性运动诱发性运动障碍患者CTA检查结果
脑电图及24 h动态脑电图检查(2021-08-22):未见明显癫痫波(行脑电图检查期间患者诉有多次左侧肢体僵直发作)。
肌张力障碍相关基因测序检查(2021-08-26):EIF4G1基因外显子24中A>G的杂合突变,临床意义不明。
诊疗经过:入院后给予阿司匹林(100毫克/次,1次/日)+氯吡格雷(75毫克/次,1次/日)抗血小板聚集,阿托伐他汀(10毫克/次,1次/晚)调节血脂稳定斑块,硝苯地平控释片(30毫克/次,1次/日)、培哚普利吲达帕胺片(1.5粒/次,1次/日)降压,二甲双胍(0.25克/次,3次/日)降糖,补液等治疗。每日生命体征及血糖监测结果提示血压控制在130/80 mmHg左右,空腹血糖控制在6 mmol/L左右。基于此治疗,患者诉左侧肢体僵直症状较前加重,表现为每次发作僵直持续时间较入院前长,但仍不超过30 s。予以强化他汀治疗后仍无明显改善,遂于8月22日调整治疗方案为低分子肝素(0.4毫升/次,1次/日)皮下注射抗凝+阿司匹林口服(100毫克/次,1次/日)抗血小板聚集,瑞舒伐他汀调节血脂、稳定斑块治疗,患者僵直发作症状仍无明显改善。后于8月24日加用卡马西平(0.1克/次,2次/日)治疗,患者当天上午口服卡马西平后,自诉下午左侧肢体僵直症状明显改善,表现为发作频率显著减少。考虑诊断为卒中相关的发作性运动障碍(paroxysmal dyskinesia,PxDs),口服卡马西平后症状明显控制。
随访:出院1个月后门诊面对面随访,患者继续口服卡马西平(0.1克/次,2次/日)治疗,无僵直发作。患者出院后曾自行停用卡马西平一次,后再次出现僵直症状发作,遂继续原剂量口服卡马西平治疗。
最终诊断:
发作性运动障碍
腔隙性脑梗死
原发性高血压3级(极高危)
2型糖尿病
动脉粥样硬化(颅内、颈部及下肢动脉)
2 讨论
从发作形式和特点上看,此例患者为站立动作后容易诱发的左侧肢体偏侧肌张力障碍,发作前有不适预感,发作时意识清醒,发作时间不超过30 s,频繁时每小时发作几十次,发作间歇期未发现异常神经系统体征,口服卡马西平后患者自觉症状明显改善,提示PxDs的可能。同时,患者的甲状腺功能指标、微量元素、血糖监测结果未见异常。头颅MRI提示右侧丘脑底核附近急性脑梗死,DWI序列上为高信号,ADC序列上为低信号。肌张力障碍相关基因测序未发现相关基因变异。因此,考虑诊断为卒中后继发的PxDs[1-2],结合发作形式和发作时间等特点,考虑为卒中后继发性发作性运动诱发性运动障碍(paroxysmal kinesigenic dyskinesia,PKD)可能性大[3-5]。该例患者发作期脑电图未见癫痫波,发作前有站立诱因,发作时意识清醒,暂不考虑癫痫的诊断。该例患者脑梗死病灶位于右侧丘脑底核附近,责任血管考虑为脉络膜后动脉,与既往文献报道的卒中后出现运动障碍的患者病因多为小血管闭塞,梗死部位多位于脑组织深部相似[6]。文献报道,在继发性PxDs中,肌张力障碍是最常见的不自主运动类型,大多单侧分布[4]。一项纳入76例PxDs患者的研究发现,继发性PxDs患者有17例(22%),其中4例为卒中后继发。值得注意的是,该报道中的4例继发性PxDs患者运动障碍最早出现在卒中发病后3年,最晚出现于卒中后6年[7]。该例患者在卒中急性期即出现PKD症状,从时序关系上更提示其卒中与PKD之间存在联系。
既往文献指出,基底节丘脑皮质环路在卒中后运动障碍的产生中可能发挥着重要作用,涉及壳核、内侧苍白球、黑质网状部、外侧苍白球、丘脑底核等部位[8-11]。该例患者梗死灶位于右侧丘脑底核附近,推测是卒中发生后基底节丘脑皮质环路功能受到影响,从而导致运动障碍的出现。该例患者在出院1个月随访时继续口服卡马西平(0.1克/次,2次/日)治疗,自诉服药情况下无僵直发作。从既往文献报道看,有的卒中后运动障碍患者的不自主运动症状在出现2周后可自行缓解,1年随访时超过80%的患者可部分或完全缓解[6],本文报道的患者在出院1个月(即症状出现2个月)时药物治疗效果良好,中途停用卡马西平后再次出现僵直症状发作,还需进一步随访。
卒中后继发的PxDs并不多见,PKD更为罕见,容易被误诊为癫痫,但是早期识别后治疗效果好,能够显著改善患者的生活质量。因此,了解PxDs的临床特点、诊断标准及鉴别诊断要点对于诊治卒中后PKD尤为重要。同时,对于新发现的PxDs,应完善相关检查,进行基因筛查,同时排查继发性因素,及早开展针对原发疾病的治疗。
