一株白骨壤内生真菌亮白曲霉CW5-7代谢产物主成分及其抗氧化活性研究
2022-02-13阮加陈杨光乐周宇豪王勋铭庄君茹
许 莉,阮加陈,杨光乐,周宇豪,王勋铭,庄君茹,张 岗*
(1.厦门医学院 厦门市海洋药用天然产物资源重点实验室,福建 厦门 361023;2.厦门医学院 天然化妆品福建省高校应用技术工程中心,福建 厦门361023)
红树林微生物因其独特的生态特征、生物多样性及丰富的次级代谢产物类型,成为海洋药物研究的重点领域之一[1]。曲霉属真菌是红树林微生物的重要成员,也是发现先导化合物的重要资源[2-3]。作者利用涂布法从厦门红树林植物白骨壤根部分离得到1株内生真菌,通过测定ITS序列对该菌株进行鉴定,对菌株在大米培养基中的代谢产物进行分离纯化,通过波谱学数据分析对主成分结构进行鉴定,并对其抗氧化活性进行评价。
1 实验
1.1 材料、试剂与仪器
白骨壤根,采自厦门市龙舟池风景区,经厦门医学院鲍红娟副教授鉴定为马鞭草科植物白骨壤(Avicenniamarina)的根。
马铃薯葡萄糖琼脂(PDA)培养基,青岛海博生物;总抗氧化能力检测试剂盒(FRAP法),碧云天公司;超氧阴离子清除能力检测试剂盒,索莱宝公司;色谱用甲醇,Sigma公司;其余试剂均为国产分析纯。
1260 infinity系列分析及制备型高效液相色谱仪,美国Agilent公司;分析及半制备反相YMC Pack ODS-A 色谱柱(250 mm×5 mm,5 μm;250 mm×10 mm,5 μm,),日本YMC公司;AV-500型超导核磁共振波谱仪,Bruker公司;Q Exactive Focus 组合型四极杆Orbitrap质谱仪,赛默飞世尔科技有限公司;钙流检测工作站(Molecular Device FlexStation 3型酶标仪)。
1.2 培养基
PDA培养基:取商品化PDA培养基粉末适量,按说明书配制,灭菌后稍冷却,无菌条件下取适量倒入培养平板中,冷却,备用。
大米培养基:取10份大米,每份90 g,分别置于10个500 mL容量瓶中,加入120 mL纯化水,115 ℃灭菌后,冷却,备用。
1.3 内生真菌的分离
将白骨壤根洗净,用无菌棉球吸干水分;在超净工作台中用无菌小刀将白骨壤根切成长度为4 cm的小段,先用75%乙醇浸泡10 s,再用次氯酸钠溶液(40 mg·L-1) 消毒30 s,最后用无菌水漂洗4次,剪去两端褐变部分,将中间部分剪成0.5 cm左右小段,用无菌棉球吸干表面的水分;将样品剪碎置于无菌研钵中,加入5 mL无菌水,研磨,吸取研磨溶液200 μL涂布于PDA培养基中,26 ℃下倒置培养5~7 d,做3次重复实验。为验证表面消毒效果,实验中设置漂洗(最后一次漂洗材料的无菌水涂布于PDA双抗培养基)和印记(最后一次消毒材料的外表面印记于PDA双抗培养基)2个对照组。待平板上长出各种形态的菌落后,用接种针挑取不同形态的单菌落分别以平板划线法接种于PDA培养基中,做好标记,26 ℃培养箱中培养5~7 d后,观察菌落形态,挑取单菌落菌丝体,重复以上操作,直至获得纯单菌落,编号为 CW5-7。
1.4 内生真菌的鉴定
收集分离得到的内生真菌CW5-7菌丝体,送美吉生物公司进行测序。扩增引物为:ITS4,5′-TCCTCCGCTTATTGATATGC-3′;ITS5,5′-GGAAGTAA-AAGTCGTAACAAGG-3′。将内生真菌CW5-7的ITS序列在NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行BLAST比对,选择并下载同源性最高的数条序列。使用Clustal软件对搜集的序列进行多序列比对,根据比对结果使用MEGAX软件采用邻接法构建系统进化树,Bootstrap分析中使用1 000次重复计算系统进化树的支持率。
1.5 代谢产物主成分的分离与鉴定
1.5.1 内生真菌的大规模培养
无菌环境下,将内生真菌CW5-7接种于灭菌的大米培养基中,置于25 ℃恒温培养箱中培养1个月后,加入500 mL乙酸乙酯,终止菌株生长。
1.5.2 主成分的分离
将内生真菌CW5-7在大米培养基中的代谢产物捣碎后,用乙酸乙酯浸泡7 d,过滤,收集滤液,备用。向每瓶代谢产物中加入500 mL乙酸乙酯,同法提取,滤液合并后用旋转蒸发仪于40 ℃下减压回收溶剂,得提取物10.4 g。取少量提取物用甲醇溶解成浓度为5 mg·mL-1溶液,进行HPLC分析,初步确定提取物主成分类型及含量。色谱分析条件:梯度洗脱,甲醇体积分数从5%升至100%,流速0.8 mL·min-1,进样量5 μL,检测波长230 nm,分析时间30 min。
将其余提取物过反相固相萃取柱,分别用体积分数10%、30%、50%、70%、100%甲醇洗脱,每次洗脱液颜色变淡时更换下一体积分数甲醇,洗脱液用旋转蒸发仪于40 ℃下减压回收溶剂,得相应各洗脱部位F1~F5。30%甲醇洗脱部位(F2)经半制备HPLC进一步分离,得化合物Ⅰ(7 mg)及化合物Ⅱ(6 mg),分离条件为:40%甲醇等度洗脱,流速2.0 mL·min-1。
1.5.3 结构鉴定
采用核磁共振氢谱(1HNMR)、核磁共振碳谱(13CNMR)及高分辨质谱(HR-ESI-MS)对化合物Ⅰ、Ⅱ的结构进行鉴定。
1.6 代谢提取物及主成分的抗氧化活性评价
1.6.1 总抗氧化能力的测定
(1)
式中:c1为对应Fe2+浓度,mmol·L-1;c2为样品溶液浓度,mg·mL-1。
1.6.2 超氧阴离子自由基清除能力的测定
取上述样品溶液,按试剂盒说明方法测定样品的超氧阴离子自由基清除能力;以VC 为阳性对照,清除率按式(2)计算:
(2)
2 结果与讨论
2.1 内生真菌的鉴定
内生真菌CW5-7的ITS序列测试结果如下:
CATTACCGAG TGAGGGTTTC TCTGAAGCCC
免疫接种具有不可替代的作用,然而因重视程度不足,导致很多羊养殖户存在侥幸心理,认为加强饲养管理即可。然而,一部分致病原在不同因素的作用下会导致羊患病[3]。
AACCTCCCAC CCGTGTATAC CGTACCCTGT
TGCTTCGGCG GGCCCGCCTC ACGGCCGCCG
GGGGACCTCG CGTCCCCGGG CCCGCGCCCG
CCGAAGACCC CAACACGAAC ACTGTCTGAA
AAGTGCAGTC TGAGTCGATT GTTACCAATC
AGTCAAAACT TTCAACAATG GATCTCTTGG
TTCCGGCATC GATGAAGAAC GCAGCGAAAT
GCGATAACTA ATGTGAATTG CAGAATTCAG
TGAATCATCG AGTCTTTGAA CGCACATTGC
GCCCCCTGGT ATTCCGGGGG GCATGCCTGT
CCGAGCGTCA TTGCTGCCCT CAAGCACGGC
TTGTGTGTTG GGCCCCGTCC CCGGTACCCC
CGGGGACGGG CCCGAAAGGC AGCGGCGGCA
CCGCGTCCGG TCCTCGAGCG TATGGGGCTT
TGTCACCCGC4 TCTGCAGGCC CGGCCGGCGC
CAGCCGACCA ACCCAACCAT TTTTTACAGG
TTGACCTCGG ATCAGGTAGG GATACCCGCT
GAACTTAAGC ATATCAATAA
根据测序结果进行序列比对、构建系统进化树,结果如图1 所示。
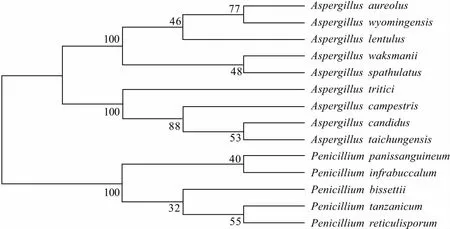
图1 内生真菌CW5-7的系统进化树Fig.1 Phylogenetic tree of endophytic fungus CW5-7
从图1可以看出,内生真菌CW5-7与A.candidus高度同源(同源性100%),可判断内生真菌CW5-7为亮白曲霉(A.candidus)。
2.2 代谢提取物的 HPLC 分析(图2)
从图2可以看出,亮白曲霉 CW5-7 在大米培养基中的代谢提取物包括 2 个主成分,其保留时间分别为22.3 min 和 24.1 min。2 个主成分的紫外光谱(图3)相似,峰位均在250~300 nm 处,提示为对三联苯类化合物。
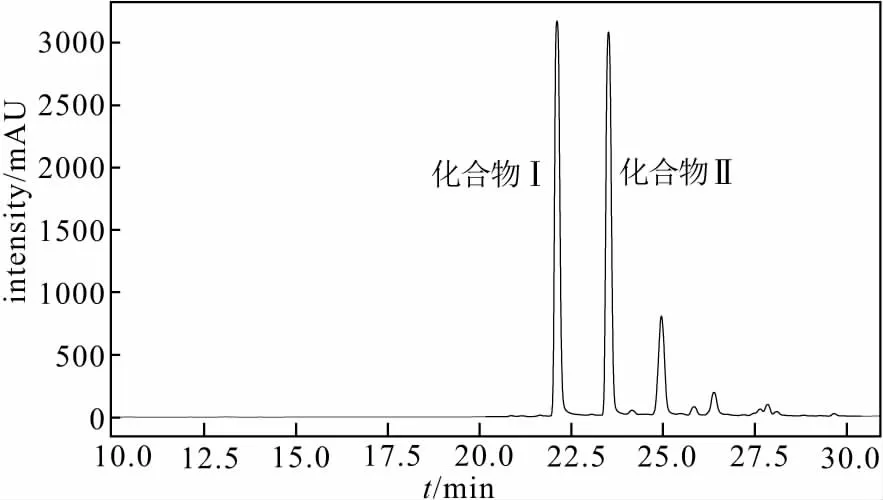
图2 亮白曲霉CW5-7 代谢提取物的 HPLC图谱Fig.2 HPLC spectrum of metabolic extracts of Aspergillus candidus CW5-7

图3 化合物Ⅰ、Ⅱ的紫外光谱Fig.3 UV spectra of compounds Ⅰ and Ⅱ
2.3 结构鉴定
采用反相固相萃取法初步分离CW5-7在大米培养基中的代谢产物,发现对三联苯类化合物主要集中在 30%甲醇洗脱部分,采用半制备 HPLC 进一步分离,得到 2 个对三联苯类化合物单体,其理化性质及波谱学数据如下:
化合物Ⅰ:白色无定形粉末,FeCl3反应显阳性。HR-ESI-MS,m/z:393.039 8[M+Na]+;1HNMR (500 MHz,CD3OD),δ:7.10(1H,d,J=2.0 Hz),6.96(1H,dd,J=8.0 Hz、2.0 Hz),6.84(1H,d,J=8.0 Hz),6.82(1H,d,J=2.0 Hz),6.80(1H,d,J=8.0 Hz),6.70(1H,dd,J=8.0 Hz、2.0 Hz),6.69(1H,d,J=2.0 Hz),3.67(3H,s),3.41(3H,s);13CNMR (125 MHz,CD3OD),δ:154.84(C-5′),149.18(C-3′),146.06(C-3),145.88(C-4),145.52(C-3″),145.15(C-4″),140.74(C-2′),134.37(C-1′),131.65(C-1),126.94(C-1″),123.75(C-6″),121.53(C-6),119.39(C-2),118.82(C-4′),117.18(C-2),116.24(C-5),115.74(C-5′),104.94(C-6′),60.77(C-2′a),56.47(C-5′a)。以上数据与文献[4]报道的 3,3″-dihydroxyterphyllin基本一致,故确定化合物Ⅰ为 3,3″-dihydroxyterphyllin。
化合物Ⅱ:白色无定形粉末,FeCl3反应显阳性。HR-ESI-MS,m/z:355.116 3 [M+H]+;1HNMR (500 MHz,CD3OD),δ:7.47(2H,d,J=8.5 Hz),6.86(2H,d,J=8.5 Hz),6.82(1H,d,J=2.0 Hz),6.80(1H,d,J=8.0 Hz),6.70(1H,dd,J=8.0 Hz、2.0 Hz),6.43(1H,s),3.68(3H,s),3.38(3H,s);13CNMR (125 MHz,CD3OD),δ:157.96(C-4),154.95(C-5′),149.24(C-3′),145.54(C-3″),145.18(C-4″),140.80(C-2′),134.31(C-1),131.63(C-2,6),131.06(C-1′),126.93(C-1″),123.75(C-6″),119.40(C-2″),118.94(C-4′),116.11(C-3,5),115.75(C-5″),104.91(C-6′),60.75(C-2′a),56.49(C-5′a)。以上数据与文献[5]报道的3-hydroxyterphyllin 基本一致,故确定化合物Ⅱ为 3-hydroxyterphyllin。
化合物Ⅰ、Ⅱ的结构式如图4所示。
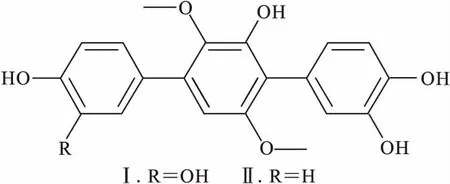
图4 化合物Ⅰ、Ⅱ的结构式Fig.4 Structural formulas of compounds Ⅰand Ⅱ
2.4 代谢提取物及主成分的抗氧化活性
代谢提取物及主成分的总抗氧化能力及超氧阴离子自由基清除能力分别如图5、图6所示。

图5 代谢提取物及主成分的总抗氧化能力Fig.5 Total antioxidant capacity of metabolic extracts and principal components
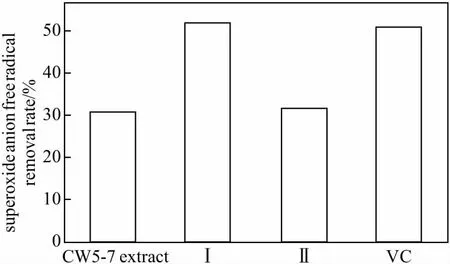
图6 代谢提取物及主成分对超氧阴离子自由基的清除能力Fig.6 Superoxide anion free radical scavenging ability of metabolic extracts and principal components
从图5可以看出,在浓度0.1 mg·mL-1下,代谢提取物、化合物Ⅰ和Ⅱ的总抗氧化能力分别为4.6 mmol·g-1、11.2 mmol·g-1、10.3 mmol·g-1,化合物Ⅰ的总抗氧化能力最强,化合物Ⅰ、Ⅱ的总抗氧化能力均优于阳性药物Trolox(7.3 mmol·g-1)。
从图6可以看出,在相同浓度(0.1 mg·mL-1)下,代谢提取物、化合物Ⅰ和Ⅱ对超氧阴离子自由基的清除率分别为30.8%、52.4%、32.2%,化合物Ⅰ清除超氧阴离子自由基能力与VC(51.0%)相当。表明,亮白曲霉CW5-7代谢提取物及主成分化合物Ⅰ和Ⅱ具有较强的抗氧化活性。
3 结论
从厦门红树林植物白骨壤根部分离得到1株亮白曲霉CW5-7, 该曲霉在大米培养基中能够大量代谢产生2个对三联苯类化合物3,3″-dihydroxyterphyllin(Ⅰ)和 3-hydroxyterphyllin(Ⅱ)。对三联苯是自然界中一大类成分,已经从微生物等生物样本中分离得到了诸多类似物[6]。该类化合物具有很多生物活性,如神经保护、免疫抑制性[7]及细胞毒性[8]等。本研究发现亮白曲霉CW5-7代谢提取物及化合物Ⅰ和Ⅱ具有较强的抗氧化活性,在化妆品等领域具有潜在的应用价值。
